低温胁迫对戊唑醇包衣高粱种子出苗和幼苗生理生化的影响
2020-05-14龙海江向晓龙任明见吴传玺胡安龙
樊 娟,龙海江,向晓龙,任明见, ,吴传玺,胡安龙,2*
(1.贵州大学农学院,贵阳 550025;2.贵州大学作物保护研究所,贵阳 550025;3.国家小麦改良中心贵州分中心,贵阳 550025;4.遵义市桐梓县贵梁农业发展有限公司,贵州 遵义 563200)
高粱因抗旱性、耐贫瘠及耐高温特性而广泛种植,且生物学产量较高,是我国重要的资源作物之一[1]。在生产实践中,春季高粱低温冷害问题频发,当环境温度低于10 ℃时抑制高粱种子萌发、出苗及光合作用[2-3]。
近年来,种子包衣技术在农业种植中应用广泛。戊唑醇作为三唑类广谱杀菌剂,可包衣小麦种子以防治小麦赤霉病[4],也可处理玉米种子以防治玉米瘤黑粉病及丝黑穗病[5]。但种衣剂不合理使用致植株产生药害时有发生[6-7]。王雅玲等指出,在低温胁迫下,戊唑醇包衣玉米种子促进由低温胁迫导致的过氧化作用及叶绿素分解,使植株低温冷害加剧[8]。Wang 等研究发现,低温胁迫条件下,Hanyubaomu 和Miaoboshi 包衣对水稻种子萌发及幼苗生长均无明显促进作用[9]。研究表明,合理使用抗寒种衣剂可减轻低温胁迫对水稻[10]及棉花[11]的伤害。Guan 等研制一种含水杨酸可凝胶涂层,可用于玉米种子包衣以增强其抗寒性[12]。低温胁迫对种衣剂处理高粱种子的影响研究尚未见报道。因此,本文以适宜温度为对照,研究低温胁迫对戊唑醇包衣高粱种子萌发及幼苗生理特性的影响,以期对高粱种衣剂研制及安全合理使用提供理论依据。
1 材料与方法
1.1 材料
高粱种子:红缨子,由桐梓县贵梁农业发展有限公司提供。
供试药剂:60 g·L-1戊唑醇悬浮种衣剂,购自拜耳作物科学(中国)有限公司。
1.2 方法
1.2.1 试验设计
将经蒸馏水分选的高粱种子在0.1%多菌灵中浸泡20 min 后用无菌水洗净,自然晾干后包衣。戊唑醇种衣剂包衣设0.06 g ai·kg-1种子(A)、0.12 g ai·kg-1种子(B)、0.24 g ai·kg-1种子(C)、0.48 g ai·kg-1种子(D)4 个处理,以分选杀菌未包衣高粱种子为空白对照(CK)。同时设25 ℃/30 ℃(夜间/白天,下同)、15 ℃/20 ℃、5 ℃/10 ℃、0 ℃/5 ℃4 个不同温度条件处理。每处理高粱种子10 粒,各3次重复,共60盆。种子播于塑料花盆(φ=8 cm、h=10 cm),播种土壤为市购营养黑土(购自吉林省白山市抚松县植源农业科技有限公司)与贵州大学农学院试验田土壤1∶1混合。
2019 年12 月20 日播种后置于人工培养箱内(光照:L∶D=12∶12,相对湿度85%)。将所有处理置于25 ℃条件下培养2 d,种子吸胀萌发后将各处理分别于25 ℃/30 ℃、15 ℃/20 ℃、5 ℃/10 ℃、0 ℃/5 ℃条件培养15 d 后常温(25 ℃/30 ℃)培养3 d恢复,2020年1月10日采集处理。
1.2.2 生理指标测定
发芽率及出苗率测定参照文献[13]试验;叶绿素、根系活力及渗透电导率(DDSJ-11A电导率测定仪)测定参照李小方等方法[14];超氧化物歧化酶含量测定采用邻苯三酚自氧化法[15];过氧化氢酶活性测定采用紫外分光光度计吸收法[16]。
1.3 数据处理
数据取3 次重复平均值,DPS 7.05 作方差分析和差异显著性检验,以α=0.05 为显著性水平。Microsoft Excel 2010软件数据统计分析作图。
2 结果与分析
2.1 低温胁迫对戊唑醇包衣高粱种子萌发及出苗的影响
结果见表1。
由表1可知,低温胁迫使高粱种子发芽率显著降低33%~46.67%,出苗率下降60%~80%,在15 ℃/30 ℃温度条件下,戊唑醇包衣种子与裸种发芽率和出苗率均无显著差异(α=0.05)。在0 ℃/10 ℃温度条件下,戊唑醇包衣显著抑制种子发芽及出苗,且随包衣浓度升高种子发芽率降低,显著降低76.67%;在同等包衣浓度处理条件下,随温度降低发芽率显著降低,但出苗率未受包衣浓度影响。

表1 温度和浓度对戊唑醇包衣高粱种子发芽率及出苗率的影响(7 d内)Table 1 Effects of temperature and concentration on germination rate and seedling emergence rate of tebuconazole-coated sorghum seeds
2.2 低温胁迫对戊唑醇包衣高粱幼苗生长发育的影响
由图1~6可知,低温胁迫对高粱幼苗根长、株高及单株鲜重有较明显的抑制作用,可使其活力指数显著下降(α=0.05)。在25 ℃/30 ℃及15 ℃/20 ℃温度条件下,戊唑醇包衣对高粱幼苗根长、株高、单株鲜重和根重无显著抑制作用,且当戊唑醇包衣浓度为0.06 g ai·kg-1种子时,各项性状较裸种均有提高。在胁迫温度下(5 ℃/10 ℃及0 ℃/5 ℃),随包衣浓度增加,低温胁迫对其根长、株高和单株鲜重抑制作用较显著,可使高粱幼苗活力指数显著下降(α=0.05)。在相同包衣浓度条件下,低温胁迫显著影响高粱幼苗生长,其根长、株高及单株鲜重显著降低,从而使其根冠比和活力指数下降,但对高粱幼苗根重无显著影响(α=0.05)。

图1 温度和浓度对戊唑醇包衣高粱根长的影响Fig.1 Effects of temperature and concentration on root length of tebuconazole-coated sorghum
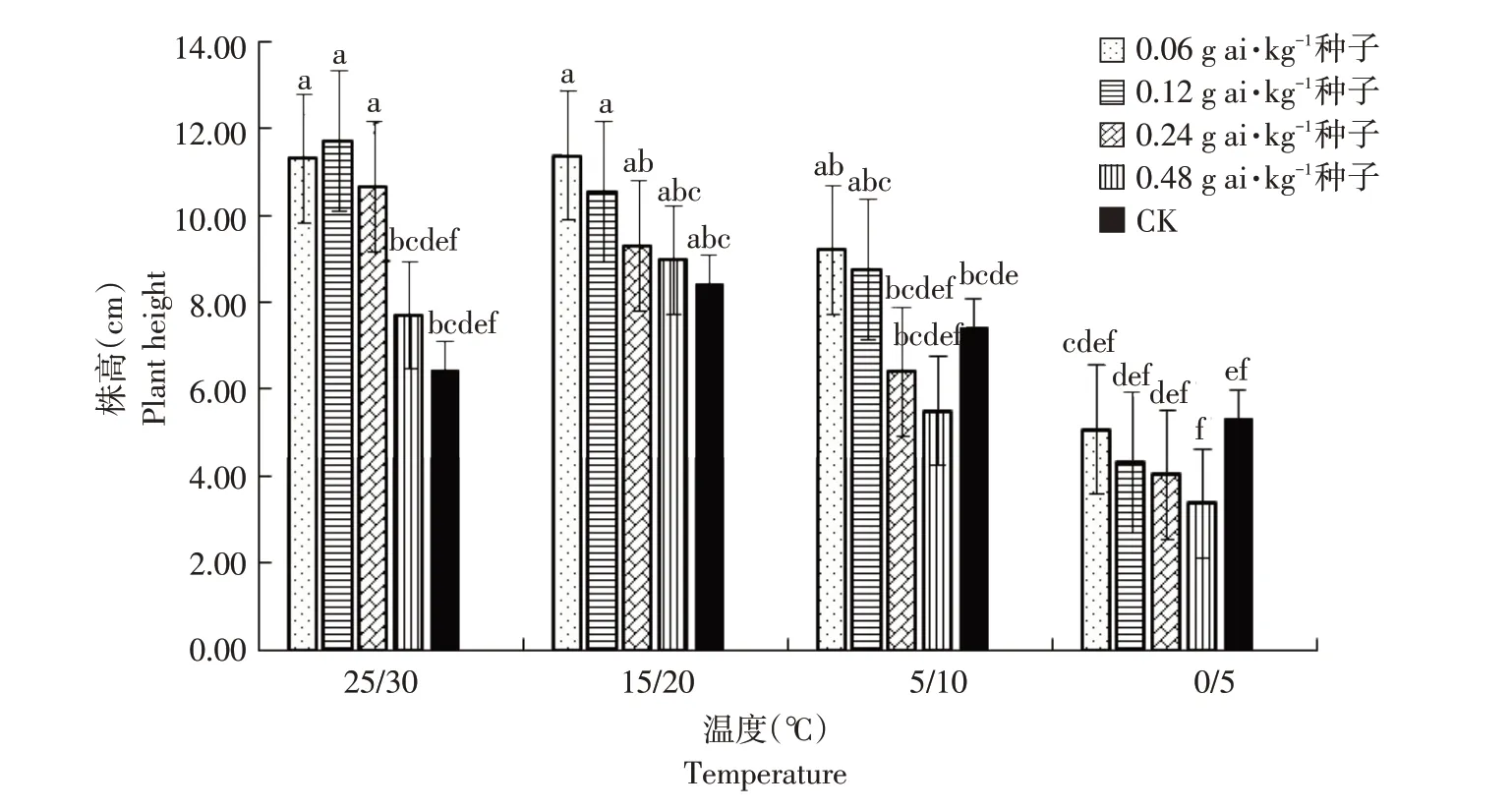
图2 温度和浓度对戊唑醇包衣高粱株高的影响Fig.2 Effects of temperature and concentration on plant height of tebuconazole-coated sorghum
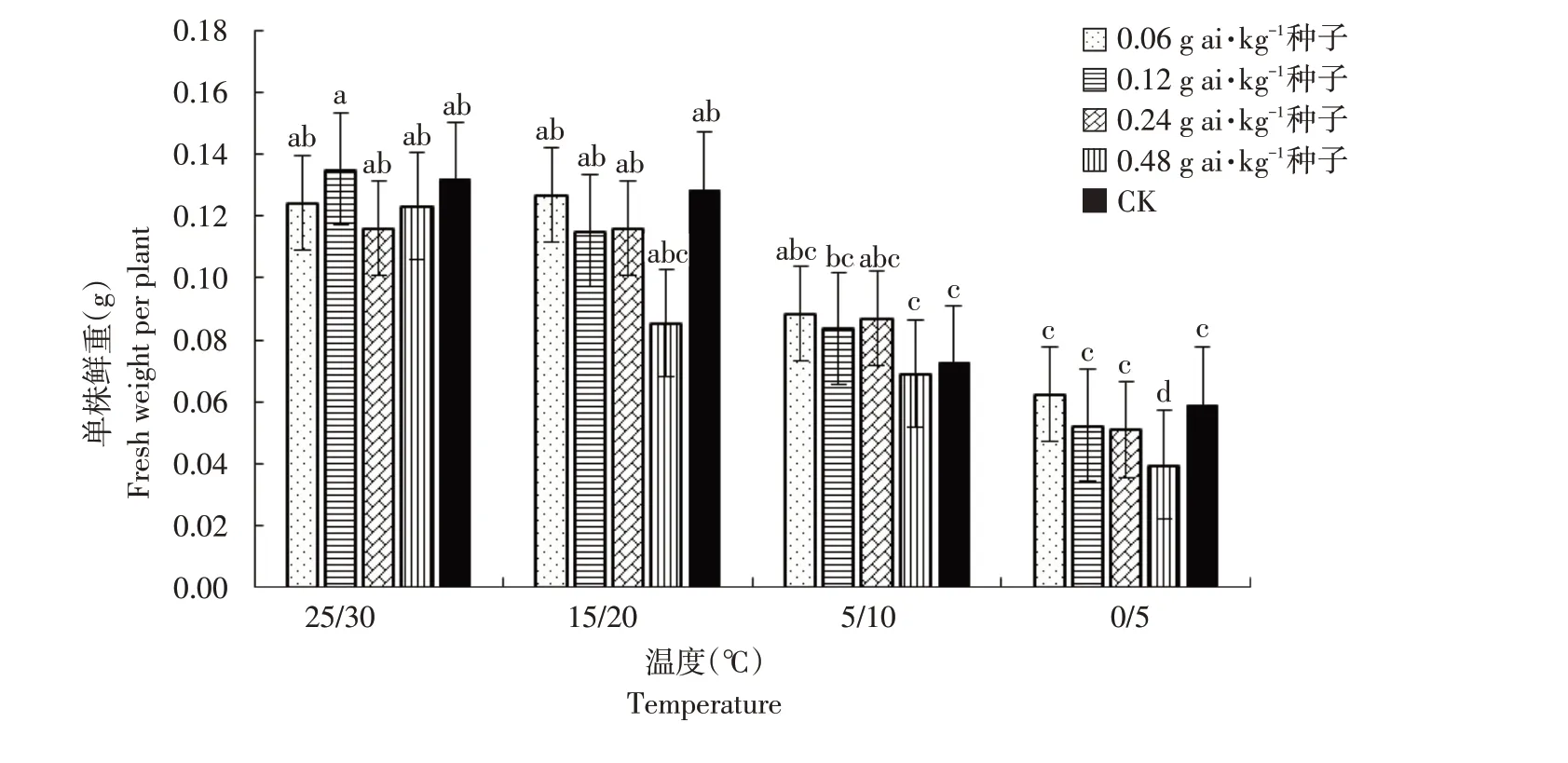
图3 温度和浓度对戊唑醇包衣高粱单株鲜重的影响Fig.3 Effects of temperature and concentration on fresh weight per plant of tebuconazole-coated sorghum

图4 温度和浓度对戊唑醇包衣高粱单株根重的影响Fig.4 Effects of temperature and concentration on root weight per plant of tebuconazole-coated sorghum

图5 温度和剂量对戊唑醇包衣高粱根冠比的影响Fig.5 Effects of temperature and concentration on root-crown ratio of tebuconazole-coated sorghum

图6 温度和剂量对戊唑醇包衣高粱活力指数的影响Fig.6 Effects of temperature and concentration on dynamic index of tebuconazole-coated sorghum
2.3 低温胁迫对戊唑醇包衣高粱幼苗根系活力的影响
由表2可知,在相同戊唑醇包衣浓度下,低温胁迫程度越深,幼苗根系活力差异越大。在25 ℃/30 ℃时,包衣浓度越大根系活力越大,且均与未包衣处理差异显著(α=0.05)。15 ℃/20 ℃时,不同包衣浓度间根系活力差异显著(α=0.05);当包衣浓度为0.06及0.12 g ai·kg-1种子时,幼苗根系活力上升且与裸种差异显著(α=0.05)。胁迫温度5 ℃/10 ℃下,包衣浓度上升,根系活力下降,但差异不显著(α=0.05)。0 ℃/5 ℃时,包衣剂量增加,根系活力下降,但0.06 及0.12 g ai·kg-1种子戊唑醇包衣处理与裸种差异不显著(α=0.05);0.24 和0.48 g ai·kg-1种子戊唑醇包衣高粱根系活力下降,且达显著水平(α=0.05)。
2.4 低温胁迫对戊唑醇包衣高粱幼苗体内叶绿素含量的影响
由图7可知,低温胁迫显著降低高粱幼苗叶绿素含量,且在最低温时达最低。25 ℃/30 ℃时,戊唑醇包衣处理下高粱幼苗叶绿素含量分别为21.30、21.73、21.55 及20.85 mg·g-1,与未包衣处理叶绿素含量19.99 mg·g-1无显著差异(α=0.05),但稍有提高。15 ℃/20 ℃时,未包衣高粱幼苗叶绿素含量为17.37 mg·g-1;戊唑醇包衣处理高粱幼苗叶绿素含量随包衣浓度增加而下降,且包衣浓度为0.24及0.48 g ai·kg-1种子时叶绿素含量与裸种差异显著(α=0.05)。在5 ℃/10 ℃时,未包衣高粱幼苗叶绿素含量降至16.35 mg·g-1,戊唑醇包衣高粱幼苗叶绿素含量较未包衣处理稍降低,且随包衣浓度增加叶绿素含量降低,但并未达显著水平(α=0.05)。在0 ℃/5 ℃时,对照高粱幼苗叶绿素含量已下降至9.77 mg·g-1,戊唑醇包衣处理高粱叶绿素含量随包衣浓度增加而降低,且在0.48 g ai·kg-1种子浓度下与未包衣处理差异显著(α=0.05)。

表2 温度和浓度对戊唑醇包衣高粱幼苗根系活力的影响Table 2 Effects of temperature and concentration on root activity of tebuconazolee-coated sorghum seedlings

图7 温度和浓度对戊唑醇包衣高粱幼苗叶绿素含量的影响Fig.7 Effects of temperature and concentration on chlorophyll content of tebuconazolee-coated sorghum seedlings
2.5 低温胁迫对高粱幼苗叶片中电解质外渗情况的影响
由图8可知,在同等包衣浓度条件下,随胁迫温度降低,高粱幼苗相对电导率增加。25 ℃/30 ℃时,相对电导率较低,且未包衣处理高粱幼苗与戊唑醇包衣处理高粱幼苗相对电导率差异未达显著水平(α=0.05)。15 ℃/20 ℃时,高粱幼苗相对电导率较25 ℃/30 ℃条件下增加,但戊唑醇包衣处理与未包衣高粱幼苗相对电导率差异均不显著(α=0.05)。当胁迫低温为5 ℃/10 ℃时,随包衣浓度增加,相对电导率先降后升。当胁迫低温为0 ℃/5 ℃时,随包衣浓度增加,电导率增加;但包衣剂量为0.06 g ai·kg-1种子时,高粱幼苗电导率与未包衣处理高粱幼苗差异不显著(α=0.05);当包衣剂量为0.12 及0.24 g ai·kg-1种子时,相对电导率显著增加(α=0.05)。包衣浓度为0.48 g ai·kg-1种子时,相对电导率达18.68 ms·cm-1,与其余各处理间差异显著(α=0.05)。

图8 温度和浓度对戊唑醇包衣高粱幼苗相对电导率的影响Fig.8 Effects of temperature and concentration on the relative conductivity of tebuconazolee-coated sorghum seedlings
2.6 低温胁迫对高粱幼苗过氧化氢酶含量的影响
由图9可知,低温胁迫明显增加高粱幼苗体内CAT 含量。25 ℃/30 ℃时,高粱幼苗CAT 含量较低,未包衣处理高粱幼苗CAT 含量为24.86 U·g-1,戊唑醇包衣高粱幼苗CAT 含量较未包衣处理差异不显著(α=0.05)。15 ℃/20 ℃时,未包衣处理高粱幼苗CAT 含量为40.68 U·g-1,戊唑醇包衣浓度为0.06、0.12 g ai·kg-1种子时高粱幼苗体内CAT含量分别为27.12 及36.16 U·g-1,较裸种差异显著(α=0.05)。5 ℃/10 ℃时,高粱幼苗CAT含量明显增加。戊唑醇包衣浓度为0.06、0.12及0.24 g ai·kg-1种子时,CAT 含量较裸种稍降低,但差异不显著(α=0.05);随包衣浓度增加至0.48 g ai·kg-1种子,CAT含量最高,且与未包衣处理高粱幼苗CAT 含量差异达显著(α=0.05)。0 ℃/5 ℃时,未包衣处理高粱幼苗体CAT 含量高达198.88 U·g-1,戊唑醇包衣高粱幼苗CAT 含量变化规律与5 ℃/10 ℃时一致,且含量最高。

图9 温度和浓度对戊唑醇包衣高粱幼苗过氧化氢酶含量的影响Fig.9 Effects of temperature and concentration on catalase contents of tebuconazolee-coated sorghum seedlings
2.7 低温胁迫对高粱幼苗超氧化物歧化酶含量的影响
由图10可知,在25 ℃/30 ℃时,植物组织内SOD含量最低,各处理间差异不显著。15 ℃/20 ℃时,较25 ℃/30 ℃SOD含量明显增加,未包衣与戊唑醇包衣处理相比,幼苗体内SOD 含量差异不显著(α=0.05)。5 ℃/10 ℃时,SOD含量增加,高粱幼苗体内SOD 含量与未包衣处理高粱差异不显著(α=0.05)。0 ℃/5 ℃时,高粱幼苗内SOD含量最高,经0.06和0.12 g ai·kg-1种子戊唑醇包衣幼苗SOD含量低于未包衣处理,且差异不显著(α=0.05);在0.24 g ai·kg-1种子包衣浓度下SOD 含量升高,0.48 g ai·kg-1种子戊唑醇包衣处理下高粱幼苗体内SOD 含量较未包衣处理显著升高(α=0.05)。

图10 温度和浓度对戊唑醇包衣高粱幼超氧化物歧化酶含量的影响Fig.10 Effects of temperature and concentration on superoxide dismutase content of tebuconazolee-coated sorghum seedlings
3 讨 论
种子吸胀期温度对萌发有重要影响[17]。种子萌发是植株生长发育过程中代谢较为旺盛的阶段,也最易受外界逆境影响。杜尧东等研究表明,低温胁迫降低番茄种子萌发率、发芽势及发芽指数[18]。较低浓度戊唑醇包衣使小麦种子发芽率升高,但高浓度戊唑醇包衣抑制其萌发[19]。这与本研究结果一致,低温胁迫显著抑制高粱种子萌发率。在同等低温胁迫条件下,戊唑醇包衣浓度升高,高粱种子萌发率下降,说明高浓度戊唑醇包衣加剧低温胁迫对高粱种子的影响,使其萌发受抑。
田体伟等研究指出,高浓度戊唑醇处理显著抑制小麦幼苗生长发育,而低浓度戊唑醇处理增加小麦苗高、根长和根数[20]。杨德光等研究表明,低温胁迫抑制玉米种子发芽和幼苗生长,降低幼苗株高、根长、叶绿素含量,提高SOD活性[21]。与本研究结果一致,在适宜温度条件下,较高浓度戊唑醇处理对其高粱种子生长发育无抑制作用,其根长、株高、单株鲜重较未包衣处理提高。但在低温胁迫条件下,较高浓度戊唑醇处理高粱种子的生长发育受到显著抑制,根长、株高、单株鲜重及活力指数明显下降。
根系是植株吸收水分及矿物元素的重要器官。根系活力即根的生长情况和代谢水平,其活力反映根系使地下部分营养元素或农药等物质向上输导的能力,直接影响植物地上部生长和营养状况[22]。本试验中,影响高粱幼苗根系活力的原因主要来自两方面:一是低温胁迫对植株地上部分的破坏,使其生长状态变差,从而降低根系活力;二是由于戊唑醇包衣剂量过大,导致其产生部分药害,与低温逆境协同增强对高粱幼苗根系发育的抑制作用。低温胁迫下,高浓度戊唑醇包衣的高粱种子幼苗体根系活力降低,使其地上部分受到直接影响,生长发育变差。
植物体内叶绿素是一类与光合作用有关的重要色素,叶绿素含量与光合作用能力相关。叶绿素含量是评定逆境因素对光合作用器官造成严重伤害的重要指标[23]。低温胁迫使植株叶绿素含量下降,最终导致光合速率下降[24]。本研究发现,在适宜生长温度下,戊唑醇包衣对高粱幼苗叶绿素生成并未表现抑制作用,相反,戊唑醇包衣高粱种子幼苗较未包衣裸种幼苗体叶绿素含量增加,光合作用能力增强。在胁迫低温条件下,适量戊唑醇包衣并未增强低温逆境的破坏作用,当戊唑醇包衣浓度达0.24及0.48 g ai·kg-1种子时,戊唑醇对高粱幼苗的药剂反应与低温逆境胁迫共同作用于高粱幼苗,使其叶绿素含量急剧降低,影响高粱正常光合作用。
植物细胞对维持细胞的微环境和正常代谢发挥重要作用。正常情况下,细胞膜对物质具有选择透性作用。当植物受逆境环境影响时,细胞膜遭到破坏,膜透性增大,使细胞内电解质外渗,以至植物细胞浸提液电导率提高[25]。因此,高粱幼苗浸提液电导率可反映高粱细胞膜遭受破坏程度。研究证实,电导率代表植株对抗冷害能力[26]。本研究中,电导率随温度降低而增加,说明细胞膜由于胁迫低温逆境被破坏,且温度越低电导率越大。在同等低温胁迫条件下,适量戊唑醇包衣高粱与对照并无明显差异,但当戊唑醇包衣浓度较大时,电导率增幅较大,与对照相比增长近66.9%。说明较高浓度戊唑醇包衣可增强低温逆境产生的渗透作用。
过氧化氢酶(CAT)是催化过氧化氢分解成氧和水的酶,在植物体内广泛存在于叶绿体、线粒体及内质网中,以清除植物体内因氧化而产生的过氧化氢,使细胞免于遭受其毒害,是生物防御体系的关键酶之一。超氧化物歧化酶(SOD),是生物体内重要的抗氧化酶,广泛分布于各种生物体内,可消除生物体在新陈代谢过程中产生的有害物质。超氧化物歧化酶清除生物体内自由基,对抗与阻断氧自由基对细胞造成的损害,并及时修复受损细胞[27]。研究指出,冬季低温胁迫下,油菜CAT活性在日均温降至5 ℃左右时明显升高并出现最大值,SOD 活性则在3 ℃左右达到最高[28];本研究也证实这一点,高粱幼苗在0 ℃/5 ℃下CAT及SOD酶活性较常温下显著升高,且达最大值。在低温胁迫下,SOD 及CAT 酶活性随温度降低而增高,与赵宏伟等研究结果一致[29]。在同等低温胁迫条件下,戊唑醇包衣浓度为0.06 及0.12 g ai·kg-1种子时,高粱幼苗体内CAT 及SOD 酶含量与未包衣高粱幼苗之间差异较小;当戊唑醇包衣浓度达0.24及0.48 g ai·kg-1种子时,高粱幼苗体内CAT及SOD酶含量显著增加,说明逆境胁迫带来的破坏在较高浓度戊唑醇作用下增强。
4 结 论
在适宜生长条件下(15~30 ℃),戊唑醇包衣高粱种子对高粱发芽及出苗有促进作用,且对高粱幼苗根长、株高、单株鲜重和根重无抑制作用;此外,戊唑醇包衣下高粱幼苗根系活力未受抑制。戊唑醇包衣高粱种子提高幼苗叶绿素含量,使其光合作用增强,促进其生长发育。
低温胁迫条件下(0~10 ℃),0.06和0.12 g ai·kg-1种子戊唑醇包衣对高粱幼苗无显著影响。0.24 与0.48 g ai·kg-1种子戊唑醇包衣加剧低温胁迫导致的叶绿素含量降低、细胞电解质外渗、过氧化氢积累及氧自由基增加。
综上,推荐使用浓度(0.06~0.12 g ai·kg-1种子)戊唑醇包衣不会导致高粱产生低温药害,超过推荐浓度(0.24~0.48 g ai·kg-1种子),则加剧低温胁迫,产生药害。
