多肽菌素在长牡蛎人工育苗生产中的应用
2020-05-13于瑞海李海昆王永旺
刘 洋, 赵 强, 于瑞海, 李海昆, 王永旺
多肽菌素在长牡蛎人工育苗生产中的应用
刘 洋1, 赵 强2, 于瑞海1, 李海昆1, 王永旺1
(1. 中国海洋大学, 海水养殖教育部重点实验室, 山东 青岛 266003; 2. 烟台市海洋经济发展研究院, 烟台 364110)
多肽菌素作为一类具有抗菌活性的生物短肽, 是一种可以替代抗生素的生物肽。为了推广多肽菌素在水产养殖中的应用, 本研究以长牡蛎()人工育苗为基础, 以添加2×10–6mol/L青霉素钠为对照组, 以添加5个不同浓度(2×10–6、4×10–6、6×10–6、8×10–6、10×10–6mol/L)多肽菌素为实验组, 研究多肽菌素在长牡蛎人工育苗生产中的应用。结果显示: (1)在长牡蛎种贝培育方面, 培育前8天各组差异不显著(0.05), 培育后期添加6×10–6mol/L多肽菌素组存活率均最高, 对照组最低, 且培育至32天时该实验组均显著高于其他组(< 0.05)。(2)在长牡蛎幼虫培育方面, 幼虫壳高日增长量在添加6×10–6mol/L多肽菌素组中最大, 为11.57 μm/d, 而对照组仅为9.61 μm/d; 幼虫存活率方面对照组始终最低, 而添加6×10–6mol/L与8×10–6mol/L多肽菌素组均保持较高存活率, 显著高于对照组(< 0.05)。(3)在长牡蛎幼虫附着变态方面, 添加6×10–6mol/L多肽菌素组附着率最高、附着时间最短, 且均与对照组差异显著(< 0.05)。(4)在长牡蛎稚贝培育方面, 稚贝壳长日增长量实验组均高于对照组, 且随添加浓度的上升, 日增长量也随之增加; 稚贝存活率在添加6×10–6mol/L多肽菌素组达到最高, 与对照组差异显著(< 0.05)。结果表明, 使用多肽菌素与使用青霉素钠相比, 多肽菌素显著提高了整个牡蛎培育过程中的存活率、生长速度、及附着变态率, 这也为多肽菌素在贝类育苗生产中的推广提供了基础依据。
多肽菌素; 长牡蛎; 种贝; 幼虫; 稚贝
长牡蛎()作为我国重要经济养殖贝类, 因其生长速度快、产量高、经济效益显著等优点, 深受养殖单位喜爱, 近年来随着牡蛎养殖价格的上涨, 其养殖面积不断扩大, 带动了我国牡蛎养殖业的快速发展[1-2], 因此, 对牡蛎苗种需求量也不断增加, 但近年来, 在牡蛎人工育苗过程中易出现幼虫下沉死亡、生长缓慢、以及附着变态率低等现象[3-4], 针对这些问题, 育苗单位一般使用抗生素进行抑菌和杀菌等处理, 以降低幼虫死亡率和提高幼虫生长及变态率。
抗生素作为控制水产养殖动物疾病发生的重要药物, 近年来研究表明不仅增加动物耐药性, 同时药残危害水环境中的生态系统, 这使得抗生素渔药的使用面临严峻挑战[4-5]。而多肽菌素作为抗菌肽一种, 是一类具有抗菌活性的生物短肽, 广泛存在于生物界中[6]。该类物质分子量小, 具有热稳定、水溶性好以及广谱抗菌等特点, 并且抗菌机理与抗生素完全不同, 不易产生耐药性[7-8], 是抗菌素的替代品。目前, 关于多肽菌素的应用在水产养殖方面的报道还比较少, 主要集中在对虾和鱼类养殖中, 如Destoumieux等[9]在凡纳滨对虾()中发现抗菌肽在抗菌性能及免疫功能方面优于其他抗菌药物; 姜珊等[10]研究结果表明, 饲料中添加5~10 mg/kg抗菌肽可以显著提高罗非鱼()的增重率、红细胞总数以及过氧化氢酶的活性, 张晓宇等[11]对白鲢()也进行过研究, 表明饲料中添加多肽菌素可以提高白鲢的非特异性免疫力和抗病力, 但在贝类育苗和养殖中还未见报道。
本研究以长牡蛎()为研究对象, 以山东深海生物科技股份有限公司提供的多肽菌素为试验材料, 在牡蛎人工育苗过程中, 通过添加不同浓度多肽菌素研究其对长牡蛎种贝促熟培育、幼虫及稚贝生长发育的影响, 通过此研究, 旨在替代牡蛎人工育苗中抗菌素的使用, 并以此作为多肽菌素在贝类人工育苗生产中的推广提供经验。
1 材料与方法
1.1 实验材料
多肽菌素为抗菌肽的一种, 由山东深海生物科技股份有限公司提供, 原名多肽菌素S100。主要成分为抗菌多肽APSH-07、机体防御肽DPS-01、组织修复肽、益生素等, 外观为褐色液体, 有酵香气味。
1.2 实验地点
实验于2018年夏季至2019年春季在莱州市乐平水产科技有限公司育苗场进行, 实验用育苗池大小为4 m×5 m×1.2 m, 实验期间水温为23 ~ 24℃, 盐度为29。
1.3 实验设计
种贝培育期随机选取400个长牡蛎, 分为1个对照组和3个实验组, 每组100个。幼虫培育期取刚孵化完的D形幼虫均分为18个培育池, 分为1个对照组, 5个实验组, 每组设三个重复。稚贝培育期分组同幼虫培育期, 见表1。

表1 实验期间不同培育期的处理浓度
注: 图中字母代表处理浓度。对照组: A (2×10–6mol/L); 实验组: a1 (2×10–6mol/L), a2 (4×10–6mol/L), a3 (6×10–6mol/L), a4 (8×10–6mol/L), a5 (10×10–6mol/L)
1.4 种贝及幼虫的培育管理
添加剂每天换水后均匀泼洒, 种贝饵料以小新月菱形藻()为主, 亚心形扁藻()为辅; 幼虫饵料以球等边金藻()为主, 小球藻()为辅, 后期投喂亚心形扁藻。每天观测生长存活状况, 并记录数据。
1.5 取样及数据计算
取样时为保证数据准确性采用三点取样法, 即培育池的前中后位置。幼虫期采用500 mL烧杯迅速取样, 显微镜下观察并记录幼虫大小及幼虫数量; 附着期采用同样方法测量培育池中幼虫密度计算附着率; 稚贝期通过随机抽取附着基, 观察并记录稚贝大小及数量。种贝存活率为测量时存活个数与初始个数之比; 幼虫壳高平均日增长量为第22天测量时幼虫平均壳高与初始壳高的差值与培育天数的比值; 幼虫存活率为测量时幼虫密度与初始密度之比; 附着率为第7天测量时已附着稚贝数量与初始幼虫数之比; 稚贝存活率及壳长平均日增长量同幼虫培育期计算, 出库时间以稚贝达到出库规格时间为准。
1.6 数据分析
实验数据均采用平均值±标准差 (Mean±SD) 表示, 采用SPSS23.0进行数据分析。各个实验均采用单因素方差分析(One-way ANOVA), 显著水平均设为< 0.05。
2 结果
2.1 多肽菌素对长牡蛎亲贝存活及产卵孵化的影响
实验期间长牡蛎种贝存活率情况见图1。培育前8天, 各组存活率均差异不显著(> 0.05); 培育至第14天, 各实验组均显著高于对照组(< 0.05), 且添加6×10–6mol/L多肽菌素组存活率达到最高; 培育至第32天, 添加6×10–6mol/L多肽菌素组仍为最高达到(83.67 ± 2.17) %, 且与其他各组均差异显著(< 0.05), 而此时对照组存活率仅为(70.23 ± 2.17) %。

图1 不同处理浓度下长牡蛎种贝存活情况
注: 相同培育时间下不同字母间表示差异显著(< 0.05)
实验期间种贝产卵及孵化情况见表2。将存活亲贝进行刺激产卵, 发现产卵量在添加6×10–6mol/L多肽菌素组最大, 由于种贝数目不同, 性别比不同, 故不能由此判定最适浓度。在受精率方面, 各组间差异不显著(> 0.05), 添加6×10–6mol/L及10×10–6mol/L多肽菌素组受精率较高; 但在孵化率方面, 添加6× 10–6mol/L多肽菌素组达到最高, 且与对照组差异显著。
2.2 多肽菌素对长牡蛎幼虫生长发育的影响
添加多肽菌素对长牡蛎幼虫壳高生长具有显著影响(< 0.05)(见表3)。培育至第2天, 各组间差异不显著(> 0.05)。随日龄增加幼虫规格逐渐增大, 最适培育条件逐步发生变化。培育第6天至22天, 添加6×10–6mol/L多肽菌素组平均壳高均最大, 且显著高于其它组(< 0.05)。培育至第14天、18天、22天, 添加8×10–6mol/L多肽菌素组平均壳高仅次于添加6×10–6mol/L多肽菌素组, 且显著高于其他组(< 0.05)。培育至第22天时, 添加6×10–6mol/L多肽菌素组平均壳高比对照组高(40.27 ± 2.51) μm。
实验期间长牡蛎幼虫壳高平均日增长量如图2所示。添加6×10–6mol/L多肽菌素组壳高平均日增长量最高, 达到(11.57 ± 1.24) μm/d, 与添加8×10–6mol/L多肽菌素组差异不显著(> 0.05), 与其他各组均差异显著(< 0.05)。除添加6×10–6mol/L多肽菌素组之外各组均差异不显著(> 0.05), 对照组壳高平均日增长量最低为(9.61 ± 1.67) μm/d。
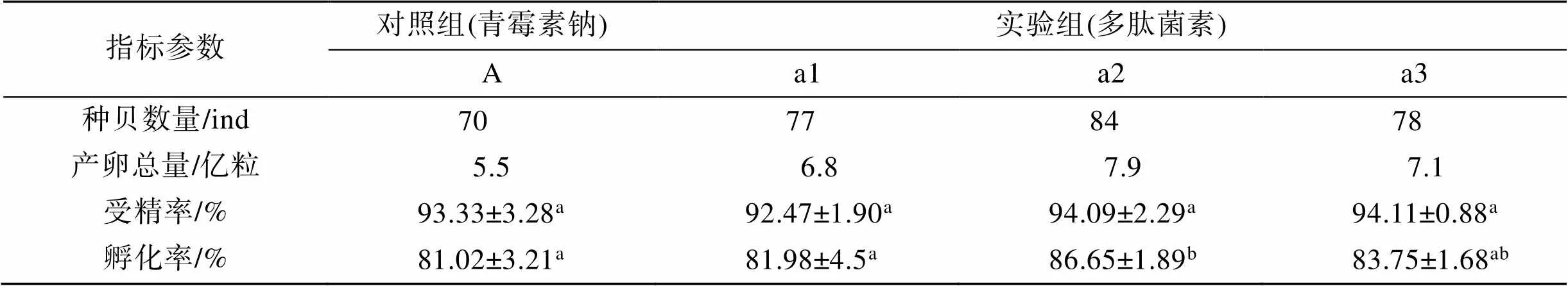
表2 不同处理浓度下种贝产卵量及受精孵化情况
注: 同一行数据标注不同上标字母代表差异显著(<0.05)

表3 不同处理浓度下长牡蛎幼虫的壳高生长情况/μm
注: 同一列数据标注不同上标字母代表差异显著(<0.05)
实验期间长牡蛎幼虫存活情况如图3所示。第2天各组间存活率相差较小, 第2天之后添加6× 10–6mol/L与8×10–6mol/L多肽菌素组长牡蛎幼虫存活率较高, 两组之间差异不显著(> 0.05), 但始终显著高于其他各组(< 0.05)。培育期间, 前10天各组存活率下降较快, 之后趋于平缓。培育至第22天, 对照组存活率仅为(34.46 ± 1.63) %, 而添加多肽菌素6×10–6mol/L与8×10–6mol/L多肽菌素组存活率分别为(58.25 ± 0.73) %, (55.49 ± 1.24) %。
2.3 多肽菌素对长牡蛎幼虫附着变态的影响
当眼点幼虫达到50%~60%时投放附着基, 第7天测量附着率。实验期间长牡蛎幼虫附着情况如图4所示。在附着率方面, 添加6×10–6mol/L多肽菌素组最高, 为(57.68 ± 1.27) %, 且与各组差异显著(< 0.05)。各实验组除添加2×10–6mol/L多肽菌素组外均显著高于对照组(< 0.05), 且添加6×10–6mol/L、8×10–6mol/L、10×10–6mol/L多肽菌素组附着率均高于50 %, 而对照组仅为(37.23 ± 2.03) %。在附着时间方面, 添加6×10–6mol/L多肽菌素组附着时间最短, 仅为(123.33 ± 0.89) h, 与添加8×10–6mol/L多肽菌素组差异不显著(> 0.05), 与其他组差异显著(< 0.05)。而对照组附着时间为(171.67 ± 1.24) h, 比添加10×10–6mol/L多肽菌素组长近50 h。
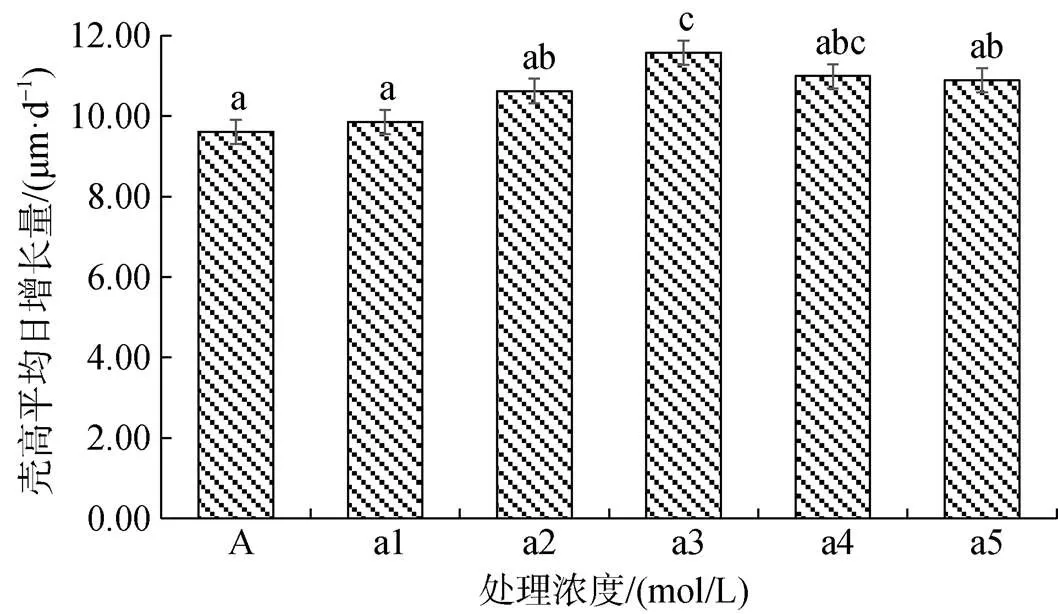
图2 不同处理浓度下长牡蛎幼虫壳高平均日增长量
注: 不同字母间表示差异显著(< 0.05)
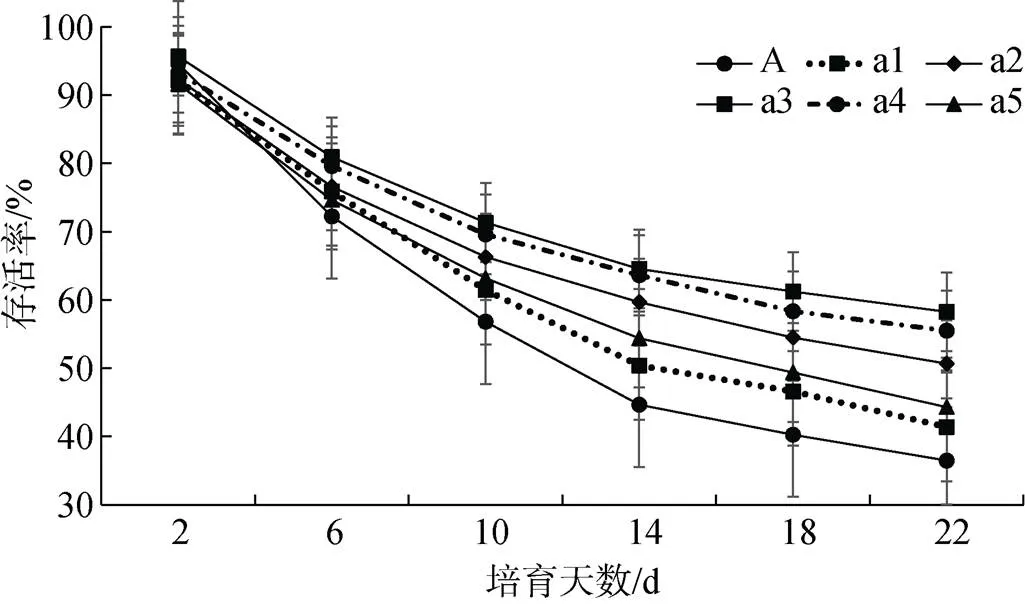
图3 不同处理浓度下长牡蛎幼虫存活情况
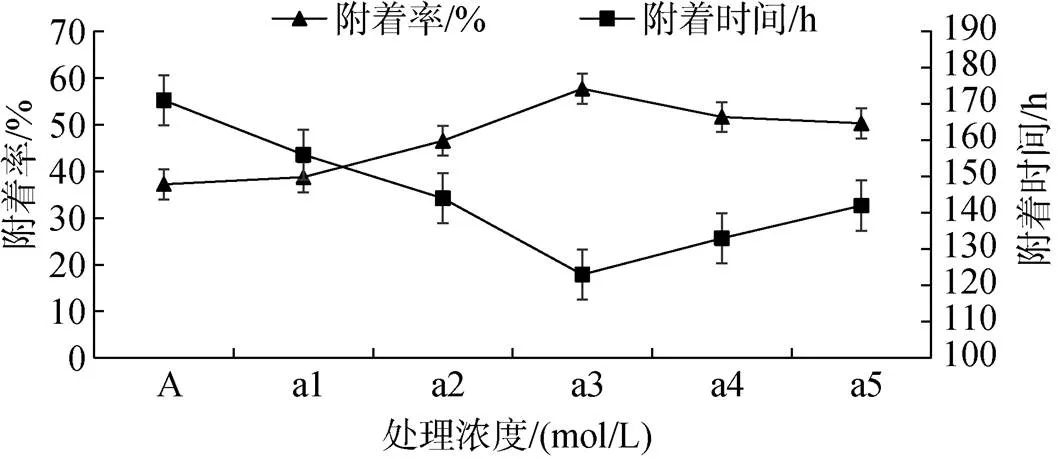
图4 不同处理浓度下长牡蛎幼虫附着情况
2.4 多肽菌素对长牡蛎稚贝生长发育的影响
自90 %以上眼点幼虫完成附着变态至培育至稚贝(平均500 μm以上)出库, 这一阶段称为稚贝培育阶段, 一般8~10天。此阶段稚贝生长情况直接影响苗量高低, 通过添加不同浓度多肽菌素以提高出苗量, 实验结果如图5、图6所示。在稚贝壳长日增长量方面, 实验组均高于对照组, 且随着多肽菌素浓度的上升, 日增长量也随之增加, 添加10×10–6mol/L多肽菌素组达到最高, 为(32.09 ± 1.18) μm/d, 除与添加6×10–6mol/L、8×10–6mol/L多肽菌素组差异不显著外(> 0.05), 与其他各实验组均差异显著(< 0.05)。对照组壳高平均日增长量仅为(18.33 ± 2.19) μm/d, 显著低于各实验组(< 0.05)。在稚贝存活率方面, 添加6×10–6mol/L多肽菌素组最高, 存活率高达(84.29 ± 1.47) %, 添加8×10–6mol/L多肽菌素组次之, 为(80.17 ± 2.13) %, 而对照组仅为(62.48 ± 1.67) %。

图5 不同处理浓度下长牡蛎稚贝壳长平均日增长量
注: 不同字母间表示差异显著(< 0.05)

图6 不同处理浓度下长牡蛎稚贝存活情况
注: 不同字母间表示差异显著(< 0.05)

图7 不同处理浓度下长牡蛎稚贝出库时间情况
注: 不同字母间表示差异显著(< 0.05)
不同处理浓度下长牡蛎稚贝出库时间情况如图7所示。添加6×10–6mol/L多肽菌素组出库时间最短为(155.67 ± 3.23) h, 约为6天半, 且该组除与添加8×10–6mol/L多肽菌素组出库时间差异不显著(> 0.05)外, 与其他各组均差异显著(< 0.05)。对照组出库时间最长为(201.43 ± 2.84) h, 约为8天半, 除与添加2×10–6mol/L多肽菌素组差异不显著(> 0.05), 均显著低于另外4个实验组(< 0.05)。对照组与添加6× 10–6mol/L多肽菌素组出库时间相差近2天, 若多肽菌素广泛应用于贝类育苗, 这将大大提高人工育苗效率。
3 讨论
3.1 多肽菌素作用机理及其在水产养殖中的应用现状
多肽菌素作为抗菌肽的一种, 具有独特的抗菌机制, 可以快速的杀死病原体, 包括细菌、革兰氏阳性菌、革兰氏阴性菌、真菌、病毒以及寄生虫等, 并且毒副作用小, 不易产生耐药性, 可以替代抗生素, 符合水产品安全生产的需要, 已成为国内外研究和开发的热点[12-13]。目前关于抗菌肽的作用机理有两种说法, 一是抗菌肽直接作用于细胞膜改变渗透性, 二是作用于细胞内靶点[14]。作用于细胞膜是由于抗菌肽表面带正电, 而革兰氏阳性菌及革兰氏阴性菌表面带负电荷, 两者间会互相吸引, 相互作用, 导致细菌表面的Mg2+或Ca2+被替换, 使细胞渗透压失常, 细胞质外泄, 从而导致细胞死亡, 并且膜作用机制有多种, 包括桶板模式、地毯模式、环孔模式[15-17]。对于膜内作用, 有研究表示抗菌肽通过穿透细胞膜在细胞质中蓄积并与DNA和RNA相互结合, 从而导致细胞死亡[18]; 抗菌肽麻蝇素-Ⅱ能够有效抑制细菌细胞壁或者其他隔膜形成, 导致细菌生长受阻[19], 从而导致细胞死亡。
多肽菌素在水产养殖中的应用相对较少, 主要集中在以下几个方面。第一, 抗菌肽抑制水产养殖中常见病原菌, 降低水体中病原菌的数量, 从而有效提高水产养殖动物的存活率[12]; 第二, 抗菌肽可以提高水产养殖动物的生产性能, 改善肠道消化功能, 主要表现在养殖动物的增重率、饵料系数以及生长率等指标上[20]; 第三, 抗菌肽可以增强水产动物的免疫性能, 大量研究认为, 抗菌肽是通过调节某些生长因子与其受体的表达, 激活机体相关信号通路, 充当单核细胞和中性粒细胞等免疫细胞的趋化因子[21],与动物非特异性免疫协同作用, 来增强机体的免疫力, 从而对机体起到保护作用。目前抗菌肽作用机制虽未完全研究透彻, 但抗菌肽在提高动物生长性能方面已被证实, 所以抗菌肽在水产行业具有极大的应用空间和广阔的发展前景。
3.2 多肽菌素在长牡蛎人工育苗生产中影响讨论
本研究表明多肽菌素能够显著提高长牡蛎人工育苗生产效率。在种贝实验过程中, 培育至后期各实验组存活率均显著高于对照组(< 0.05), 且在种贝产卵孵化期间, 各实验组孵化率均高于对照组。这一结果与Tassanakajon等[22]对凡纳滨对虾研究结果相似, 当在饲料中添加2 000~3 000 mg/kg的抗菌肽时, 凡纳滨对虾的成活率、增重率、特定生长率以及饲料效率均显著高于未添加组; 同样的结果在凡纳滨对虾研究中, 覃志彪等[23]表明在饲料中添加5 000~ 8 000 mg/kg天蚕素抗菌肽, 可以提高对虾成活率, 并且提高对虾的营养成分。另外在黄沧海等[24]在对罗非鱼的研究中发现, 添加抗菌肽组在促进罗非鱼增重方面极显著高于抗生素组, 并且提高了罗非鱼的肥满度。这可能是多肽菌素S100在种贝肠道内发挥作用, 促进有益菌、抑制有害菌的生长, 使得种贝存活率上升。
在长牡蛎幼虫培育过程中, 实验表明添加多肽菌素存活率以及平均日增长量均高于青霉素钠组, 青霉素钠组始终最低, 同样在在幼虫附着阶段也显示添加多肽菌素附着率高于未添加组, 且附着时间短。另外在幼虫培育过程中得出多肽菌素最适添加浓度为6×10–6mol/L, 当高于该浓度时, 幼虫存活及生长均出现下降趋势。这些实验结果可能是因为适宜浓度多肽菌素能够促进幼虫的生长发育, 提高饵料利用率, 浓度过高反而会抑制幼虫的生长。因为抗菌肽能够维持肠道内生态平衡, 如果长时间摄食高浓度抗菌肽可能会抑制肠道内有益菌, 导致幼虫生长变慢甚至死亡。类似的实验结果在王四新等[25]对草鱼()的研究中表明饲料中添加抗菌肽可以显著提高草鱼的增质量速度和相对增重率; 在王自蕊等[26]对湘云鲫()的研究中证明添加150和200 mg/kg的天蚕素抗菌肽对湘云鲫有促生长效果; 另外在最适添加量研究中, 林鑫等[27]和贾滔等[28]在鲤鱼()的饲料中添加100~200 mg/kg抗菌肽, 鲤鱼的特定生长率与增重率显著提高, 最佳添加水平为150 mg/kg; 郑宗林等[29]在对红姑娘鱼()的研究中, 发现300 mg/kg 组与500 mg/kg组在增重率、饲料效率和蛋白效率都显著高于对照组, 最适添加量为300 mg/kg,可显著提高红姑娘鱼的增重率与饲料转化率。这些研究结果均表明抗菌肽能有效促进水产动物的生长发育, 但最适添加量因不同物种而异, 可能是由于抗菌肽在不同物种体内的作用机制与作用途径不同, 还有待研究。
在长牡蛎稚贝培育阶段, 添加多肽菌素稚贝存活率显著提高且生长速度快, 另外出库时间缩短近2天。稚贝阶段个体小, 缺乏特异的免疫系统, 主要依靠天然免疫保护机体免受外界病原的危害[30]。在刘翠玲等[31]研究中发现, 饲料中添加3 g/kg抗菌肽生物制剂可以促进鲤鱼幼鱼的生长与消化; 何义进等[32]通过在异育银鲫()饲料中添加0.2%以上抗菌肽, 结果表明提高了血清中超氧化物歧化酶活性, 改善了机体免疫能力。所以在稚贝培育过程中添加多肽菌素可以提高稚贝的免疫能力, 当机体受到外界攻击时, 抗菌肽起到调节、防御免疫作用, 从而使得稚贝存活率升高并且生长速度加快, 从而达到提高人工育苗效率的目的。
4 结果
本实验中, 通过在育苗池中添加不同浓度多肽菌素, 研究出有利于长牡蛎人工育苗生产的最佳浓度为6×10–6mol/L。实验表明多肽菌素具有较好的抗菌性, 可替代抗菌素使用, 对于贝类的抗病能力及成活率的提高具有显著效果。目前多肽菌素作用机制尚未完全研究透彻, 但为水产育苗、养殖中病害防治的应用奠定了基础。
[1] Dégremont L, Garcia C, Jr A S. Genetic improvement for disease resistance in oysters: A review[J]. Journal of Invertebrate Pathology, 2015, 131: 226-241.
[2] Melo C M R D, Durland E, Langdon C. Improvements in desirable traits of the Pacific oyster (), a result of five generations of selection on the West Coast, USA[J]. Aquaculture, 2016, 460: 105-115.
[3] 于瑞海, 李琪, 王昭萍, 等.我国北方太平洋牡蛎育苗及养殖现状[J]. 科学养鱼, 2008, (6): 3-5. Yu Ruihai, Li Qi, Wang Zhaoping, et al. The current situation of culture of Pacific oyster () in north of China[J]. Scientific Fish Farming, 2008, (6): 3-5.
[4] 叶文红. 抗生素渔药使用情况及其替代品发展简介[J].水产养殖, 2018, 39(12) : 14-20. Ye Wenhong. Use of antibiotics in fishery and development of substitutes[J]. Journal of Aquaculture, 2018, 39(12): 14-20.
[5] 郑惠东. 水环境中抗生素来源及对健康的影响[J]. 环境卫生学杂志 2018, 8(1): 73-77. Zheng Huidong. Sources of antibiotics in water environment and their effects on health[J]. Journal of Environmental hygiene, 2018, 8(1): 73-77.
[6] 张家国. 水产动物抗菌肽研究的最新进展[J]. 大连水产学院学报, 2009, 24(增刊): 130-133. Zhang Jiaguo. Recent progress of antimicrobial peptides in aquatic animals[J]. Journal of Dalian Fisheries University, 2009, 24 (Supplement) : 130-133.
[7] 翟朝阳. 昆虫抗菌肽物质研究进展[J]. 昆虫学报, 1996, 3(91): 99-104. Zhai Chaoyang. Advances in insect antimicrobial peptides[J]. Acta Entomologica Sinica, 1996, 3(91): 99-104.
[8] Gazit E, Lee W J. Mode of action of the antibacterial cecropin B2: a spectrofluorometric study[J]. Biochemistry, 1994, 33(35): 10681-10692.
[9] Destoumieux D, Munoz M, Bulet P, et al. Penaeidins, a family of antimicrobial peptides from penaeid shrimp (,)[J]. Cellular and Molecular Life Sciences, 2000, 57(8-9): 1260-1271.
[10] 姜珊, 王宝杰, 刘梅, 等. 饲料中添加重组抗菌肽对吉富罗非鱼生长性能及免疫力的影响[J]. 中国水产科学, 201l, 18(6): 1308-1314. Jiang Shan, Wang Baojie, Liu Mei, et al. Effects of recombinant antimicrobial peptides added in feed on growth performance and immunity of giffulapia[J], Journal of Fishery Sciences of China, 201l, 18(6): 1308 1314.
[11] 张晓宇, 石浦, 彭赛君, 等. 多肽菌素S100对白鲢非特异性免疫力和抗病力的影响[J]. 黑龙江畜牧兽医, 2017, (18): 151-153 Zhang Xiaoyu, Shi Pu, Peng Saijun, et al. Effects of polypeptide fungicin S100 on non-specific immunity and disease resistance of[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017, (18): 151-153.
[12] 张晓宇, 彭赛君, 吕月琴, 等. 抗菌肽及其在水产养殖业的应用进展. 饲料研究, 2017, (22): 1-5, 9. Zhang Xiaoyu, Peng Saijun, Lv Yueqin, et al. Advances in antimicrobial peptides and their applications in aquaculture. Feed Research, 2017, (22): 1-5, 9.
[13] 徐睿航, 张敬燕, 张国庚. 水产养殖动物抗菌肽的研究进展. 乡村科技, 2018, (6): 106-107. Xu Ruihang, Zhang Jingyan, Zhang Guogeng. Research progress of antimicrobial peptides in aquaculture animals. Xiangcui Keji, 2018, (6): 106-107.
[14] 董晓庆, 曲桂娟, 陈玉珂, 等. 抗菌肽在水产养殖中的研究进展[J]. 黑龙江畜牧兽医, 2015, (23): 62-64. Dong Xiaoqing, Qu Guijuan, Chen Yuke, et al. Research progress of antimicrobial peptides in aquaculture[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015, (23): 62-64.
[15] Christensen B, Fink J, Merrifiel R B, et al. Channel- forming properties of cecropins and related model compounds incorporated into planar lipid membrances[J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 4: 5072-5076.
[16] Oren Z, Shai Y. Mode of action oflinear amphipathic alphahelical antimicrobial peptides[J]. Peptide Science, 1998, 47(6): 451-463.
[17] He K, Ludtke S J, Huang H W, et al. Antimicrobial peptide pores in membrances detected by neutron in- plane scattering[J]. Biochemistry, 1995, 48: 15614-15618.
[18] Subbalakshmi C, Sitaram N. Mechanism of antimicrbial action of indolicidin[J]. FEMS Microbiology Letters, 1998, 160(1): 91-96.
[19] Andreu D, Rivas L. Animal antimicrobial peptides: an overview[J]. Biopolymers, 1998, 47 (6): 415-433.
[20] Belaid A, Aouni M, Khelifa R, et al. In vitro antiviral activity of dermaseptins against herpes simplex virus type-1[J]. Journal of Medical Virology, 2002, (2): 229- 234.
[21] Chen Q, Schmidta P, Anderson G M, et al. The neutrophil granule-and epithelial cell-derived cathelicidin, utilizes formyl peptide receptor-like 1 (FPRL1) as a receptor to chemoattract human peripheral blood neutrophils, monocytes, and T cells[J]. The Journal of Experimental Medicine, 2000, 192(7): 1069-1074.
[22] Tassanakajon A, Amparyup P, Somboonwiwat K, et al. Cationic antimicrobial peptides in penaeid shrimp[J]. Marine Biotechnology, 2011, 13 (4) : 639-657.
[23] 覃志彪, 梁静真, 龙苏, 等. 抗菌肽对凡纳滨对虾生产性能及机体成分的影响[J]. 南方农业学报, 2016, 47(4) : 674-678. Tan Zhibiao, Liang Jingzhen, Long Su, et al. Effects of antimicrobial peptides on productivity and body composition of[J]. Journal of Southern Agriculture, 2016, 47(4) : 674-678.
[24] 黄沧海, 李波, 王冬冬, 等. 抗菌肽对罗非鱼幼鱼生长性能的影响[J]. 中国畜牧杂志, 2009, 45(23): 53-56. Huang Canghai, Li Bo, Wang Dongdong, et al. Effects of antimicrobial peptides on growth performance of[J]. Chinese Journal of Animal Science, 2009, 45 (23): 53-56.
[25] 王四新, 季海峰, 刘辉, 等. 抗菌肽对草鱼生长性能的影响[J]. 饲料研究, 2011, (4): 29-31. Wang Sixin, Ji Haifeng, Liu Hui, et al. Effect of antimicrobial peptides on growth performance of[J]. Feed Research, 2011, (4): 29-31.
[26] 王自蕊, 谯仕彦, 李波, 等. 饲料中添加天蚕素抗菌肽对湘云鲫生长性能、非特异性免疫功能及抗病力的影响[J]. 动物营养学报, 2014, 26(7): 1856-1863. Wang Zirui, Qiao Shiyan, Li Bo, et al. Effects of adding sericin antimicrobial peptides in feed on growth performance, non-specific immune function and disease resistance of[J]. Chinese Journal of Animal Nutrition, 2014, 26(7): 1856-1863.
[27] 林鑫, 毛述宏, 杨阳, 等. 饲料中添加抗菌肽对锦鲤生长、非特异性免疫力和抗病力的影响[J]. 动物营养学报, 2013, 25(8): 1860-1865. Lin Xin, Mao Shuhong, Yang Yang, et al. Effects of feeding antimicrobial peptides on growth, nonspecific immunity and disease resistance of[J]. Chinese Journal of Animal Nutrition, 2013, 25(8): 1860-1865.
[28] 贾滔, 王冬冬, 李波. 天蚕素抗菌肽对网箱养殖鲤鱼生长性能的影响[J]. 河南水产, 2015, 2(1): 26-27. Jia Tao, Wang Dongdong, Li Bo. Effects of sericin antimicrobial peptides on growth performance ofin cage[J]. Henan Fisheries, 2015, 2(1): 26-27.
[29] 郑宗林, 赵永志, Sergio Castillo. 饲料中添加抗菌肽对红姑鱼幼鱼生长性能及血清激素水平的影响[J]. 西北农林科技大学学报(自然科学版), 2016, 44(11): 23-30. Zheng Zonglin, Zhao Yongzhi, Sergio C. Effects of feeding antimicrobial peptides on growth performance and serum hormone level of[J]. Journal of Northwest A & F university (Natural Science Edition), 2016, 44(11): 23-30.
[30] 杨婷婷, 叶梦晓, 尤仲杰, 等. 抗菌肽及其在贝类中的研究进展[J]. 基因组学与应用生物学,2016, 44(11): 23-30. Yang Tingting, Ye Mengxiao, You Zongjie et al. Antimicrobial peptides and their research progress in shellfish[J]. Genomics and Applied Biology, 2016, 44(11): 23-30.
[31] 刘翠玲. 饲料中添加微生态制剂、抗菌肽及其复合制剂对鲤鱼生长、消化和非特异性免疫相关酶活性的影响[D]. 上海: 上海海洋大学, 2015. Liu Cuiling. Effects of microecological preparations, antimicrobial peptides and their compound preparations on growth, digestion and non-specific immune-related enzyme activities ofin feed[D]. Shanghai: Shanghai Ocean University, 2015.
[32] 何义进, 陈嘉殷, 刘波. 抗菌肽对异育银鲫生长、免疫与抗氧化相关因子及肠道菌群的影响[J]. 辽宁大学学报(自然科学版), 2011, 389(2): 149-153. He Yijin, Chen Jiayin, Liu Bo. Effect of antimicrobial peptides on growth, immune and antioxidant related factors and intestinal flora of Allogynogenetic crucian carp[J]. Journal of Liaoning University (Natural Sciences Edition), 2011, 389(2): 149-153.
Application of polypeptide fungicin in the artificial seedling production of Pacific oyster ()
LIU Yang1, ZHAO Qiang2, YU Rui-hai1, LI Hai-kun1, WANG Yong-wang1
(1. Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao, Shandong, 266003; 2. Yantai Fisheries Research Institute, Yantai 364110, China)
Polypeptide fungicin is a type of biopeptide that possesses antibacterial activity and can replace antibiotics. To promote the application of polypeptide fungicin in aquaculture, this study aimed to determine its application in the artificial seedling production of Pacific oysters ()This study is based on the artificial seedling production of; penicillin sodium was employed (2×10−6mol/L) as the control group, and five different concentrations of polypeptide fungicin (2×10−6, 4×10−6, 6×10−6, 8×10−6, and 10×10−6mol/L) were employed as the experimental group. The results of this study are summarized as follows. First, there was no significant difference between each group 8 days before cultivation of thescallop (> 0.05). The experimental group with 6×10−6mol/L polypeptide fungicin at the later stage of cultivation had the highest survival rate, whereas the control group had the lowest survival rate. The survival rate of the experimental group with 6× 10−6mol/L polypeptide fungicin was significantly higher than that of the other groups at 32 days of cultivation (< 0.05). Second, in terms oflarvae, the increase in larval shell height in the experimental group with 6×10−6mol/L polypeptide fungicin was 11.57 microns per day, whereas that in the control group was only 9.61 microns per day. The control group had the lowest larval survival rate; a significantly higher survival rate was maintained in the experimental group with 6×10−6and 8×10−6mol/L polypeptide fungicin than in the control group (< 0.05). Third, in terms of the attachment metamorphosis oflarvae, the attachment rate of the experimental group with 6×10−6mol/L polypeptide fungicin was the highest along with the shortest attachment time, which were significantly different from the control group (< 0.05). Fourth, in the cultivation of the juvenile(oysters), the daily growth amount of juveniles in the experimental group was higher than that in the control group. In addition, the increase in concentration of polypeptide fungicin led to an increase in the daily growth amount. The survival rate of juveniles was highest in the experimental group with 6×10−6mol/L polypeptide fungicin, which was significantly different from the control group (< 0.05). The results showed that compared with the use of penicillin sodium, the use of polypeptide fungicin considerably improved the survival rate, growth rate, and adhesion conversion rate during the entire oyster cultivation process. In addition, it improved the efficiency of artificial oyster seedlings, which provides a basis for the promotion of polypeptide fungicin in the production of shellfish seedlings.
polypeptide fungicin;; scallop; larvae; juvenile
Nov. 11, 2019
[This work was supported by Marine Economy Innovation and Development Regional Demonstration project, No. 12PYY001SF08-ZGHYDH-1;National Laboratory Project, No. 201ASKJ02-0]
S985
A
1000-3096(2020)04-0059-08
10.11759/hykx20191111001
2019-11-11;
2019-12-28
海洋经济创新发展区域示范专项(12PYY001SF08-ZGHYDH-1); 国家实验室项目(201ASKJ02-0)
刘洋(1996-), 男, 山东省泰安人, 硕士生, 研究方向: 贝类繁育及育种, 联系电话: 17854223149, E-mail: 1447863885@ qq.com; 于瑞海,
, 男(1964-), 教授级高工, 贝类繁育及育种研究, E-mail: yuruihai@ouc.edu.cn
(本文编辑: 赵卫红)
