取代肉桂酰甘氨酸酯的合成
2020-05-13祝显虹郑大贵周安西毛刘量
祝显虹, 郑大贵, 周安西, 毛刘量, 钟 发
(上饶师范学院 江西省普通高校应用有机化学重点实验室,江西 上饶 334001)
肉桂酸是众所周知的天然抗微生物化合物,广泛分布于植物中的芳香族脂肪酸,具有抗炎、抗茵等作用[1-4],近年来,肉桂酰胺类化合物抗肿瘤活性的报道很多[5-10]。由于其具有特殊活性,化学家们发展了很多来合成这类化合物的方法,如Brochu等[11]将N,N-二异丙基乙胺加入甘氨酸甲酯盐酸盐的二氯甲烷溶液中,再向该混合物中加入制备好的肉桂酰氯,合成得到肉桂酰甘氨酸甲酯。张建勋等[12]在甘氨酸乙酯盐酸盐中缓慢滴加肉桂酰氯,三乙胺作为缚酸剂,氯仿为溶剂,合成了肉桂酰甘氨酸乙酯。Studer等[13]报道以肉桂醛为原料,在1,8-二氮杂二环十一碳-7-烯、1,3-二甲基三唑碘化物、六氟异丙醇和3,3′,5,5′-四叔丁基联苯醌等多种试剂的四氢呋喃溶液中,合成得到肉桂酰甘氨酸乙酯。Baures等[14]利用肉桂酸和甘氨酸乙酯盐酸盐为原料,以CH2Cl2为溶剂,在1-[3-(二甲基氨基)丙基]-3-乙基碳化二亚胺盐酸盐的催化下,合成得到肉桂酰甘氨酸乙酯。Wei等[15]利用1-(3-二甲胺基丙基)-3-乙基碳二亚胺和二环己基碳二亚胺,肉桂酸经1-(3-二甲胺基丙基)-3-乙基碳二亚胺活化,再通过1-羟基苯并三唑保护形成稳定的活性中间体后,与氨基酸酯反应合成了取代肉桂酰氨基酸酯。但上述方法中存在反应条件苛刻,催化试剂昂贵,三乙胺有难闻的气味及毒性等不足,或是分离中间产物酰氯,不利于操作,但也有采用分步一锅法合成肉桂酰氨基酸酯,如Gillie等[16]以肉桂酸为原料,乙腈和三乙胺为溶剂,在氩气保护下将其冷却至-10 ℃后加入氯甲酸异丁酯,再加入甘氨酸甲酯盐酸盐,采用“分步一锅法”的形式合成得到肉桂酰甘氨酸甲酯,但反应条件苛刻。
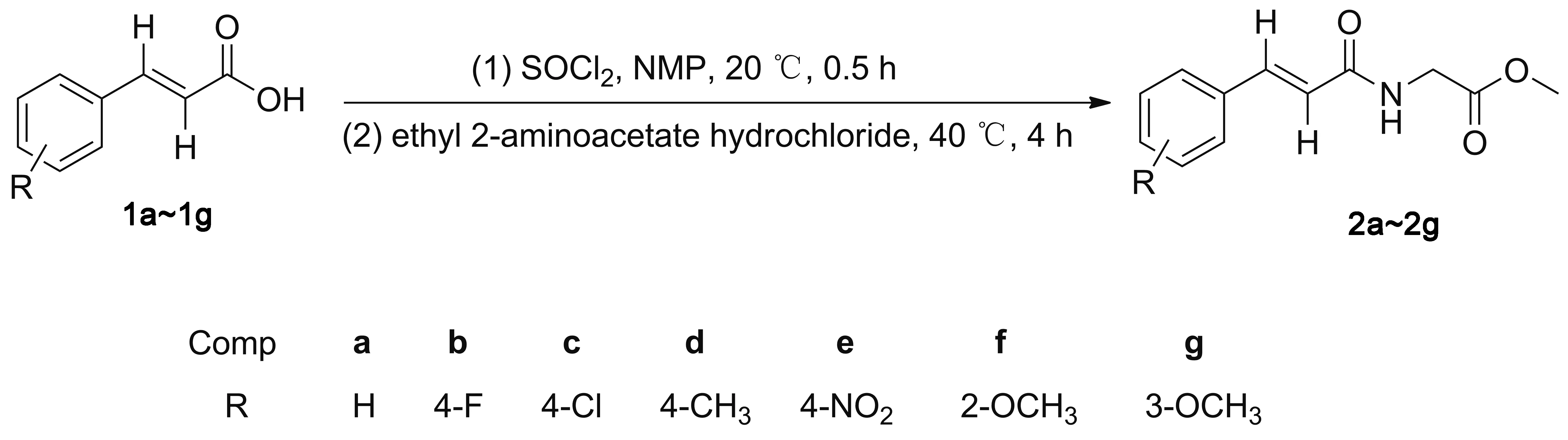
Scheme 1
受上述工作启发,本文采用“分步一锅法”,取代肉桂酸与SOCl2制得到取代肉桂酸酰氯后,酰氯不经分离,直接与加入甘氨酸乙酯盐酸盐反应,合成了一系列取代肉桂酰甘氨酸乙酯(2a~2g, Scheme 1),其结构经1H NMR、13C NMR、 IR和MS(EI)确证。并探讨了NMP促进取代肉桂酰甘氨酸乙酯反应可能的机理。
1 实验部分
1.1 仪器与试剂
X-6型精密显微熔点仪;Bruker Avance 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker TENSOR 27型红外光谱仪(KBr压片);Agilent 5975C型质谱仪(EI离子源)。
所用试剂均为分析纯。
1.2 2a~2g的合成(以2a为例)
单口烧瓶中加入肉桂酸(1a)1.482 g(10 mmol)和NMP 7.5 mL,室温下搅拌溶解,冰水浴冷却下缓慢滴加SOCl2875 μL(12 mmol),滴毕,于20 ℃反应0.5 h。加入甘氨酸乙酯盐酸盐1.954 g(14 mmol),于40 ℃反应4 h。加入40 mL乙酸乙酯和40 mL蒸馏水,分液,水层用乙酸乙酯(40 mL)萃取,乙酸乙酯层依次用饱和食盐水(5×40 mL)洗涤,无水Na2SO4干燥,过滤,滤饼旋蒸除去乙酸乙酯,残余物经硅胶柱层析[V(乙酸乙酯)/V(石油醚)=10/1]纯化得2a。
用类似的方法合成2b~2g。
肉桂酰甘氨酸乙酯(2a)[14]: 淡黄色固体,收率89.5%, m.p.103.0~106 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.64(d,J=15.6 Hz, 1H, CH), 7.52~7.50(m, 2H, ArH), 7.38~7.36(m, 3H, ArH), 6.48(d,J=15.6 Hz, 1H, CH), 6.24(s, 1H, NH), 4.28~4.23(m, 2H, CH2), 4.18(d,J=5.12 Hz, 2H, CH2), 1.31(t,J=7.14 Hz, 3H, CH3);13C NMR(CDCl3, 100 MHz)δ: 170.24, 166.16, 141.66, 134.66, 129.79, 128.79, 127.89, 119.97, 61.59, 41.64, 14.15; IRν: 3363, 2980, 2908, 1729, 1670, 1528, 1209, 868, 774, 710, 522, 483 cm-1; MS(EI)m/z: 232.1[M+, 23.41], 131.1[C9H7O+, 100]。
4-氟肉桂酰甘氨酸乙酯(2b): 白色固体,收率83.5%, m.p.107~109 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.62(d,J=15.6 Hz, 1H, CH), 7.51~7.48(m, 2H, ArH), 7.09~7.04(m, 2H, ArH), 6.39(d,J=15.6 Hz, 1H, CH), 6.19(s, 1H, NH), 4.28~4.23(m, 2H, CH2), 4.18(d,J=5.08 Hz, 2H, CH2), 1.31(t,J=7.14 Hz, 3H, CH3);13C NMR(CDCl3, 100 MHz)δ: 170.21, 165.84, 164.86, 162.37, 140.54, 130.88, 130.85, 129.74, 129.65, 119.59, 119.58, 116.02, 115.81, 61.68, 41.63, 14.15; IRν: 3256, 3071, 2988, 1736, 1657, 1619, 1207, 833, 791, 712, 661, 507 cm-1; MS(EI)m/z: 250.1[M+, 13.40], 149.1[C9H6FO+, 100]。
4-氯肉桂酰甘氨酸乙酯(2c)[17]: 白色固体,收率88.3%, m.p.119~121 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.61(d,J=15.6 Hz, 1H, CH), 7.45~7.43(m, 2H, ArH), 7.36~7.34(m, 2H, ArH), 6.43(d,J=15.6 Hz, 1H, CH), 6.19(s, 1H, NH), 4.28~4.23(m, 2H, CH2), 4.17(d,J=5.02 Hz, 2H, CH2), 1.31(t,J=7.14 Hz, 3H, CH3);13C NMR(CDCl3, 100 MHz)δ: 170.25, 166.16, 141.66, 134.66, 129.77, 128.78, 127.88, 119.98, 61.58, 41.63, 14.14; IRν, 3256, 3066, 2984, 1736, 1716, 1655, 1209, 821, 721, 664, 544, 501 cm-1; MS(EI)m/z: 266.1[M+, 8.44], 165.0[C9H6ClO+, 100]。
4-甲基肉桂酰甘氨酸乙酯(2d): 白色固体,收率90.6%, m.p.122~125 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.63(d,J=15.6 Hz, 1H, CH), 7.42~7.40(m, 2H, ArH), 7.19~7.17(m, 2H, ArH), 6.43(d,J=15.6 Hz, 1H, CH), 6.17(s, 1H, NH), 4.28~4.22(m, 2H, CH2), 4.18(d,J=5.12 Hz, 2H, CH2), 2.37(s, 3H, CH3), 1.31(t,J=7.14 Hz, 3H, CH3);13C NMR(CDCl3, 100 MHz)δ:170.23, 166.26, 141.69, 140.10, 131.91, 129.52, 127.88, 118.86, 61.58, 41.63, 21.42, 14.15; IRν: 3257, 3080, 2993, 1749, 1653, 1615, 1203, 811, 728, 666, 575, 499 cm-1; MS(EI)m/z: 246.1[M+, 14.26], 145.1[C10H9O+, 100]。
4-硝基肉桂酰甘氨酸乙酯(2e): 淡黄色固体,收率81.3%, m.p.156~158 ℃;1H NMR(CDCl3, 400 MHz)δ: 8.25~8.82(m, 2H, ArH), 7.70(d,J=15.6 Hz, 1H, CH), 7.67~7.65(m, 2H, ArH), 6.60(d,J=15.6 Hz, 1H, CH), 6.30(s, 1H, NH), 4.29~4.24(m, 2H, CH2), 4.19(d,J=5.08 Hz, 2H, CH2), 1.32(t,J=7.16 Hz, 3H, CH3);13C NMR(CDCl3, 100 MHz)δ: 170.00, 164.87, 148.23, 140.89, 139.10, 128.47, 124.14, 124.04, 61.83, 41.70, 14.15; IRν: 3362, 3042, 2990, 1731, 1678, 1637, 1210, 853, 764, 669, 586, 489 cm-1; MS(EI)m/z: 278.1[M+, 3.42], 176.0[C9H6NO3+, 100 ]。
2-甲氧基肉桂酰甘氨酸乙酯(2f): 淡黄色固体,收率89.86%, m.p.138~139 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.89(d,J=15.8 Hz, 1H, CH), 7.48~7.30(m, 2H, ArH), 6.97~6.90(m, 2H, ArH), 6.61(d,J=15.8 Hz, 1H, CH), 6.21(s, 1H, NH), 4.27~4.22(m, 2H, CH2), 4.18(d,J=5.08 Hz, 2H, CH2), 3.88(s, 3H, CH3), 1.31(t,J=7.14 Hz, 3H, CH3);13C NMR(CDCl3, 100 MHz);δ: 170.27, 166.66, 158.30, 137.13, 130.89, 129.12, 123.62, 120.80, 120.62, 111.07, 61.53, 55.39, 41.64, 14.15; IRν: 3251, 3081, 2982, 1751, 1653, 1618, 1194, 870, 750, 702, 572, 488 cm-1; MS(EI)m/z: 263.1[M+, 24.68], 161.1[C10H9O2+, 100]。
3-甲氧基肉桂酰甘氨酸乙酯(2g): 淡黄色固体,收率88.3%, m.p.78~81 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.62(d,J=15.6 Hz, 1H, CH), 7.30~7.09(m, 2H, ArH), 7.02~6.90(m, 2H, ArH), 6.47(d,J=15.6 Hz, 1H, CH), 6.29(s, 1H, NH), 4.28~4.22(m, 2H, CH2), 4.18(d,J=5.12 Hz, 2H, CH2), 3.82(s, 3H, CH3), 1.31(t,J=7.14 Hz, 3H,CH3);13C NMR(CDCl3, 100 MHz)δ: 170.22, 166.15, 159.80, 141.56, 136.04, 129.77, 120.45, 120.30, 115.57, 112.96, 61.58, 55.23, 41.62, 14.13; IRν: 3260, 3084, 2999, 1724, 1654, 1611, 1219, 861, 808, 778, 683, 589, 483 cm-1; MS(EI)m/z: 263.1[M+, 7.64], 161.1[C10H9O2+, 100]。
2 结果与讨论
2.1 实验条件的优化
以肉桂酰甘氨酸乙酯(2a)的合成为例,固定肉桂酸10 mmol,酰氯化反应温度为20 ℃和酰氯化反应反应时间为0.5 h,考察了NMP用量、物料比、酰胺化反应温度、酰胺化反应时间对反应收率的影响。
(1) NMP用量
单口烧瓶中加入肉桂酸1.482 g(10 mmol)和不同量的NMP,室温搅拌溶解,冰水浴冷却下缓慢滴加SOCl2725 μL(10 mmol),在20 ℃下酰氯化反应0.5 h,再加入甘氨酸乙酯盐酸盐1.396 g(10 mmol),在30 ℃下酰胺化反应3 h。考察NMP用量对反应收率的影响,结果见表1。

表1 NMP用量对反应收率的影响Table 1 The effect of NMP amount on the yield
由表1可知,NMP对反应具有明显的促进作用,随着NMP的用量增加,产物收率先增大后趋向平稳,造成这一现象可能的原因是:NMP作为溶剂,反应体系在匀相的溶液中更易进行,同时NMP也作为缚酸剂,吸收或释放出质子,有效促进酰氯化反应和酰胺化反应的进行(2.2 可能的反应机理)。NMP的用量加大后,萃取时水洗的次数增多。综上,NMP以7.5 mL为宜。
(2) SOCl2用量
单口烧瓶中加入肉桂酸1.482 g(10 mmol)和NMP(7.5 mL),室温下搅拌溶解,冰水浴冷却下,分别缓慢滴加不同量的SOCl2,在20 ℃下酰氯化反应0.5 h,再加入甘氨酸乙酯盐酸盐1.396 g(10 mmol),在30 ℃下酰胺化反应3 h。考察SOCl2用量对反应收率的影响,结果见表2。

表2 SOCl2用量对反应收率的影响Table 2 The effect of SOCl2 amount on the yield

表3 甘氨酸乙酯盐酸盐用量对反应收率的影响Table 3 The effect of glycine ethyl ester hydrochloride amount on the yield
由表2可知,随着SOCl2用量的增大,反应收率增加。但随着SOCl2用量增加,反应混合液颜色加深,副产物增多,分离纯化后的产物颜色也加深。综上,以n(肉桂酸)/n(SOCl2)=1.0/1.2最佳。
(3) 甘氨酸乙酯盐酸盐用量
单口烧瓶中加入肉桂酸1.482 g(10 mmol)和NMP (7.5 mL),室温搅拌溶解,冰水浴冷却下,缓慢滴加SOCl2875 μL(12 mmol),在20 ℃下酰氯化反应0.5 h,再分别加入不同量的甘氨酸乙酯盐酸盐, 在30 ℃下酰胺化反应3 h。考察甘氨酸乙酯盐酸盐用量对反应收率的影响,结果见表3。
由表3可知,随着甘氨酸乙酯盐酸盐用量的增大,反应收率逐步提高。在固定SOCl2用量的情况下,增大甘氨酸乙酯盐酸盐的用量意味着增大了酰胺化反应物的浓度,有利于产物的生成;随着甘氨酸乙酯盐酸盐的用量继续增加,在有限的溶剂量中,体系变的更为粘稠,从而影响传质,收率略有下降。以n(肉桂酸)/n(甘氨酸乙酯盐酸盐)=1.0/1.4最佳。
(4) 酰胺化温度
单口烧瓶中加入肉桂酸1.482 g(10 mmol)和NMP (7.5 mL),室温搅拌溶解,冰水浴冷却下缓慢滴加SOCl2875 μL(12 mmol),在20 ℃下酰氯化反应0.5 h,再加入甘氨酸乙酯盐酸盐1.954 g(14 mmol),在不同的温度下酰胺化反应3 h。考察酰胺化反应温度对反应收率的影响,结果见表4。

表4 酰胺化反应温度对反应收率的影响Table 4 The effect of amidation temperature on the yield
由表4可知,随着酰胺化反应温度的升高,收率先升后降。造成这种现象的原因是:反应是放热反应,温度太低反应不充分,并且低温度下,NMP黏性较高,不利于反应有效进行;但反应温度过高时,大量的HCl以气体的形式从反应体系中逸出,NMP吸收HCl的量减少,酰氯化完成后,NMP盐酸盐释放能催化酰胺化的质子减少。同时反应温度过高,甘氨酸乙酯易成环或脱羧等其它副反应,导致收率下降,综上,酰胺化反应温度以40 ℃为宜。
(5) 酰胺化反应时间
单口烧瓶中加入肉桂酸1.482 g(10 mmol)和NMP 7.5 mL,室温搅拌溶解,冰水浴冷却下缓慢滴加SOCl2875 μL(12 mmol),在20 ℃下酰氯化反应0.5 h,再加入甘氨酸乙酯盐酸盐1.954 g(14 mmol),在40 ℃下酰胺化不同时间。考察酰胺化反应时间对反应收率的影响,结果见表5。
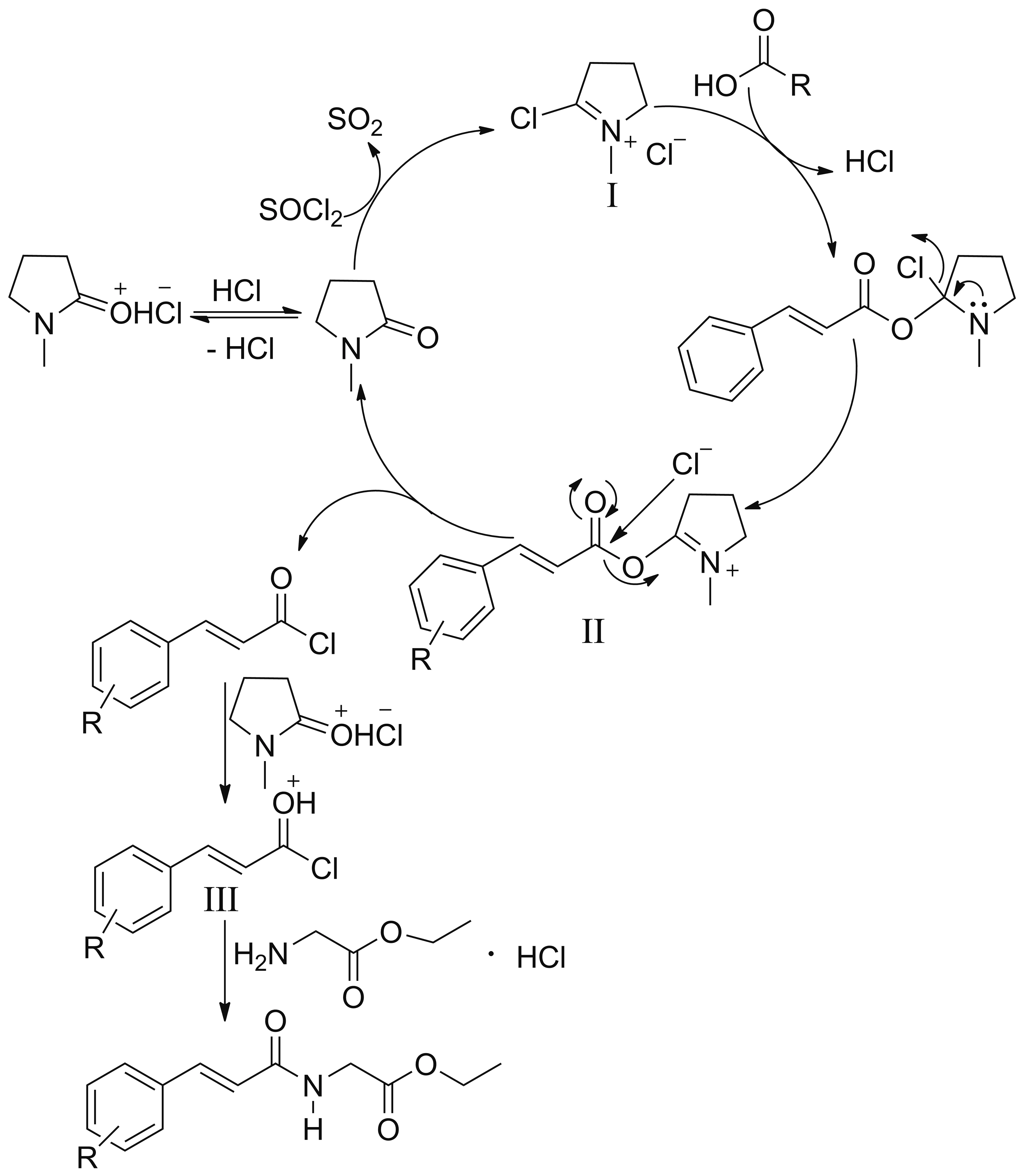
Scheme 2
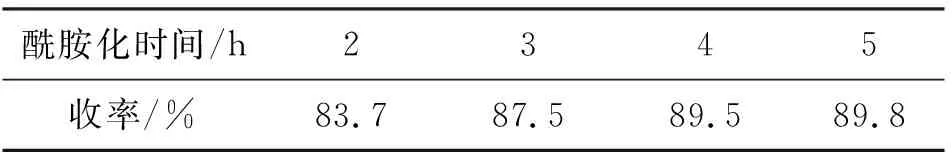
表5 酰胺化反应时间对反应收率的影响Table 5 The effect of amidation time on the yield
由表5可知,随着酰胺化反应时间的延长,反应收率有所升高,但继续增加反应时间,收率变化不明显。且随着酰胺化反应时间的增加,由于酰氯化反应中SOCl2未分离出来,在酰胺化反应中体系酰氯化进行的同时,副反应也在进行,反应混合体系颜色加深,酰胺化反应时间以4 h为宜。
综上可见,在最优条件[肉桂酸10mmol, NMP 7.5 mL,于20 ℃酰氯化反应0.5 h,于40 ℃酰胺化反应4 h,n(肉桂酸)/n(SOCl2)/n(甘氨酸乙酯盐酸盐)=1.0/1.2/1.4]下,收率89.5%。
2.2 反应机理
NMP促进反应进行的可能机理可从以下两个方面解释(Scheme 2): (1)NMP与SOCl2反应生成盐Ⅰ[18-20],该盐Ⅰ再与取代肉桂酸作用生成中间产物Ⅱ,由于中间产物Ⅱ的羰基碳比取代肉桂酸的羰基碳电正性强,所以更容易接受氯负离子的进攻,从而加速取代肉桂酰氯的生成,NMP吸收酰氯化反应中的副产物HCl生成NMP盐酸盐,促进酰氯化反应朝生成取代肉桂酰氯的方向进行;(2)由于取代肉桂酰氯未分离,NMP盐酸盐中可释放出的质子,甘氨酸乙酯盐酸盐本身溶解后也可释放出的质子,取代肉桂酰氯与质子结合生成中间体Ⅲ,使取代肉桂酰氯羰基碳原子更容易接受甘氨酸乙酯分子中氮原子上非键电子对的进攻,从而加速酰胺化反应的进行。
3 结论
在NMP催化作用下,合成得到一系列取代肉桂酰甘氨酸乙酯(2a~2g)。该方法具有反应条件温和、操作简便、收率较高等优点。
