嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶培养基及发酵条件优化
2020-05-12余奕宏丁小娟丁筑红宋煜婷陈思奇肖仕芸杜勃峰
余奕宏,丁小娟,丁筑红*,宋煜婷,王 翼,陈思奇,肖仕芸,杜勃峰
(贵州大学 酿酒与食品工程学院国家林业草原局刺梨工程技术研究中心 贵州省农畜产品贮藏加工重点实验室,贵州 贵阳 550025)
β-葡萄糖苷酶(β-glucosidase)在自然界的多种动植物和细菌及真菌体内广泛存在[1],可参与微生物、植物、动物和人体的大多数生化反应,其中包括碳水化合物的代谢,释放葡萄糖体和配基[2-4],并在维持生物体的正常生理功能中起重要作用。β-葡萄糖苷酶在活细胞内产生,并可在体外参与各类反应,如水解果汁及果酒中芳香前体物质产生香气[5],生产非离子表面活性剂烷基糖苷等[6],从而在工业化过程中发挥重要作用[7]。
动植物来源的β-葡萄糖苷酶的培养周期较长,提取工艺相对复杂,可操作性差[8],而通过微生物法制得的β-葡萄糖苷酶易分离纯化、价格低廉、产量高,可满足工业化应用需求[9-10]。工业上常用曲霉发酵产β-葡萄糖苷酶,但曲霉在食品卫生方面存在安全隐患[11],而乳酸菌来源的β-葡萄糖苷酶对其相关产品的营养价值及其功能特性有双重提升作用,如植物乳杆菌(Lactobacillus plantarum)β-葡萄糖苷酶可转化人参皂苷[12-13]、大豆异黄酮糖苷[14]。嗜酸乳杆菌(Lactobacillus acidophilus)属于乳杆菌属(Lactobacillus),是动物肠道菌群中的重要微生物,可以调节并改善肠道中的微生态平衡[15],还具有调节免疫[16]、减轻肥胖[17]等益生功能。目前,国内外针对微生物来源β-葡萄糖苷酶的研究主要集中在黑曲霉(Aspergillus niger)、木霉菌(Trichoderma)等,而对嗜酸乳杆菌产β-葡萄糖苷酶及其相关技术研究鲜有报道,且在工业化生产中,现有β-葡萄糖苷酶产量较低且活力普遍偏低,其来源的局限性及较低的产量制约着β-葡萄糖苷酶的工业化生产及应用[18]。
因此,本试验以前期获得的β-葡萄糖苷酶活性较高的嗜酸乳杆菌GIM.1.20为研究对象,通过单因素、正交试验、响应面分析优化其产β-葡萄糖苷酶的发酵培养基及发酵条件,旨在提高β-葡萄糖苷酶产量,为嗜酸乳杆菌功能的开发以及后续β-葡萄糖苷酶的生产应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
嗜酸乳杆菌(Lactobacillus acidophilus)GIM 1.208:本实验室前期筛选获得。
1.1.2 培养基
MRS培养基:酪蛋白胨10.0 g/L,酵母提取物2.0 g/L,乙酸钠5.0 g/L,吐温80 1.0 g/L,七水硫酸镁0.2 g/L,碳酸钙20.0 g/L,牛肉膏浸提物10.0 g/L,葡萄糖20.0 g/L,柠檬酸二胺2.0 g/L,磷酸氢二钾2.0 g/L,七水硫酸锰0.05 g/L,蒸馏水1.0 L,pH 6.8,121 ℃高压蒸汽灭菌20 min。
刺梨培养基:刺梨浆15 g,蒸馏水45 mL,自然pH,121 ℃高压蒸汽灭菌20 min。
1.1.3 化学试剂
葡萄糖(分析纯):天津市致远化学试剂有限公司;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)(分析纯):天津市兴复精细化工研究所;无水乙酸钠(分析纯):天津市鼎盛鑫化工有限公司;盐酸(分析纯):成都金山化学试剂有限公司;氢氧化钠(分析纯):天津市盛鑫源伟业贸易有限公司;碳酸钠(分析纯):重庆江川化工(集团)有限公司;对硝基苯酚(p-nitrophenol,p-NP)(纯度>98%):天津市科密欧化学试剂有限公司;4-硝基苯基-β-D-葡萄糖苷(p-Nitrophenyl-β-D-glucopyranoside,p-NPG)(纯度>98%):美国Sigma公司。
1.2 仪器与设备
E-201-C-9 pH复合电极:上海鸿盖仪器有限公司;SPX-150B-Z生化培养箱:上海博迅实业有限公司医疗设备;101-3A电热鼓风干燥箱:天津市泰斯特仪器有限公司;LD2X-50KBJ立式压力蒸汽灭菌器:上海申安医疗器械厂;L5S紫外-可见分光光度计:上海仪器分析仪器有限公司;SPECTRAMAX 190全波长光吸收酶标仪:美国MolecularDevices公司;TGLIOM台式高速冷冻离心机:长沙迈佳森仪器设备有限公司。
1.3 试验方法
1.3.1 嗜酸乳杆菌GIM1.208菌液的制备[19]
将Lactobacillus acidophilusGIM1.208接种于MRS培养基,37 ℃静置培养48 h。吸取1 mL已活化的嗜酸乳杆菌接种于5mLMRS培养基中,37℃静置培养24h,作为种子液备用。
1.3.2β-葡萄糖苷酶活力的测定
将种子液接种于培养基,37 ℃静置培养24 h,取菌液于10 000 r/min、4 ℃条件下离心10 min,取上清液,稀释至一定倍数,采用p-NPG法测定β-葡萄糖苷酶酶活[20-21]。
β-葡萄糖苷酶酶活定义:在37 ℃、pH 5.0反应条件下,1 mL粗酶液酶解p-NPG 1 min产生1 μmol p-NP的酶活力,定义为一个酶活力单位,以U/mL表示。
1.3.3 嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶发酵培养基的
筛选
将种子液按2%(V/V)接种量分别接种于MRS培养基和刺梨培养基,37 ℃静置培养24 h,测定β-葡萄糖苷酶活力,考察两种培养基对Lactobacillus acidophilusGIM1.208产β-葡萄糖苷酶的影响。
1.3.4 嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶发酵培养基优化
确定发酵培养基后,以葡萄糖为碳源[22-23],考察葡萄糖添加量(0、1.0%、2.0%、3.0%、4.0%、5.0%)、初始pH值(3.5、4.5、5.5、6.5、7.5、8.5)、CMC-Na添加量(0、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%)[24]对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响。初始发酵条件为接种量2%,料液比为1∶3(g∶mL),自然pH,37 ℃发酵24 h。
在单因素试验的基础上,以β-葡萄糖苷酶活力(Y)为评价指标,选择葡萄糖添加量(A)、初始pH值(B)及CMC-Na添加量(C)进行3因素3水平正交试验,因素与水平见表1。

表1 发酵培养基优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for fermentation medium optimization
1.3.5 嗜酸乳杆菌GIM1.208产B-葡萄糖苷酶发酵条件优化
采用单因素轮换法依次考察刺梨浆与水料液比1∶1、1∶2、1∶3、1∶4、1∶5、1∶6(g∶mL))、发酵温度(25 ℃、27 ℃、30 ℃、35 ℃、37 ℃、40 ℃)、发酵时间(12 h、24 h、36 h、48 h、60 h、72 h)及接种量(1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%)对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响。初始发酵条件为接种量2%,刺梨浆与水料液比1∶3(g∶mL),自然pH,培养24 h。
在单因素试验结果基础上,以β-葡萄糖苷酶活力(Y)为评价指标,选取对结果影响显著的因素发酵温度(D)、接种量(E)、刺梨浆与水料液比(F)进行3因素3水平Box-Behnken试验,因素与水平见表2。

表2 发酵条件优化响应面试验因素与水平Table 2 Factors and levels of response surface tests for fermentation conditions optimization
1.3.6 数据处理
每次试验重复3次;采用SPSS 22.0软件进行显著性分析,Design-Expert8.0.6软件设计响应面试验方案,建立数学模型并进行多元回归分析,Excel 2016制图。
2 结果与分析
2.1 嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶培养基筛选
利用MRS肉汤培养基和刺梨果培养基发酵嗜酸乳杆菌GIM 1.208产β-葡萄糖苷酶,研究发现,发酵24 h后,刺梨发酵培养基中β-葡萄糖苷酶活力为(3.997±0.303)U/mL,高于MRS肉汤培养基中β-葡萄糖苷酶活力[(1.770±0.203)U/mL],这可能与刺梨自身含有丰富的营养物质有关,这类物质可作为嗜酸乳杆菌GIM1.208发酵产β-葡萄糖苷酶的诱导物[25],促进嗜酸乳杆菌GIM1.208产酶。因此,选用刺梨培养基作为最适产酶培养基。
2.2 发酵培养基优化
2.2.1 葡萄糖添加量对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响
有研究发现,葡萄糖可改变β-葡萄糖苷酶的作用位点而增强酶活[26],因此,选择葡萄糖作为碳源,考察葡萄糖添加量对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响,结果见图1。由图1可知,当葡萄糖添加量为3%时,β-葡萄糖苷酶活力最高,为5.92 U/mL,分析原因可能是β-葡萄糖苷酶活性与发酵体系静电性质和酶结构相关[27],因此,选择葡萄糖3%作为碳源补充。

图1 葡萄糖添加量对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响Fig.1 Effect of glucose addition on β-glucosidase production by Lactobacillus acidophilus GIM1.208
2.2.2 初始pH值对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响
由图2可知,随着初始pH值的升高,β-葡萄糖苷酶活力呈现先升高后下降的趋势,当初始pH值为6.5时,β-葡萄糖苷酶活力达到最大,为5.54 U/mL。分析原因可能是随着发酵体系初始pH值的变化,酶的活性位点发生变化,对酶与底物的结合有影响,降低其活性[26]。因此,选取培养基初始pH值为6.5。
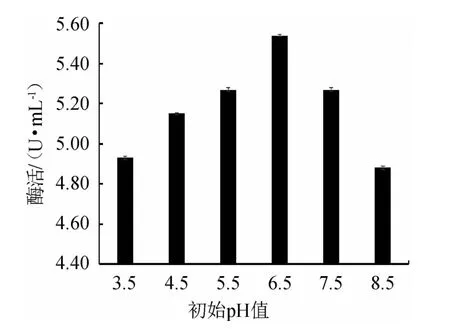
图2 初始pH值对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响Fig.2 Effect of initial pH on β-glucosidase production by Lactobacillus acidophilus GIM1.208
2.2.3 羧甲基纤维素钠对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响
β-葡萄糖苷酶是诱导酶类,可溶性CMC-Na有助于β-葡萄糖苷酶活性的提高[23,28]。由图3可知,随着CMC-Na添加量的增加,β-葡萄糖苷酶活力呈先升高后降低的趋势,当CMC-Na添加量为0.4%时,酶活力最高,为6.13 U/mL。因此,选择CMC-Na添加量为0.4%。

图3 羧甲基纤维素钠添加量对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响Fig.3 Effect of carboxymethylcellulose sodium addition on β-glucosidase production by Lactobacillus acidophilus GIM1.208
2.2.4 发酵培养基优化正交试验结果与分析
发酵培养基优化正交试验结果与分析见表3,方差分析结果见表4。

表3 发酵培养基优化正交试验结果与分析Table 3 Results and analysis of orthogonal tests for fermentation medium optimization

续表

表4 正交试验结果的方差分析Table 4 Variance analysis of orthogonal tests results
由表3可知,各因素对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响的主次顺序为A>C>B,即葡萄糖添加量>CMC-Na添加量>初始pH值,最优试验组合为A2B1C2,即葡萄糖添加量3.0%,培养基初始pH值5.5,CMC-Na添加量0.4%。在此优化条件下,β-葡萄糖苷酶活力为9.72 U/mL。由表4可知,补充葡萄糖和诱导物CMC-Na对产酶效果具有显著性影响(P<0.05),而初始pH值对结果影响不显著(P>0.05)。
2.3 发酵条件的优化
2.3.1 料液比对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响
水分会影响发酵过程中胞外酶的合成与分泌[29]。由图4可知,当刺梨浆与水料液比为1∶1~1∶4(g∶mL)时,β-葡萄糖苷酶活力逐渐升高;当料液比为1∶4(g∶mL)时,β-葡萄糖苷酶活力达到最大,为12.35 U/mL;当料液比<1∶4(g∶mL)之后,β-葡萄糖苷酶活力呈现下降趋势。因此,选择最佳料液比为1∶4(g∶mL)。
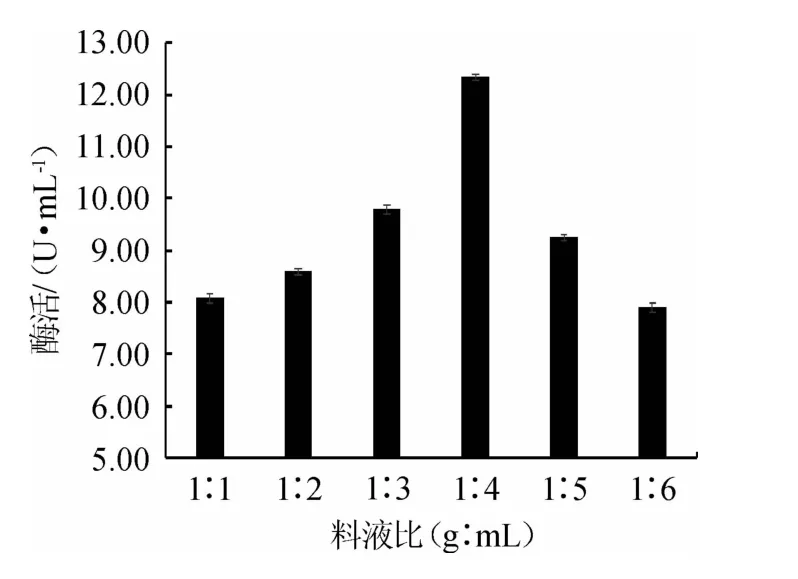
图4 料液比对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响Fig.4 Effect of material to liquid ratio on β-glucosidase production by Lactobacillus acidophilus GIM1.208
2.3.2 发酵温度对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响
由图5可知,当发酵温度为25~30 ℃时,随着发酵温度的升高,嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的能力呈上升趋势,这可能是因为温度升高提高了质膜的通透性和代谢反应的速度[30],利于细胞内外环境之间的养分运输和产物交换。当发酵温度为30 ℃时,其酶活性达到最大值,为15.15 U/mL。当发酵温度高于30 ℃之后,β-葡萄糖苷酶活力下降[31-32]。因此,选择最佳发酵温度为30 ℃。

图5 发酵温度对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响Fig.5 Effect of fermentation temperature on β-glucosidase production by Lactobacillus acidophilus GIM1.208
2.3.3 发酵时间对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响
由图6可知,当发酵时间<24 h之前,酶活性增加;当发酵24 h时,酶活力达到最大,为15.33 U/mL;当发酵时间>24 h之后,酶活性呈现缓慢降低趋势。此时微生物生长至衰亡期,代谢减弱、酶活性降低,且发酵后期,微生物次级代谢产物不断积累,抑制了嗜酸乳杆菌产酶而降低酶活性[33]。因此,选择最佳发酵时间为24 h。

图6 发酵时间对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响Fig.6 Effect of fermentation time on β-glucosidase production by Lactobacillus acidophilus GIM1.208
2.3.4 接种量对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响
接种量过少或过多都不利于β-葡萄糖苷酶的合成[20,34]。由图7可知,当接种量<2.5%之前,β-葡萄糖苷酶活力逐渐升高;当在接种量为2.5%时,β-葡萄糖苷酶活性达到最大,为15.85 U/mL;当接种量>2.5%之后,随着培养基内部营养物质的匮乏,β-葡萄糖苷酶活力缓慢减小。因此,选择最佳接种量为2.5%。

图7 接种量对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的影响Fig.7 Effect of inoculum on β-glucosidase production by Lactobacillus acidophilus GIM1.208
2.3.5 Box-Behnken响应面试验结果与分析
发酵条件优化响应面试验结果与分析见表5,方差分析见表6。

表5 发酵条件优化Box-Behnken试验结果与分析Table 5 Results and analysis of Box-Behnken tests for fermentation conditions optimization
采用Design Expert 8.0.6软件对表5的结果进行多元二次回归拟合,得到β-葡萄糖苷酶活力(Y)与发酵温度(D)、接种量(E)、料液比(F)的二次多项回归方程:Y=-86.43+3.94D+16.16E+10.45F+0.05DE-0.01DF+0.17EF-0.06D2-3.61E2-1.30F2。

表6 回归模型的方差分析Table 6 Variance analysis of regression model
由表6可知,回归模型极显著(P<0.01),失拟项不显著(P>0.05),表明回归方程拟合效果较好,模型选择恰当。决定系数R2=0.952 0,调整决定系数R2Adj=0.988 0,说明预测值与实际测定值间存在较好的相关性,模型选择正确,可用此模型对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的发酵产酶条件进行预测。一次项D及二次项D2、E2、F2对结果影响极显著(P<0.01),一次项E对结果影响显著(P<0.05),而其他项对结果影响不显著(P>0.05)。
采用Design Expert 8.0.6软件对模型进行优化求解,以β-葡萄糖苷酶活力为响应值,得到嗜酸乳杆菌产β-葡萄糖苷酶的最优发酵条件为发酵温度31.24 ℃、接种量2.57%、料液比1∶4.02,在此最优条件下,最大酶活力预测值为16.81 U/mL。为便于实际操作,将最优发酵条件修订为发酵温度31 ℃、接种量2.6%、料液比1∶4(g∶mL),在此最优条件下重复试验6次,得到β-葡萄糖苷酶活力实际值为16.80 U/mL,与模型预测值相近,可知该模型对嗜酸乳杆菌产β-葡萄糖苷酶的情况有较为准确的预测,证明了响应面优化对嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的发酵生产具有一定的指导意义。
3 结论
通过单因素试验及正交试验确定嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶的最佳培养基组成为葡萄糖添加量3.0%,羧甲基纤维素钠添加量0.4%,初始pH值5.5;通过单因素试验及响应面试验确定最佳发酵条件为发酵温度31 ℃,发酵时间24 h,接种量2.6%,料液比1∶4(g∶mL)。在此最优条件下,β-葡萄糖苷酶活力达16.80 U/mL,是优化前酶活力(4.30 U/mL)的3.90倍。本试验结果为今后通过生物技术手段产β-葡萄糖苷酶应用于工业生产提供了新的候选菌株,并为嗜酸乳杆菌功能及应用价值的提升提供了理论参考。
