白背叶根水提取物对肝纤维化大鼠NF-κB 信号通路的影响
2020-05-12波檀燕君麦婉婷郭富双梁秋云黄秋洁叶
章 波檀燕君麦婉婷郭富双梁秋云黄秋洁叶 勇∗
(1.广西医科大学药学院,广西 南宁 530021;2.广西中医药大学药学院,广西 南宁 530001;3.南宁市第一人民医院药剂科,广西 南宁 530001)
慢性肝损伤所导致的肝脏纤维化是一个可逆过程,其受多种机制调节。肝纤维化产生的中心环节为肝星状细胞活化,活化的肝星状细胞大量分泌细胞外基质,使得细胞外基质生成与降解平衡紊乱,导致大量细胞外基质沉积,从而产生肝纤维化[1]。白背叶根Mallotus apelta(lour.)Muell.-Arg.root 为大戟科植物白背叶的干燥根,民间常用其治疗肝炎。有研究[2-3]表明白背叶根对四氯化碳(CCl4)诱导大鼠肝纤维化有较好的治疗作用,但对其作用机制研究尚不明确。本实验通过对NF-κB 信号通路的研究,在分子水平探讨其抗肝纤维化的机制,以期为白背叶根药用价值的开发提供理论依据。
1 材料与方法
1.1 药物 白背叶根采于广西壮族自治区贺州市,经广西中医药大学傅鹏副教授鉴定为大戟科植物白背叶的根;秋水仙碱(批号20170718,)购自广东彼迪药业有限公司。
1.2 动物 SPF 级雄性SD 大鼠,体质量170~200 g,购于广西医科大学动物实验中心。实验动物生产许可证SCXK(桂)2014-0002;实验动 物使用 许可证 SYXK(桂)2014-0003。
1.3 试剂 PC-Ⅲ(批 号20171010)、Col-Ⅳ(批号20171102)、HA(批号20170910)、LN(批号20171010)、MMP-9(批号20171210)购自上海源叶生物科技公司;IL-1β(批号R180102-007 a)、IL-6(批号R180102-003a)试剂盒购自欣博盛生物科技有限公司;TRIZOL 试剂(批号180401)、逆转录试剂 盒(批 号00621709)购自美 国Thermo Fisher 公司;qPCR 试剂盒(批号154047520)购自德国QIAGEN 公 司;NF-κBp65(批 号00057379)、IκBα(批号00024903)兔多克隆抗体购自武汉三鹰生物技术有限公司;山羊抗兔-IgG(批号9300014001)购自武汉爱博泰克生物科技有限公司。
1.4 仪器 台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);全自动生化分析仪(日本Hitachi 公司);紫外分光光度计(日本津岛公司);连续光谱扫描式酶标仪(美国Molecular Devices 公司);实时荧光定量PCR 仪(美国Thermo Fisher 公司);MP-300 V 电泳仪(美国Bio-Rad 公司)。
2 方法
2.1 白背叶根水提取物制备 白背叶根阴干后粉碎至粗粉,称取100 g,1 000 mL 双蒸水煎煮2 h,纱布过滤,得提取液。药渣以上述方法煎煮2 次,合并滤液,离心去渣。将滤液旋转蒸发浓缩,干燥至膏状,以双蒸水配成5 g/mL(生药量)溶液,储于4 ℃冰箱备用。
2.2 造模、分组、给药 将SD 雄性大鼠随机分为对照组,模型组,秋水仙碱组(0.2 mg/kg),白背叶根水提取物高、中、低剂量组(生药5、2.5、1.25 g/kg),每组12 只。除对照组灌胃给予橄榄油外,其余各组大鼠给予体积分数50% CCl4的橄榄油(1 mL/kg)造模,每周灌胃给药2 次,每5 d 根据实际体质量调整CCl4剂量;第8 周,对照组、模型组给予等量生理盐水,给药组按照给药剂量灌胃给药,1 次/d,连续给药8 周,同时除对照组灌胃给予橄榄油外,其余各组大鼠给予体积分数50%CCl4的橄榄油(1 mL/kg)造模。
2.3 血清及肝脏标本的采集 大鼠处死前一晚禁食不禁水,采血前称定各组大鼠体质量,腹腔注射10%水合氯醛麻醉,无抗凝真空采血管腹主动脉采血,常温下3 000 r/min离心血液,分离血清,置于-80 ℃冰箱保存,用以后续测定MMP-9、IL-1β、IL-6 水平。各组大鼠肝脏以生理盐水清洗后称定质量,切取肝左叶边缘2 cm 大小,置于10%福尔马林溶液固定,用于HE 染色;余肝脏置于-80 ℃冰箱保存,用于PC-Ⅲ、Col-Ⅳ、HA、LN 水平的测定及qRT-PCR 和Western blot 实验。
2.4 观察组织肝纤维化程度 采用HE 染色。将经福尔马林溶液固定后的肝脏组织常规脱水、石蜡包埋、切片,进行HE 染色,于显微镜下观察各组大鼠肝脏的肝纤维化程度。
2.5 血清生化指标及炎症因子检测 采用全自动生化检测仪检测血清中ALT、AST、ALP、ALB 及TP 水平,采用ELISA 法测定血清中MMP-9 及IL-1β、IL-6 水平。
2.6 肝纤维化指标测定 采用ELISA 法测定肝组织匀浆中PC-Ⅲ、Col-Ⅳ、HA、LN 水平,严格按照试剂盒说明书进行操作。
2.7Col-Ⅰ、TNF-αmRNA 检测 TRIZOL 法提取总RNA,逆转录后进行qRT-PCR,结果采用2-ΔΔCt法进行相对定量分析。引物序列见表1,由TaKaRa 宝生物工程(大连)有限公司设计合成。

表1 引物序列
2.8 检测肝组织中NF-κB p65、IκBα 蛋白 采用Western blot 法。提取各组肝组织的总蛋白,微量核酸检测仪进行蛋白定量。取100 μL 蛋白样品至EP 管中,加入5×SDS 上样缓冲液25 μL,100 ℃煮10 min 进行蛋白质变性,冰上冷却,置于-20 ℃冰箱保存。电泳采用10% SDS-PAGE 凝胶,蛋白质转至PVDF 膜,5%脱脂牛奶于4 ℃封闭1 h,分别用NF-κB p65 抗体(1∶1 000),IκBα(1∶1 000),βactin 抗体(1∶1 000)4 ℃孵育过夜,然后加入山羊抗兔-Ig G 抗体(1∶30 000)避光孵育1 h。将每个样本所测得的NF-κB p65、IκBα 蛋白灰度值,分别与β-actin 蛋白的灰度值相比,计算灰度比值。
2.9 统计学分析 以SPSS 21.0 统计软件分析数据,计量资料均以()表示,方差齐性检验,组间比较采用单因素方差分析,方差齐者组间两两比较应用LSD 法;方差不齐则应用秩和检验,以P<0.05表示差异具有统计学意义。
3 结果
3.1 大鼠生存状况及肝组织病理观察 实验结束前,除对照组外其余各组大鼠均有死亡。其中,模型组死亡4 只,秋水仙碱组死亡1 只,白背叶根水提取物高剂量组死亡1只,白背叶根水提取物中剂量组死亡1 只,白背叶根水提取物低剂量组死亡3 只。HE 染色显示,对照组大鼠肝小叶结构完整,肝索排列整齐,肝细胞未见肿胀及其他异常,未见淋巴细胞浸润及纤维沉积。模型组大鼠肝脏假小叶形成明显,肝索排列紊乱,出现淋巴细胞浸润,肝细胞出现肿胀、气球样变等病态改变,部分肝细胞发生脂肪变性,肝脏汇管区沉积大量胶原纤维。秋水仙碱组及白背叶根水提取物组肝组织损伤明显改善,白背叶根水提取物低剂量组肝组织损伤较模型组有所减轻。见图1。
3.2 大鼠血清AST、ALT、ALP、ALB 及TP 水平 与对照组比较,模型组大鼠血清AST、ALT 及ALP 水平升高,ALB、TP 水平下降(P<0.01);与模型组比较,秋水仙碱组及白背叶根水提取物中、高剂量组大鼠血清中AST、ALT 及ALP 水平下降,高剂量组ALB、TP 水平上升(P<0.05,P<0.01)。见图2~3。
3.3 大鼠肝组织中PC-Ⅲ、Col-Ⅳ、HA、LN 水平 与对照组比较,模型组大鼠肝组织中PC-Ⅲ、Col-Ⅳ、HA、LN水平升高(P<0.01);与模型组比较,秋水仙碱组及白背叶根水提取物中、高剂量组肝组织中以上指标水平降低(P<0.05,P<0.01)。见图4。
3.4 大鼠血清中MMP-9、IL-1β、IL-6 水平的影响 与对照组比较,模型组大鼠血清MMP-9、IL-1β、IL-6 水平升高(P<0.01);与模型组比较,秋水仙碱组及白背叶根水提取物中、高剂量 组下调MMP-9、IL-1β、IL-6 水 平(P<0.05)。见图5~6。
3.5 大鼠肝脏指数 与对照组比较,模型组大鼠肝脏指数升高(P<0.01);与模型组比较,秋水仙碱组及白背叶根水提取物中、高剂量组大鼠肝脏指数降低(P<0.05)。见图7。
3.6 肝组织中Col-Ⅰ和TNF-αmRNA 的表达 与对照组比较,模型组大鼠肝组织中Col-Ⅰ和TNF-αmRNA 表达升高(P<0.01);与模型组比较,秋水仙碱组和白背叶根水提取物中、高组抑制了大鼠肝组织中Col-Ⅰ和TNF-αmRNA 的表达(P<0.05,P<0.01)。见图8。
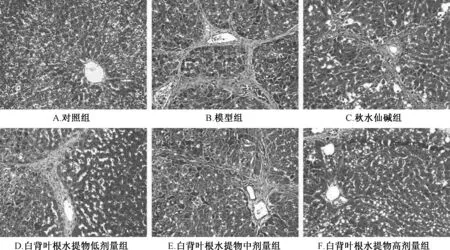
图1 HE 染色观察各组大鼠肝组织病理改变(×100)
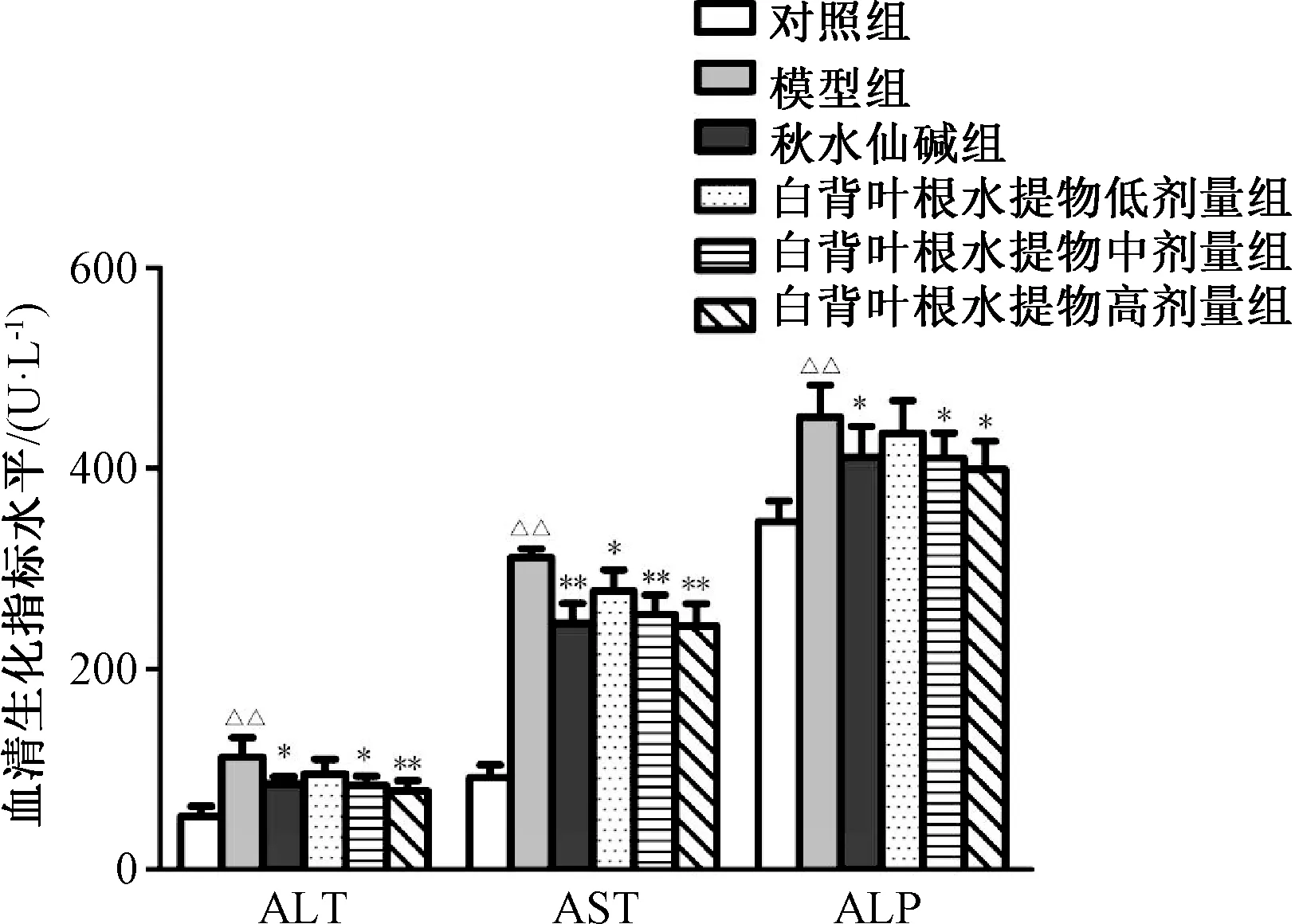
图2 白背叶根水提取物对肝纤维化大鼠血清中AST、ALT 及ALP 的影响
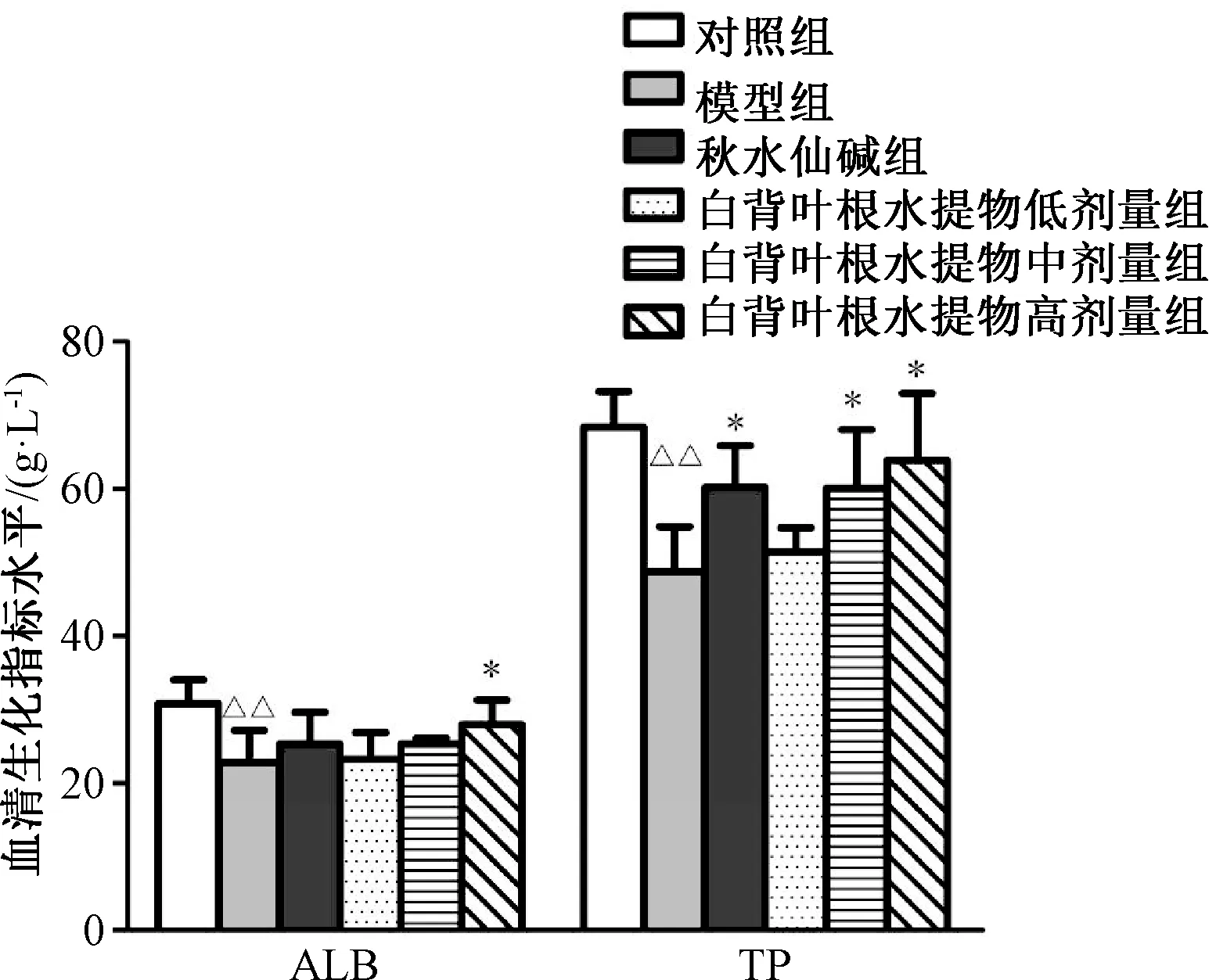
图3 白背叶根水提取物对肝纤维化大鼠血清中ALB、TP 的影响
3.7 肝组织中NF-κB p65 及IκBα 蛋白表达 与对照组比较,模型组NF-κB p65 蛋白表达提高(P<0.01),IκBα 蛋白表达水平降低(P<0.01);与模型组比较,秋水仙碱和白背叶根水提取物中、高剂量组明显降低NF-κB p65 蛋白表达(P<0.01),提高IκBα 蛋白表达(P<0.01)。见图9~10。
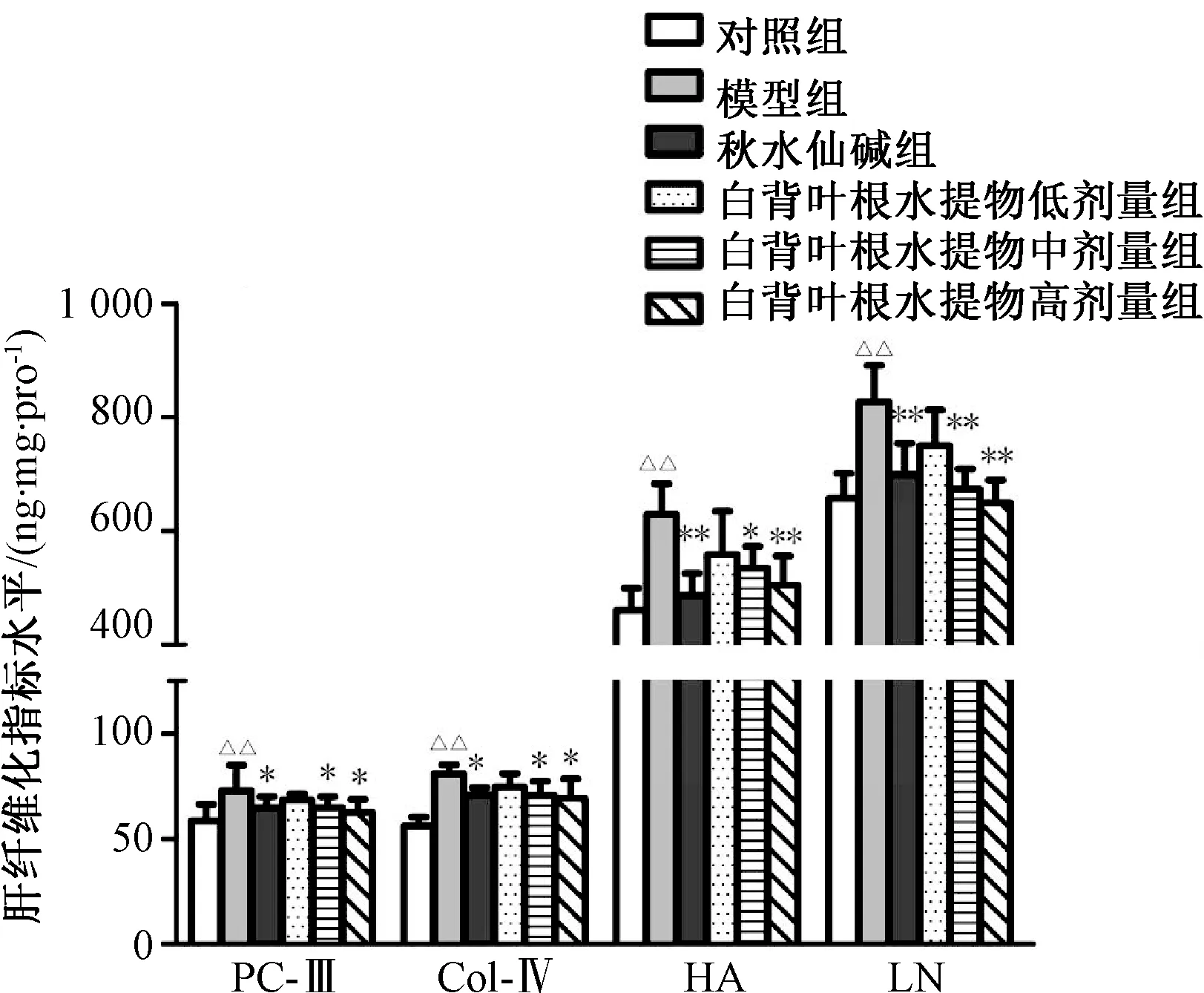
图4 白背叶根水提取物对肝纤维化大鼠肝组织中PC-Ⅲ、Col-Ⅳ、HA、LN 水平的影响
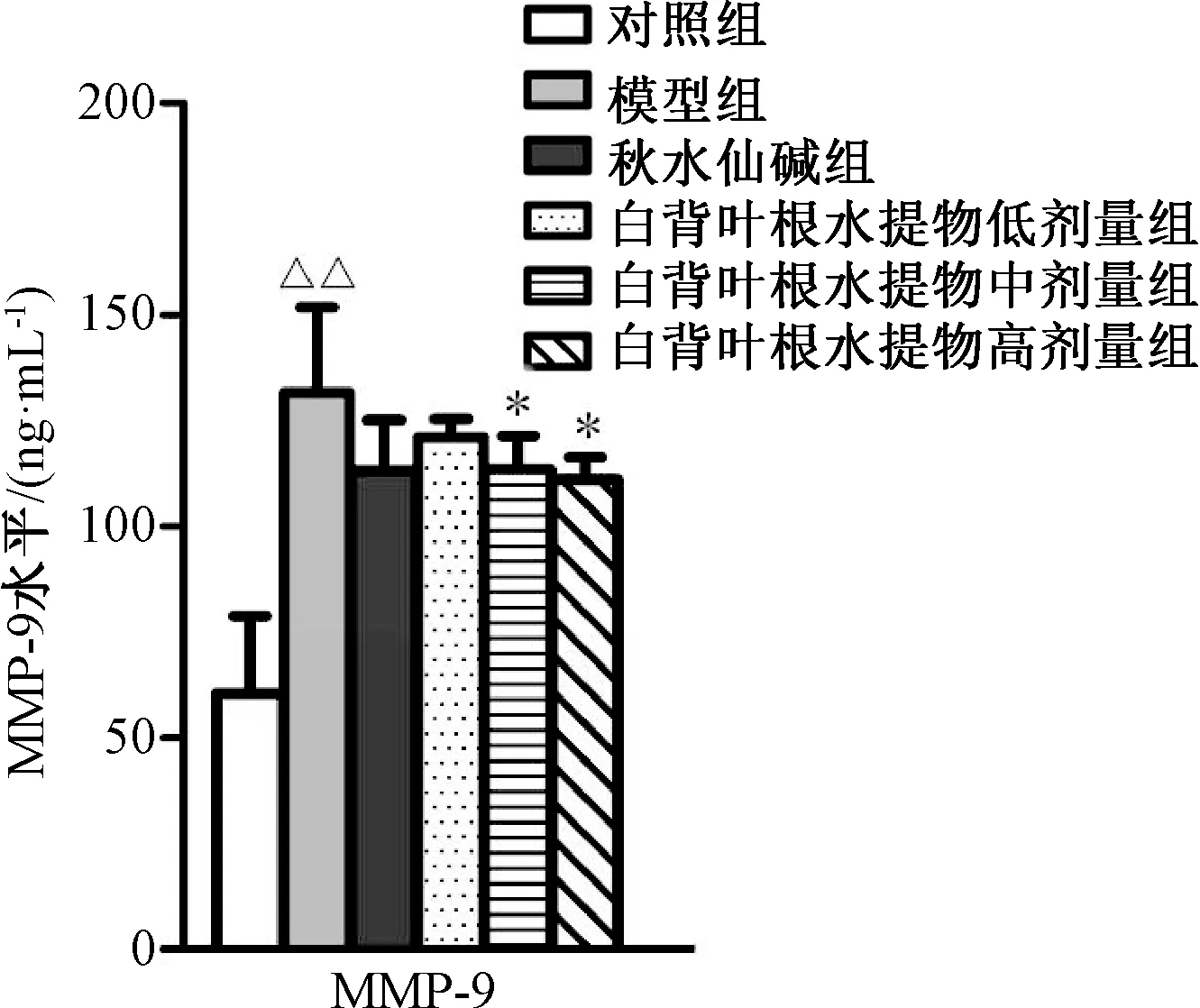
图5 白背叶根水提取物对肝纤维化大鼠血清中MMP-9 水平的影响
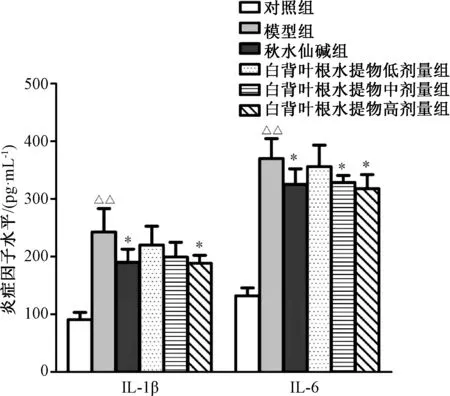
图6 白背叶根水提取物对肝纤维化大鼠血清中IL-1β、IL-6 水平的影响
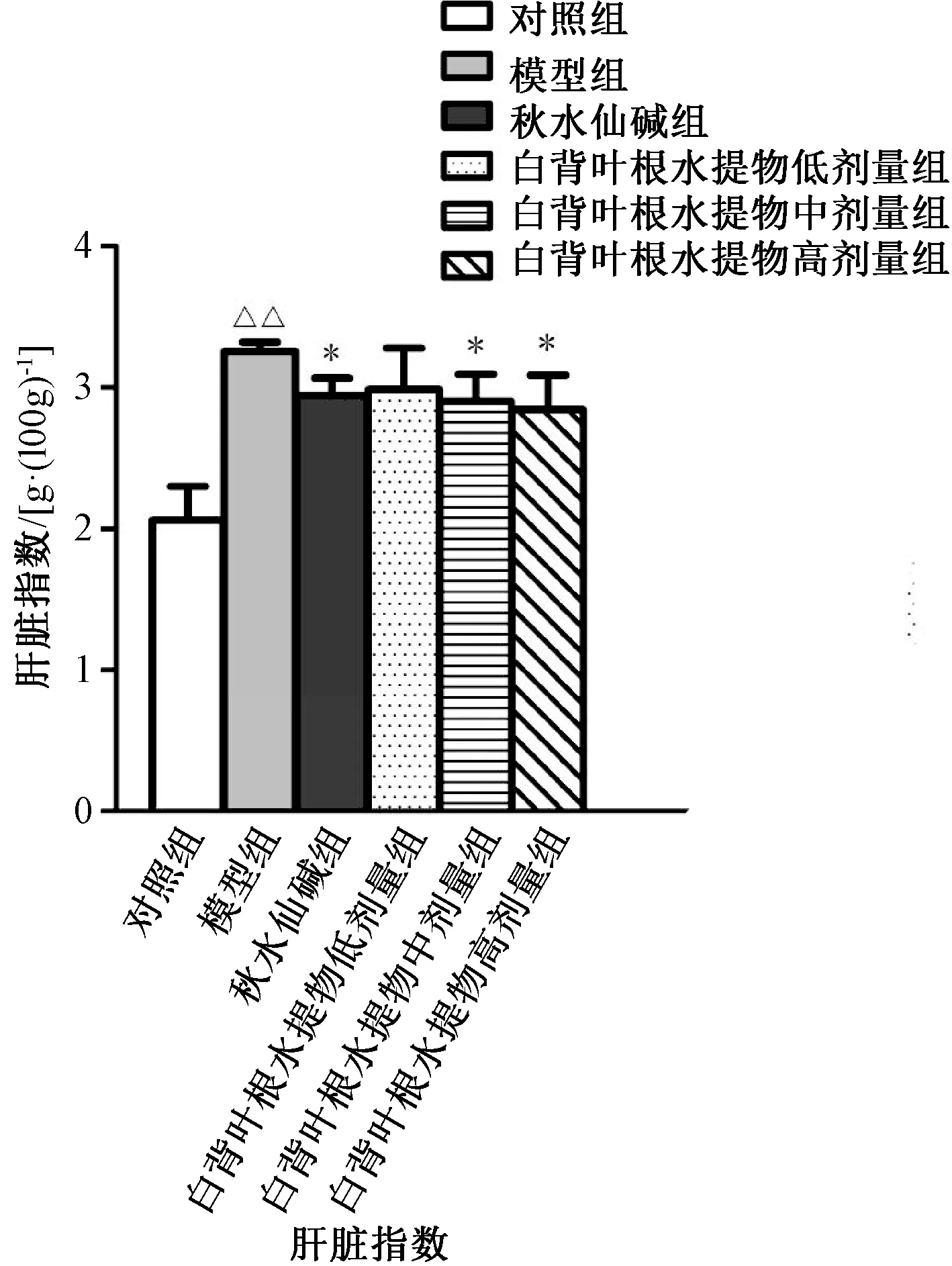
图7 白背叶根水提取物对肝纤维化大鼠肝脏指数的影响()
4 讨论
肝纤维化是多数慢性肝脏疾病发展进程中的一个病理改变,若不及时干预则可导致肝硬化甚至肝癌[4]。目前化学合成药物对于肝纤维化的治疗效果并不理想[5],越来越多的学者开始对传统中草药进行研究,以期找到更好的治疗肝纤维化药物[6-8],本研究拟对白背叶根治疗肝纤维化的作用机制进行探究。
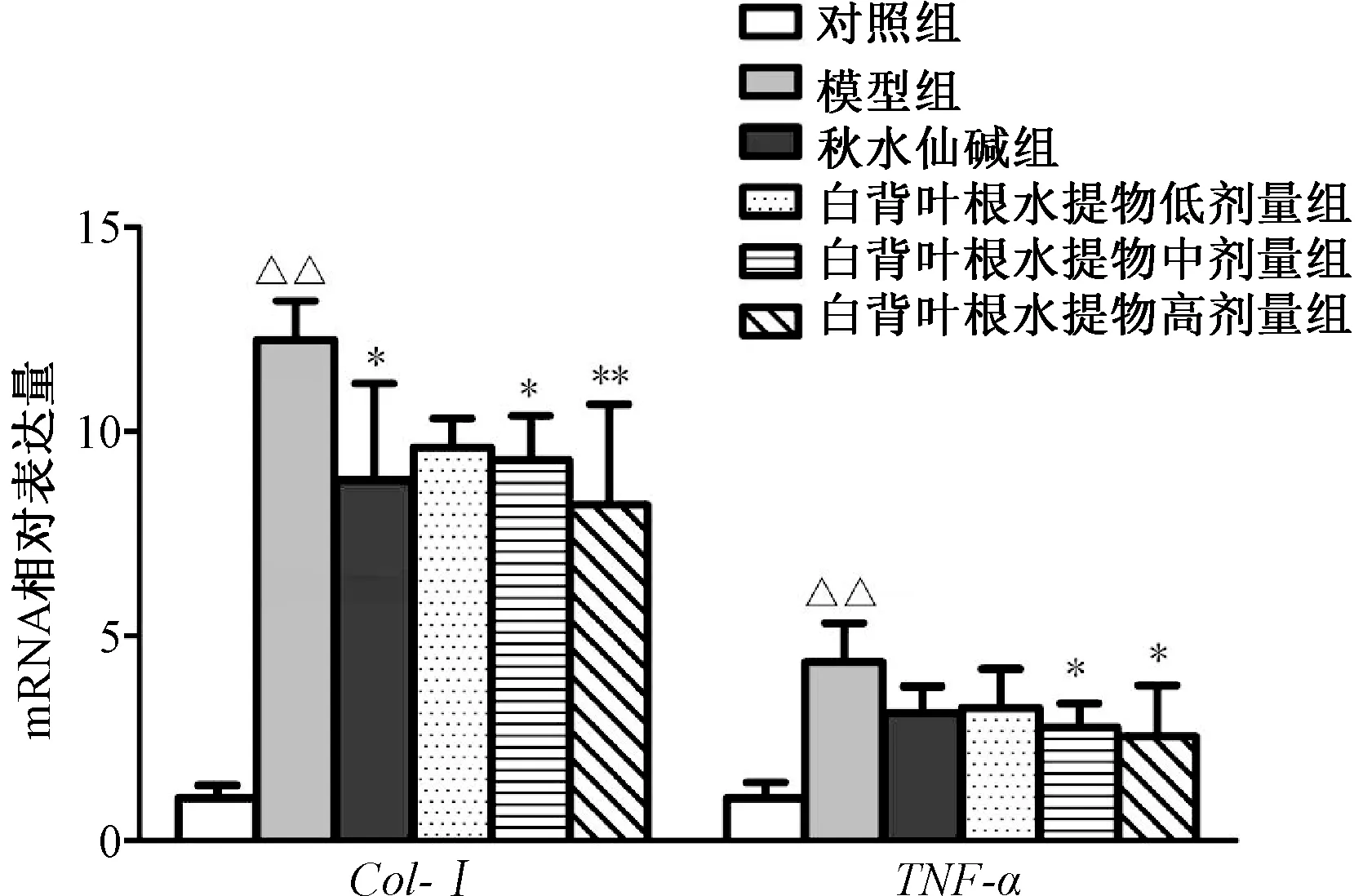
图8 白背叶根水提取物对肝组织中Col-Ⅰ和TNF-α mRNA 表达的影响

图9 肝组织中NF-κBp65、IκBα 蛋白的表达水平
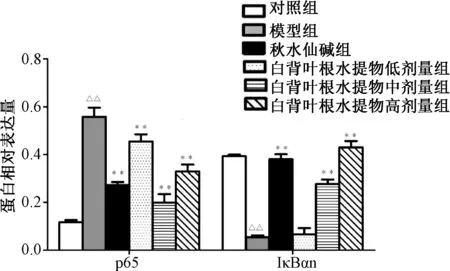
图10 白背叶根水提取物对肝组织中NF-κBp65、IκBα蛋白表达水平的影响
CCl4常被用作诱导动物肝损伤及肝纤维化,其经代谢可以产生大量自由基,对肝细胞膜多不饱和脂肪酸的攻击导致脂质过氧化[9]。肝脏受损后,ALB 及TP 合成功能受到影响,ALT、AST 和ALP 大量进入血液[10]。肝细胞受损会导致大量炎症因子的释放,进一步促进胶原的合成与积累[11]。PC-Ⅲ、Col-Ⅳ、HA、LN 常被临床用以判断肝纤维化程度,是肝纤维化改变的敏感指标[12]。TNF-α 是一种强大的致炎因子,可联合如IL-1β、IL-6 等细胞因子共同刺激肝星状细胞活化,从而影响肝纤维化的启动与发生[13]。Col-Ⅰ是细胞外基质的主要成分之一,可以代替血窦内皮下间隙的基膜,因此对肝纤维化发展中起重要作用[14]。MMP-9 是调节肝内细胞外基质降解的主要酶类之一,随着肝纤维化程度的加深,机体代偿性降解过度沉积的胶原纤维,使得MMP-9 水平增高[15]。本研究结果显示,与模型组大鼠相比,白背叶根水提取物组大鼠血清中ALT、AST、ALP、IL-1β、IL-6 和MMP-9 的水平显著降低,ALB、TP的水平明显提高;同时发现Col-Ⅰ及TNF-αmRNA 表达受到抑制,提示白背叶根水提取物可能通过减轻炎症反应及调节MMP-9 活性的途径改善肝纤维化。
有研究表明[16]NF-κB 信号通路可以通过调节炎性细胞因子来影响肝纤维化,其异常激活可导致机体免疫、炎症及生长反应的相关基因表达异常[17]。NF-κB 家族由5 种亚基所组成(p50、p52、cRel、p65 /RelA 和RelB)[18]。静息细胞中,p65/p50 异源二聚体与IκBα 在细胞质中形成无活性三聚体,阻止了p65/p50 易位至细胞核[19]。当肝脏受到各种刺激源刺激,致使IκB 激酶复合物磷酸化,导致IκBα蛋白降解,破坏了无活性三聚体,释放p65/p50 异源二聚体易位至细胞核以调节各种与肝纤维化相关的基因进行表达,最终引起肝纤维化的启动与发展[20]。本研究表明白背叶根水提取物可以明显抑制p65 及IκBα 蛋白的表达,提示白背叶根水提取物可以通过抑制NF-κB 信号通路的途径抑制肝脏炎症反应,从而发挥其改善肝纤维化的作用。
综上所述,白背叶根水提取物可以通过抑制CCl4诱导肝纤维化大鼠肝组织中p65 及IκBα 蛋白的表达,从而抑制NF-κB 信号通路激活,使机体炎症反应减轻,最终改善大鼠肝纤维化。但本研究缺少对NF-κB 信号通路正向及反向靶基因的研究,需进一步探索以便更加深入的阐述白背叶根水提取物抗肝纤维化的机制。
