磁性羧甲基纤维素基水凝胶的制备及其对Cu2+的吸附行为1)
2020-05-12刘学张璐高鸣霞孔德功戚后娟黄占华
刘学 张璐 高鸣霞 孔德功 戚后娟 黄占华
(东北林业大学,哈尔滨,150040)
随着工业的快速发展,环境的问题日益暴露出来,其中重金属污染给人类生存和健康带来了极大的危害[1]。重金属作为一类危害极大的污染物,可以通过水体积累和食物链直接或间接传递等方式对水体环境产生危害,并严重破坏了生态环境。其中重金属铜的污染物,可以腐蚀皮肤或损伤肝、肾、脾等造成急性肾衰竭,甚至可以引发癌变[2]。重金属铜的污染主要来源于电镀、冶炼、五金加工、矿山开采、石油化工和化学工业等部门排放的废水。铜的过量使用会阻碍到植物对养分的吸收,损害到人体内分泌腺的功能,刺激消化系统,会引起腹痛、呕吐、结膜炎等疾病[3]。
磁性水凝胶是一种新型智能性高分子材料,它在水中能够溶胀络合金属离子并形成稳定的交联高分子三维网络结构[4-6],在环境污染水处理领域中的研究越来越引起科研工作者的关注[7]。磁性纤维素基水凝胶作为一种易分离的吸附材料,具有独特磁响应性、易于分离和重复利用及可生物降解等特点,可用于吸附除去废水中的有机污染物[8]、无机污染物[9]和重金属离子[10]等。磁性纤维素基水凝胶制备简单及对重金属离子有良好的吸附能力,已成为解决水体重金属污染问题的新材料。目前的诸多研究中,磁性纤维素基吸附材料对重金属离子的吸附效果还与以石化资源为原料的聚合物吸附剂存在较大差距[11],为了开发具有高吸附性的纤维素基水凝胶新材料,笔者采用以环氧氯丙烷为交联剂,以羧甲基纤维素、β-环糊精和具有磁响应性的Fe3O4纳米粒子为原料,通过接枝共聚的方法制备了磁性纤维素基水凝胶(MHG),以在水环境中污染较为严重的金属铜离子(Cu2+)作为检测MHG吸附性能的对象,主要对其在不同温度和不同Cu2+溶液质量浓度中的吸附行为进行研究,分析了MHG对Cu2+的吸附性能,以此验证产物MHG在去除水环境中的重金属方面的潜在应用。
1 材料与方法
1.1 试剂与仪器
羧甲基纤维素(分析纯,Aladdin Industrial Corporation);β-环糊精(分析纯,天津市科密欧化学试剂开发中心);液体石蜡(化学纯,天津市巴斯夫化工有限公司);OP-10乳化剂(分析纯,天津市科密欧化学试剂开发中心);环氧氯丙烷(分析纯,天津基准化学试剂有限公司);硝酸铜(分析纯,天津市致远化学试剂有限公司)。
傅里叶红外分光光度计(iS10,Nicolet公司);扫描电镜(QUANTA200,FEI公司);原子吸收分光光度计(990F,北京普析通用公司)。
1.2 MHG的制备方法
将一定配比的羧甲基纤维素(CMC)、β-环糊精(β-CD)、氢氧化钠、去离子水混合放置烧杯中至溶解;在溶解体系加入150 mL的石蜡、乳化剂及采用共沉淀方法制备[12]的直径为100 nm的Fe3O4粒子溶液,并乳化30 min。乳化结束后,乳液转移至三口瓶中在40 ℃的水浴中进行机械搅拌并加入体积分数为40%的NaOH和20 mL环氧氯丙烷溶液进行聚合反应。反应进行6 h后,对聚合物依次进行水洗、醇洗以去除石蜡等溶剂后,得MHG粗产物;再将MHG粗产物于去离子水中透析7 d,经过滤后得精制MHG。
1.3 MHG的红外光谱分析
将MHG样品冷冻干燥后进行红外光谱分析(FTIR)。采用Nicolet公司iS10型号傅里叶红外分谱仪测定红外光谱,测定区间为4 000~500 cm-1,扫描次数为16次。
1.4 MHG的表面形貌观察
为观察MHG的表面形貌,使用FEI公司的QUANTA200扫描电子显微镜对其微观形貌进行表征。将冷冻干燥后的样品喷金处理,在扫描电子显微镜下观察并测定。
1.5 MHG的溶胀性能分析
采用称质量法测定MHG在室温条件下溶胀不同时间后的溶胀率(RS)[13],称取20g吸水达到饱和的MHG置于恒质量表面皿中,用干燥箱干燥。每隔一定时间取出MHG样品,快速称量其质量并记录。计算其对应的溶胀率,计算公式[14]如下:
RS=(me-md)/md。
(1)
式中:md为溶胀前的磁性干凝胶质量(g);me为磁性凝胶溶胀平衡后质量(g)。
1.6 MHG对金属铜离子吸附性能分析
分别配制质量浓度为50、100 mg/L的Cu2+溶液,于500 mL烧杯中分别加入0.1 g磁性干凝胶和400 mL不同质量浓度的Cu2+溶液,在20 ℃下静置吸附反应50 min。使用普析TAS-990火焰原子吸收分光光度计分别测定每隔一定时间吸附后溶液中Cu2+的质量浓度,计算对应的吸附量,得不同质量浓度的Cu2+溶液的等温吸附曲线。计算公式[15]如下:
Q=(C0-Ce)V/m。
(2)
式中:Q为吸附量(mg/g);V为加入的Cu2+溶液体积(L);m为加入的磁性干凝胶的质量(g);C0、Ce为吸附前后溶液中Cu2+的质量浓度(mg/L)。
取0.1 g磁性干凝胶和400 mL的质量浓度50 mg/L Cu2+溶液于500 mL烧杯中,分别在20、25、30、35、40 ℃下静置吸附反应50 min,测定不同吸附温度对吸附效果的影响。使用普析TAS-990火焰原子吸收分光光度计分别测定每隔一定时间吸附后溶液中Cu2+的质量浓度,按公式(2)计算对应的吸附量。
2 结果与分析
2.1 MHG的FTIR分析
原料CMC、β-CD以及负载Fe3O4粒子前后水凝胶的FTIR谱图如图1所示。

图1 产物的FTIR谱图
CMC和负载Fe3O4粒子前后水凝胶在3 320、2 927、1 594、1 411、1 045 cm-1有着共同的吸收峰,分别对应的官能团是O—H(伸缩振动)、C—H(烷烃)、COO—(不对称)、COO—(对称)、C—C(弯曲振动)[16]。负载Fe3O4粒子前后水凝胶在1 594、1 411 cm-1处的吸收峰表明交联后水凝胶中存在羰基[17]。在MHG中存在1 594、1 411 cm-1两处峰,说明CMC中的羧基未参与交联反应。从FTIR谱图中可以看出2 927 cm-1处的峰为CH2的反对称伸缩振动吸收峰,而在负载Fe3O4粒子前后水凝胶的FTIR谱图中出现了峰的分裂,产生了两个较小的峰。其原因是利用ECH交联后引入新的CH2基团,从而使得该处的峰出现分裂。相比原料CMC和β-CD,负载Fe3O4粒子前后水凝胶的FTIR谱图在1 026 cm-1的吸收峰变宽,表明交联反应过程中产生新的醚键,同时也说明环氧氯丙烷成功开环并进入体系中[18]。MHG在590 cm-1处出现一个新峰,代表Fe3O4中Fe—O的弯曲振动,这表明Fe3O4粒子成功负载到水凝胶结构中。
2.2 MHG的表面形貌
由图2可见,凝胶具有多孔结构,凝胶MHG的表面及内部分布有大量的孔道,且呈现出多孔的网状结构,这使得凝胶的比表面积增大,有利于吸附,为其对Cu2+具有较大的吸附容量提供佐证[19]。水凝胶负载Fe3O4粒子后,对比图2a所示水凝胶扫描电镜(SEM)图,根据图2b可知,水凝胶网络结构中布满了Fe3O4颗粒,表明Fe3O4颗粒已成功负载到水凝胶网络结构中。由图2b和图2c可见,MHG表面有部分褶皱,可能是由于MHG制取样品时,微球没有完全溶胀,空间三维网络结构没有全部打开,进而影响到微球表面形貌。如图2d所示,大量的Fe3O4粒子被包埋在水凝胶结构中,且分布较为均匀,磁性Fe3O4颗粒与颗粒之间通过丝状物交联在一起形成网状交联结构[20]。
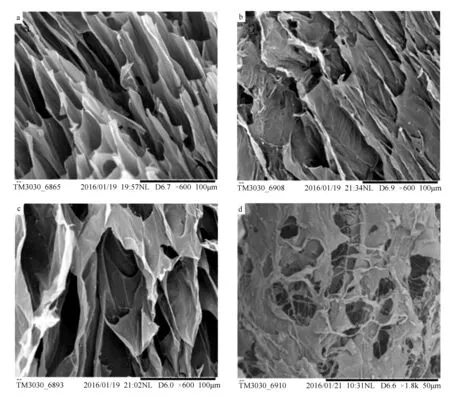
a.未负载Fe3O4的水凝胶SEM图(×600);b.Fe3O4在MHG中的分布情况(×600);c.MHG的褶皱结构(×600);d.MHG的局部微观形貌(×1800)。
图2 水凝胶和MHG的SEM图
2.3 MHG的溶胀性能
图3为负载Fe3O4粒子前的水凝胶与负载Fe3O4粒子后的MHG在去离子水中的溶胀率变化曲线。可以看出MHG在开始一段时间内溶胀很快,然后MHG溶胀逐渐变得缓慢,直至平衡状态。MHG溶胀过程大致分为两个阶段,开始是溶剂分子向磁性凝胶网络结构扩散,溶剂化作用引起凝胶高分子链段松弛从而使得分子链段向空间中伸展;然后分子网络结构受到一定的应力进而产生一定的弹性收缩引起分子网络收缩。当这两种相反倾向趋势互相抗衡时,MHG的溶胀到达平衡[21]。在MHG溶胀约12 h后溶胀率略有下降,在溶胀约14 h后达到平衡状态,这一现象可能是MHG到达过饱和状态后释放少量溶剂造成的。通过对比水凝胶和MHG的溶胀率变化曲线,可以发现MHG的溶胀率比水凝胶的溶胀率略大。这可能是由于Fe3O4粒子的存在使得水凝胶的交联程度减小,而水凝胶的溶胀程度与其交联程度有关,交联点数量越少,溶胀程度也就越大[22]。
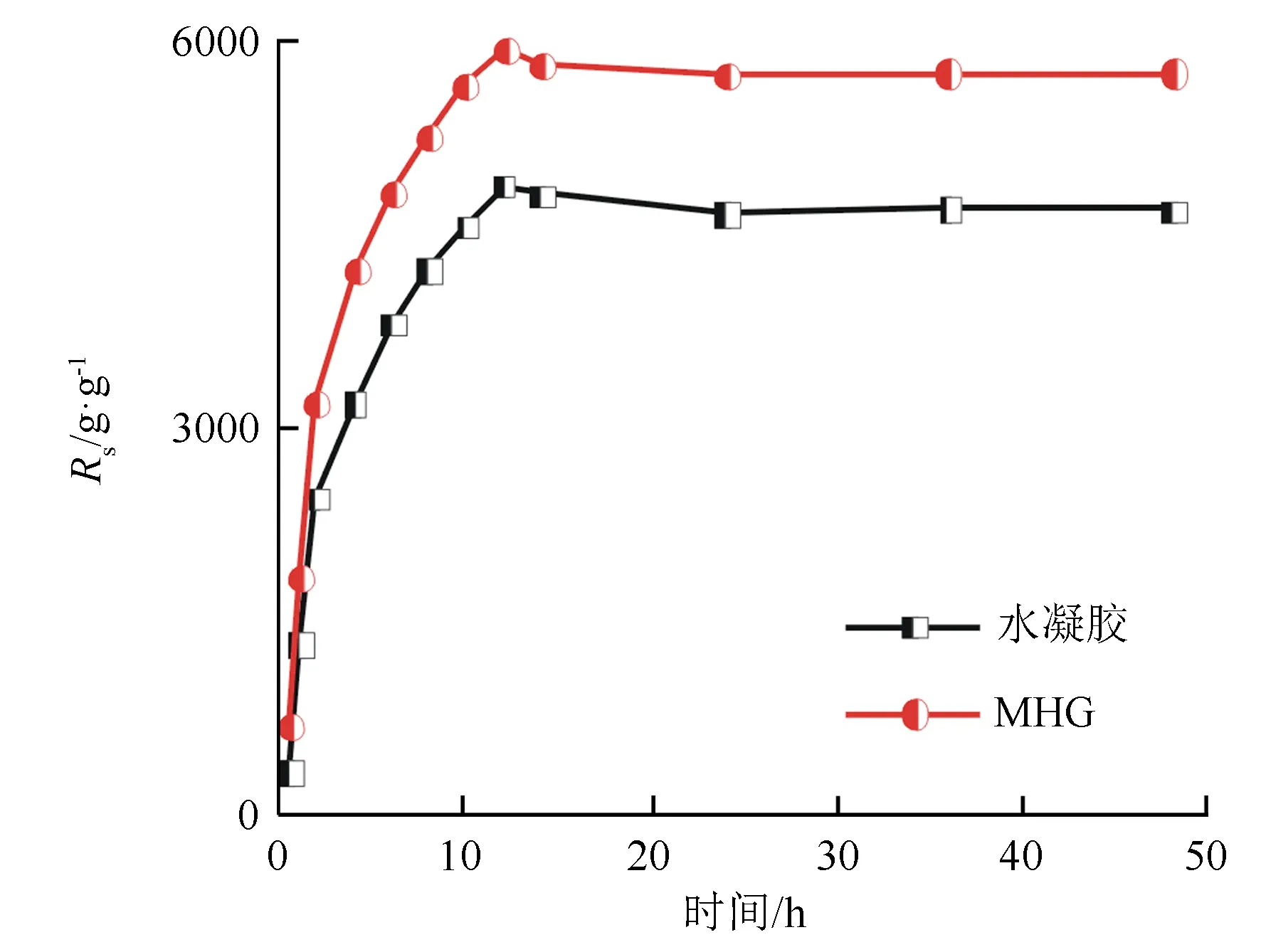
图3 水凝胶和MHG的溶胀率变化曲线
2.4 MHG对金属铜离子的吸附性能
2.4.1 温度对MHG吸附效果的影响
温度是影响MHG吸附过程的重要因素之一。本研究探讨了温度对MHG吸附Cu2+效果的影响,以确定MHG对Cu2+的吸附为放热反应还是吸热反应。表1为MHG在不同温度(20、25、30、35、40 ℃)条件下对Cu2+的吸附效果。可知,在20~30 ℃范围内,MHG对Cu2+的吸附量随温度的升高而缓慢增加,而温度在30~40 ℃范围内,吸附量随温度升高变化不大。由此可以推测MHG对Cu2+的吸附过程在前期属于吸热反应,而在后期MHG的吸附不受温度影响[16]。

表1 温度对MHG吸附Cu2+的影响
2.4.2 MHG对Cu2+的吸附动力学
为研究MHG对Cu2+的吸附速率,在293 K温度下,对其进行了吸附动力学实验。在Cu2+溶液的初始质量浓度为50、100 mg/L的条件下,MHG对Cu2+的吸附效果如图4所示。可以看出,在吸附初期(0~30 min),MHG对Cu2+的吸附量增加迅速;而在之后的20 min内,其吸附量增加缓慢直至达到吸附平衡。在50 min内MHG对重金属离子的吸附达到平衡,此时,MHG对Cu2+的吸附量分别为237.9、465.9 mg/g。MHG对Cu2+的吸附主要分为两个过程:①扩散过程;②Cu2+与MHG吸附位点的结合过程。实验结果表明,在前20 min内MHG对Cu2+的吸附主要是外部扩散的过程,此时MHG的吸附位点较多,吸附速率较快;此后随着吸附的进行,MHG的吸附位点已经基本结合完,吸附速率逐渐降低。

图4 MHG对不同初始浓度Cu2+溶液的吸附效果
吸附动力学模型不仅可以估计MHG的吸附效率,还可以从动力学的角度深层次地来表达吸附机理。对Cu2+吸附动力学的结果,用准一级动力学方程和准二级动力学方程进行拟合。准一级动力学方程和准二级动力学方程的表达式[23]分别如下:
(3)
(4)
式中:Qe和Qt分别表示吸附达到平衡和t时的吸附量(mg/g);K1表示准一级吸附速率常数(min-1);K2表示准二级吸附速率常数(min-1);t表示吸附时间(min)。
图5和表2所示的是MHG对Cu2+吸附动力学进行准一级动力学和准二级动力学拟合的结果。可以看出MHG对Cu2+吸附的准二级动力学模型的线性相关系数(R2>0.999)优于准一级动力学模型。由准二级动力学拟合得到的MHG对Cu2+的吸附量(Qe,c)与实验值(Qe,e)较为接近。因此,可以判断MHG对Cu2+吸附动力学过程为准二级动力学模型[24]。
2.4.3 负载Fe3O4粒子前后水凝胶的吸附能力对比
负载Fe3O4粒子前水凝胶对Cu2+的吸附量为375.8 mg·g-1,负载Fe3O4粒子后MHG对Cu2+的吸附量提高至465.9 mg·g-1。负载Fe3O4粒子后MHG对Cu2+的吸附量提高的原因可能是由于MHG三维网络结构中Fe3O4微粒的小尺寸效应导致的,使得MHG内部的比表面积增大,从而使其表面活性增强,致使MHG的对Cu2+的吸附量增加。表3列举了不同吸附剂对Cu2+的吸附量,可知MHG对Cu2+的吸附效果非常好,可用于水环境中Cu2+的去除[25-28]。

图5 MHG对不同初始浓度Cu2+溶液的吸附动力学方程拟合结果
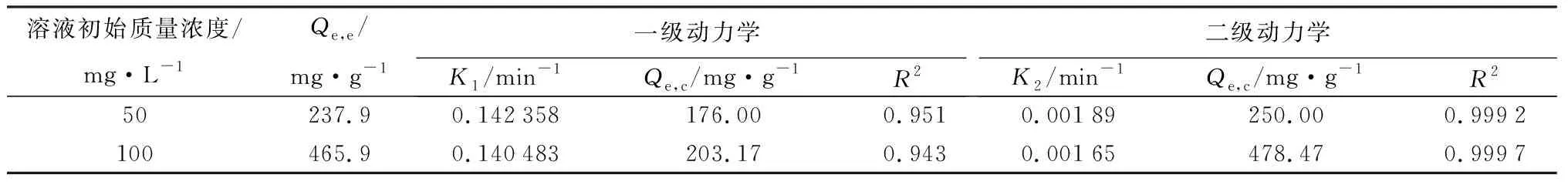
溶液初始质量浓度/mg·L-1Qe,e/mg·g-1一级动力学K1/min-1Qe,c/mg·g-1R2二级动力学K2/min-1Qe,c/mg·g-1R250237.90.142358176.000.9510.00189250.000.9992100465.90.140483203.170.9430.00165478.470.9997

表3 不同吸附剂对Cu2+的吸附量对比
3 结论
通过接枝共聚的方法制备了高吸附性能的磁性羧甲基纤维素基水凝胶(MHG),并对其进行了物化结构表征以及对水环境中金属Cu2+的吸附性能研究。SEM分析说明了Fe3O4粒子成功负载到了水凝胶的三维网络结构中,同时可以看出MHG具有较大的孔径和比表面积,这更有利于吸附的进行。FTIR分析证明β-环糊精和羧甲基纤维素发生了交联反应,同时Fe3O4粒子成功地加入到了MHG中。另外,通过对比负载Fe3O4粒子前后产物的溶胀率变化曲线可知,MHG的溶胀率均大于负载Fe3O4粒子前水凝胶的溶胀率。MHG对Cu2+的最高吸附量可达465.9 mg·g-1,效果优于很多已报道的吸附剂。MHG对Cu2+的吸附过程前期为吸热反应,而吸附过程后期不受温度影响。吸附动力学研究表明,该吸附动力学过程符合准二级动力学吸附模型。
