猪骨膜去细胞支架的制备及其生物相容性
2020-05-11陈启旺孙郁文李跃红
陈启旺,孙郁文,魏 珂,张 浩,李跃红
骨膜具有较强的成骨能力,在骨折愈合修复方面扮演着重要角色,被认为是促进骨移植材料在移植区域发挥修复作用的始动因素。国内外有较多关于临床上骨膜移植治愈骨缺损、骨不愈合的报道,然而骨膜移植存在供体不足、供区结构功能损害及免疫排斥反应等问题。近年来,组织工程技术取得了长足的进步。有学者采用脱细胞技术制备了去细胞骨膜[1],并证实这种生物材料体内相容性较好。本研究探索基于猪骨膜去细胞支架的制备及检测,观察骨膜去细胞支架与细胞共培养的情况,旨在为建立载药微球—复合支架及支架性能的研究及联合体内移植奠定基础。
1 材料与方法
1.1 材料
1.1.1主要仪器 高压灭菌锅(STIK);恒温水浴锅(易晨仪器);台式恒温震荡仪(苏州培英实验设备有限公司);超纯水制备系统(Millipore);电子天平(Sartorius);光学显微镜(凤凰光学仪器有限公司);荧光显微镜(OLYMPUS);扫描电子显微镜(ZEISS);紫外分光光度计(Shimadzu);酶标仪(Molecular Devices); Heraeus Labofuge 400R低温超高速离心机(Heraeus);Eppendorf Centrifuge 5810R型低温冷冻离心机、移液枪(Eppendorf);CO2恒温培养箱(Thermo)。
1.1.2实验试剂 Triton-X 100、十二烷基硫酸钠(SDS)、青/链霉素、苯甲基黄酰氟(PMSF)、DNA酶、RNA酶、Tris-HCl(pH=8.0)、哺乳动物基因组DNA抽提试剂盒、MTT、胎牛血清(FBS)、胰酶细胞消化液(上海碧云天生物有限公司);羟脯氨酸试剂盒(南京凯基生物科技发展有限公司);DMEM培养基(Sigma-Aldrich);过氧乙酸(山东瑞泰奇洗涤消毒科技有限公司);其他均为常规分析纯试剂。
1.1.3实验细胞 HFLS滑膜成纤维细胞(苏州北纳创联生物技术有限公司)在37 ℃、 5% CO2的CM1-1培养液(由90% DMEM-H+10% FBS 配制而成)条件下贴壁生长。细胞中间凸起,两端细长。
1.1.4实验材料 猪骨膜取自新鲜带肉猪扇骨,购于联华超市,生产企业为浙江华腾食品有限公司,屠宰企业为桐乡市崇福食品有限公司屠宰加工厂。
1.2 骨膜去细胞支架的制备
1.2.1猪扇骨骨膜的剥离 取新鲜的带肉猪扇骨,使用洁净的钝性牙科刀剔除猪扇骨的筋膜及结缔等组织。使用无菌手术刀及镊子仔细缓慢剥离骨膜组织,尽量保持骨膜组织的完整,分离过程中不断用棉签沾取适量PBS溶液湿润剥离区域。将剥离下的骨膜组织放入含有PBS溶液的培养皿中,用PBS溶液多次冲洗剥离下的骨膜组织,以去除骨膜上残留的杂质。
1.2.2骨膜去细胞支架的制备 将清洗后的骨膜组织置入PBS溶液,放入-80 ℃冰箱内物理冻融24~48 h,促进组织疏松降解。取出骨膜组织于室温下解冻;用无菌PBS溶液反复清洗3次,每次3~5 min。再将骨膜组织浸泡在2% Triton-X 100和浓度为3.5×10-5mol/L PMSF脱细胞高渗透溶液中,置37 ℃ 恒温箱以100 r/min震荡12 h。倒掉脱细胞高渗透溶液,PBS溶液反复清洗后加入1% SDS溶液,置37 ℃恒温箱震荡2 h。再将骨膜组织浸泡在混合消化酶液(含0.05 U/L DNA酶和0.1 g/L RNA酶)中水浴6 h(37 ℃),以进一步消化细胞外基质中残留的核酸成分。用PBS溶液清洗骨膜组织并置于0.1%过氧乙酸溶液中浸泡消毒。再将该骨膜标本浸泡在含0.1 U/L双抗的PBS溶液中预防细菌污染。4 ℃保存,备用。
1.3 骨膜去细胞支架的鉴定
1.3.1扫描电镜观察 正常骨膜和经去细胞处理的骨膜支架用3%的戊二醛固定24 h,用PBS溶液浸泡10 min,重复3次。经乙醇梯度脱水,机械干燥后,送至浙江大学光电学院大型仪器有偿服务平台,真空镀金后扫描观察。
1.3.2DNA定性分析 HE染色:正常骨膜和去细胞骨膜经4%多聚甲醛固定后,送样至浙江大学医学院公共技术平台进行HE染色,于光学显微镜下观察摄片。DNA提取法:① 根据哺乳动物DNA提取试剂盒说明书,选取3组正常骨膜和6组去细胞骨膜进行DNA提取实验。② 在液氮环境下研磨骨膜组织至粉末状。③ 用电子天平称取骨膜粉末,加入裂解液,涡旋混匀,50 ℃水浴过夜。④ 加入Tris水饱和酚,待溶液分层,丢弃下层酚相及中间相,重复操作1次。⑤ 加入氯仿分层后吸取上清液,加入醋酸铵和无水乙醇,上下轻柔颠倒混匀,观察是否出现DNA絮状沉淀。
1.3.3胶原定性和定量检测 胶原定性检测(Masson染色):正常骨膜和去细胞骨膜由4%多聚甲醛溶液固定,送样至浙江大学医学院公共技术平台进行Masson染色,于光学显微镜下观察摄片。胶原定量检测(羟脯氨酸测量法): ① 根据羟脯氨酸试剂盒说明书,用电子天平称取正常骨膜组织和去细胞骨膜组织。② 加入裂解液,于95 ℃水浴锅中分解。③ 加入指示剂和pH调整液。④ 稀释水解液,加入活性炭,3 500 r/min离心15 min,过程重复3次。⑤ 吸取上清液检测吸光度,计算羟脯氨酸的含量,求出正常骨膜以及去细胞骨膜组织中胶原的含量。
1.4 滑膜成纤维细胞与骨膜去细胞支架共培养
1.4.1HFLS滑膜成纤维细胞的培养 选择含10% FBS的DMEM培养液培养原代HFLS滑膜成纤维细胞,隔2 d进行细胞换液,待HFLS滑膜成纤维细胞贴壁,细胞密度长至80%~90%后传代。细胞和骨膜去细胞支架共培养实验中使用第3代传代细胞。
1.4.2细胞和支架共培养观察 常规操作培养细胞,待第3代HFLS滑膜成纤维细胞长满后加入胰蛋白酶消化,用DMEM培养基(含10% FBS)制备细胞悬液,细胞计数,调整浓度为5×104~10×104/ml。取3块96孔细胞板,每块96孔板均设立4组,即无菌PBS空白对照组(无细胞,无培养基,加MTT和DMSO)、培养基对照组(无细胞,加培养基,加MTT和DMSO)、细胞实验组(细胞,培养基,MTT和DMSO)以及细胞和骨膜去细胞支架共培养实验组(细胞,骨膜去细胞支架,培养基,MTT和DMSO),每组5个复孔。96孔板边缘孔用无菌PBS填充。细胞实验组、细胞和骨膜去细胞支架共培养实验组每孔加入100 μl细胞悬液,每滴加3个孔,就重新吹打离心管中的细胞悬液,确保每孔接种的细胞密度相同。将这3块96孔板分别置于5% CO237 ℃恒温箱培养24 h和48 h。
1.4.3MTT检测 采用培养至第3代的HFLS滑膜成纤维细胞和骨膜去细胞支架共培养以检测骨膜去细胞支架的生物相容性。加入MTT检测前吸除DMEM完全培养基,加入不含血清的DMEM基础培养基,避免血清对实验结果的干扰。检测时每孔加入20 μl 5 g/L MTT溶液,再将96孔板放回5% CO237 ℃恒温箱继续培养4 h。 4 h后终止培养,取出96孔板,小心吸去孔内培养液,每孔加入150 μl二甲基亚砜(DMSO),酶标仪低速震荡,使结晶充分溶解。OD490 nm处检测各孔的吸光度。检测细胞活性的时间点分别设定为24 h和48 h。由于MTT会和活细胞反应生成蓝紫色结晶甲瓒,则吸光度值越高,表明活细胞数量越多。
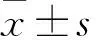
2 结果
2.1 骨膜去细胞支架鉴定评价
2.1.1扫描电镜观察 见图1。猪骨膜组织经去细胞处理后,组织表面的连续性并未中断,并存在大小不等的孔隙。电镜结果表明,去细胞操作对细胞外基质成分以及骨膜结构的完整性无明显破坏效应。

图1 去细胞骨膜扫描电镜观察 ×1 000 组织表面的连续性未中断(箭头所示),存在大小不等的孔隙(圆圈所示)
2.1.2HE染色和DNA抽提检测 正常骨膜组织具有双层结构(疏松的形成层和致密的纤维层),细胞核内的染色质以及胞质的核酸经HE染色后表现为蓝紫色(见图2A)。骨膜去细胞支架中未见明显蓝紫色的成分(见图2B),表明DNA成分去除干净。利用DNA提取试剂盒抽提正常骨膜和骨膜去细胞支架的DNA,轻柔颠倒EP管后,可观察到正常骨膜组织中产生DNA絮状沉淀。而骨膜去细胞支架组织澄清,未见明显沉淀现象。说明经去细胞操作后,骨膜支架中无残留DNA成分,细胞去除彻底。
2.1.3胶原含量的定性(Masson染色)与定量(羟脯氨酸试剂)检测 正常骨膜组织大量胶原纤维排列紧密(见图3A),骨膜去细胞支架胶原纤维交错连接,纤维的连续性良好,分布排列与处理前正常骨膜组织相似(见图3B)。提示去细胞操作并没有破坏细胞外基质中的胶原成分。进一步检测正常骨膜组织以及骨膜去细胞支架组织的羟脯氨酸含量。正常骨膜组织胶原含量为(5.55~7.85)×10-3/g,骨膜去细胞支架组织胶原含量为(6.26~9.86)×10-3/g。两者胶原含量比较差异无统计学意义(P>0.05)。
图2 两种骨膜HE染色结果比较 ×20 A.正常骨膜组织;B.骨膜去细胞支架组织 图3 两种骨膜Masson染色结果比较 ×20 A.正常骨膜组织;B.骨膜去细胞支架组织
2.2 骨膜和细胞共培养结果利用培养基对照组吸光度数值调零,计算得到各吸光度值如下:24 h细胞实验组吸光度值为0.735~1.832(1.284±0.549),细胞和骨膜去细胞支架共培养实验组吸光度值为1.106~1.839(1.473±0.366);两组比较差异无统计学意义(P>0.05)。48 h细胞实验组吸光度值为1.417~1.598(1.508±0.090),细胞和骨膜去细胞支架共培养实验组吸光度值为1.043~1.668(1.356±0.313);两组比较差异无统计学意义(P>0.05)。细胞实验组、细胞和骨膜去细胞支架共培养实验组24 h与48 h组内比较差异均无统计学意义(P>0.05)。
3 讨论
骨膜去细胞支架在制备过程中去除细胞的同时要能够保证支架的完整性,由于制备过程复杂、参数众多,不同学者采用不同的骨膜供体,探究了不同的优化方法[2-3]。本实验中,我们采用猪扇骨处骨膜,获得骨膜去细胞支架。在制备方法上,增加了Triton-X 100孵育时间(24 h),减少了SDS孵育时间(2 h),并且适度调整了RNA/DNA酶的浓度与裂解时间。本研究通过扫描电镜观察、HE染色、Masson染色、DNA和胶原含量测定等一系列实验进行鉴定,结果表明,获得的骨膜去细胞支架保持了连续的细胞外基质且达到去除DNA但保留胶原蛋白的要求。
本研究骨膜去细胞支架与成纤维细胞的体外培养证明了其具有良好的生物相容性,24 h细胞和骨膜去细胞支架共培养实验组吸光度高于细胞实验组,说明骨膜本身没有毒性,对共培养的细胞没有杀伤作用。48 h 吸光度两实验组之间没有差别,进一步说明骨膜本身没有毒性。从单个组来看,细胞实验组48 h吸光度比24 h略高,但差异无统计学意义(P>0.05)。细胞和骨膜去细胞支架共培养实验组48 h吸光度略低于24 h,但同样差异无统计学意义(P>0.05)。说明制备的骨膜暂不适于细胞的快速生长繁殖,制备条件仍需要进一步完善。
具有良好生物相容性的骨膜去细胞支架的成功制备可以作为组织工程的支架材料,为种子细胞黏附、增殖、长入和分化提供良好的三维空间支持[4],也可为复合生长因子发挥生物效应提供平台。
