一株刺梨葡萄汁有孢汉逊酵母的鉴定及酿酒特性分析
2020-05-11刘晓柱赵湖冰李银凤于志海刘晓辉黄名正
刘晓柱,赵湖冰,李银凤,于志海,刘晓辉,黄名正
(贵州理工学院,贵州 贵阳, 550003)
果酒的自然发酵是一个多菌种共同作用的复杂过程[1]。酵母菌在该过程中发挥着至关重要的作用,根据其发酵性能的差异,可将酵母菌分为酿酒酵母(Saccharomycescerevisiae)和非酿酒酵母(non-Saccharomycesyeast)两大类[2]。酿酒酵母发酵活性强,酒精代谢旺盛,主要进行酒精发酵[3]。非酿酒酵母可合成多种酶,如蛋白酶、果胶酶、糖苷酶、纤维素酶等,并作用于果汁中相关底物,促进风味物质的释放,在很大程度上影响果酒的色泽、风味以及复杂度[4]。常见的非酿酒酵母有假丝酵母属 (Candida)[5]、毕赤酵母属 (Pichia)[6]、有孢汉逊酵母属(Hanseniaspora)[7]、克鲁维酵母属 (Kluyveromyces)[8]、梅奇酵母属 (Metschnikowia)[9]等。因此,将在非酿酒酵母与酿酒酵母进行混菌发酵果酒,有利于改善果酒品质,增加果酒风味物质的复杂性。CLEMENTE-JIMENEZ等的研究结果发现,在美极梅奇酵母 (Metschnikowiapulcherrima)与酿酒酵母共培养时,二者具有协同作用,有助于包括脂肪酸、酯和萜烯醇等多种芳香化合物的产生[10]。ANFANG将酿酒酵母和克鲁维毕赤酵母(Pichiakluyveri)进行混合发酵时发现,二者按照1∶9的比例接种时,提高了长相思酿造葡萄酒中3-巯基己基乙酸盐的浓度[11]。此外,某些季也蒙毕赤酵母(Pichiaguillermondii) 菌株具有羟基肉桂酸脱羧酶活性较强,可促进乙烯基苯酚类吡喃花青素的合成,有助于葡萄酒颜色稳定性的保持[12]。尽管近年来,国内在非酿酒酵母领域研究发展较为迅速,但目前对非酿酒酵母研究主要集中在葡萄酒领域,在其他果酒酿造中的了解还十分有限。
刺梨(Rosaroxburghii),蔷薇科、蔷薇属植物,广泛分布于我国西南地区,其果实营养价值具有丰富的应用价值和药用价值[13]。贵州省将刺梨作为本省重点发展的特色产业之一,近年来发展迅速,2018年全省种植面积达1 465 km2,生产总值达31.61亿元。此外,贵州龙里刺梨还成为国家地理标志产品,受到国家层次的保护。但刺梨鲜果生食口感不佳,将其发酵生产为刺梨果酒是一种比较好的选择,既保持了刺梨中丰富的营养成分,又带动了产业发展[14]。但目前对刺梨果酒酿造酵母方面的研究还比较少,缺乏优质刺梨发酵果酒专用酵母。生产上多采用葡萄酒酿酒酵母进行发酵刺梨果酒。该类酵母发酵性能较好,但产香能力不足[15]。因此,本研究采用传统的微生物分离技术,并结合嗅闻法,从贵州刺梨上选育出1株产香浓郁的非酿酒酵母,分析了其生理特性,将其与商业化酿酒酵母进行混菌发酵,探讨其对刺梨果酒风味的影响。
1 材料与方法
1.1 材料与试剂
新鲜贵农5号刺梨,采自贵州省黔南布依族苗族自治州龙里县;YPD、WL培养基、赖氨酸固体培养基,贵州博奥瑞杰生物科技有限公司;对硝基苯基-β-D吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG),中国上海源叶生物公司;ZYMAFLORE X16(简称X16)酿酒酵母,法国LAFFORT公司;其余试剂均为国产分析纯,贵州博奥瑞杰生物科技有限公司。
1.2 仪器与设备
UH5300紫外分光光度计,日本日立公司; 雷磁PHSJ-3F pH仪,上海仪电科学仪器股份有限公司,CKX41倒置显微镜,日本OLYMPUS公司;SZM体视显微镜,中国宁波舜禹仪器有限公司;SA402B电子舌味觉系统,日本INSENT公司;Bio-rad T100TMPCR仪,美国伯乐公司;TQ8040NX气相质谱联用仪,日本岛津仪器有限公司。
1.3 实验方法
1.3.1 菌株分离与鉴定
称取100 g新鲜成熟刺梨捣碎,放入250 mL无菌锥形瓶中,密封28 ℃进行自然发酵。分别于发酵第1、 3、 5天取样,梯度稀释法涂布于YPD固体平板上,28 ℃,培养48 h。然后继续挑取每个平板上的单克隆,划线于YPD固体平板上,直至为纯的单克隆为止。
挑取YPD固体平板上纯的单克隆菌株,草酸铵结晶紫简单染色,然后置于显微镜观察细胞形态和生殖方式观察。挑取YPD固体平板上单克隆菌株划线于赖氨酸培养基上,28 ℃培养3 d,观察其生长情况。选YPD固体平板上纯的单克隆菌株划线于WL固体培养基上28 ℃,培养5 d,观察菌落颜色和形态。
PCR法扩增菌体26S rDNA D1/D2区域,PCR反应体系为2×Taq PCR Master Mix 25 μL,10 μmol/L NL1引物和NL4引物各2 μL,菌液2 μL,补水至反应总体积25 μL。反应结束后取5 μL PCR产物琼脂糖凝胶电泳检测。PCR产物送生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI上进行BLAST同源序列搜索比对。
1.3.2 菌株生长曲线
F119菌株以106CFU/mL接种于YPD液体培养基,28 ℃、180 r/min条件下培养,每隔4 h取样,以YPD液体培养基作为空白对照,在600 nm处测定菌悬液OD值,平行重复3次,共取样40 h。根据时间和OD600 nm值绘制生长曲线。
1.3.3 菌株耐受性测定
糖耐受性:将菌株F119以106CFU/mL浓度接种于葡萄糖质量浓度分别为100、150、200、250、300 g/L的YPD液体培养基中,28 ℃、180 r/min条件下培养34 h,在600 nm处测定菌悬液OD值,平行重复3次。
酒精耐受性:将菌株F119以106CFU/mL接种于酒精体积分数分别为3%、6%、9%、12%、15%的YPD液体培养基, 28 ℃、180 r/min条件下培养34 h,在600 nm处测定菌悬液OD值,平行重复3次。
SO2耐受性:将菌株F119以106CFU/mL接种于SO2质量浓度分别为50、 100、 150、 200、 300 mg/L的YPD液体培养基中。28 ℃、180 r/min条件下培养34 h,在600 nm波长处测定菌悬液OD值,平行重复3次。
酸耐性[16]:将菌株F119以106CFU/mL接种于含柠檬酸酸度分别为1.5%、2.0%、2.5%、3.0%的YPD液体培养基,28 ℃、180 r/min条件下培养34 h,在600 nm处测定菌悬液OD值,平行重复3次。
1.3.4 硫化氢产生能力
取10 μL 106CFU/mL的F119菌液滴加在亚硫酸铋培养基表面上的滤纸片,待液体完全吸收后,28 ℃倒置培养5 d,观察滤纸片变色情况。菌株产硫化氢能力由高到低,显色情况分别为显棕黑色、棕色、墨绿色、淡墨绿色及不显色。
1.3.5 产β-葡萄糖苷酶能力
参考侯晓瑞等研究方法采用p-NPG法分析菌株产β-葡萄糖苷酶能力[17]。F119菌株以106CFU/mL接种于YPD培养基中,28 ℃,200 r/min培养72 h,取1 mL发酵液于离心管中,4 ℃、8 000 r/min离心10 min,取上清液作为粗酶液。取0.1 mL粗酶液与0.2 mL 35 mmol/Lp-NPG混匀,40 ℃保温30 min,加入2 mL 1 mol/L Na2CO3终止反应,于400 nm波长处测定吸光度。酶活力单位(U)定义为pH 5.0、50 ℃条件下,1 min水解p-NPG 产生1 μmol 对硝基苯酚(p-nitrophenol,p-NP)所需酶量。
1.3.6 刺梨果酒理化指标检测
将菌株F119和酿酒酵母X16种子液以1∶1混合接种于刺梨汁中,菌株终浓度为108CFU/mL, X16单独发酵作为对照,每个样本3个平行重复。25 ℃恒温静置培养,直至发酵结束。发酵结束后, 4 ℃、3 000 r/min离心5 min去残渣,上清液用于后续分析。
采用蒽酮法测定刺梨果酒中总糖含量。乙酸乙酯配置15 mg/mL蒽酮溶液,0.2 mg/mL葡萄糖标准液。分别取葡萄糖标准液0、0.2、0.4、0.6、0.8、1.0 mL于试管中,稀释至2 mL,蒽酮试剂0.5 mL,冷水浴中加入浓H2SO45 mL,摇匀。迅速放入水浴锅中,80 ℃下水浴15 min,取出后流动水冷却至室温,在620 nm处测定其吸光度。以糖含量为横坐标,吸光度为纵坐标,绘制标准曲线。采用GB/15038—2006 葡萄酒、果酒通用分析方法测定刺梨果酒糖含量,测定值带入标准曲线换算为样品中葡萄糖值,并对混合发酵刺梨果酒酒精度,总酸和挥发酸进行测定。
1.3.7 刺梨果酒感官特性测定
取发酵刺梨果酒样品80 mL,倒入电子舌专用烧杯中。根据仪器说明书步骤进行检测。试验采用清洗溶液和刺梨果酒样本交替检测序列进行,清洗溶液为专用电极清洗液。采样时间120 s,采样速度为1次/s,每个样品平行测定3次。
1.3.8 刺梨果酒挥发性香气特性测定
参考陈思奇等[18]、蒋宝等[19]方法分析刺梨果酒香气特性,取8 mL刺梨果酒,加入2.0 g NaCl,40 ℃水浴萃取刺梨果酒中挥发性香气物质。GC-MS分析条件为PEG.20 m弹性石英毛细管柱(30 m×250 μm×0.25 μm),氦气流量1 mL/min。进样口温度50 ℃,出样口温度235 ℃。离子源温度230 ℃;四极杆温度为150 ℃,调谐EMV 947V,质量扫描范围为30.00~500.00 amu。NIST 14.L标准谱库检索并匹配GC-MS采集得到的数据,进行定性分析。采用峰面积归一化法进行物质的定量分析。
1.4 数据分析
数据结果以平均值±标准差表示,采用SPSS 21.0进行数据单因素方差分析(ANOVA)检验差异显著性,P<0.05为差异有统计学意义。
2 结果与分析
2.1 非酿酒酵母的筛选与鉴定
赖氨酸培养基鉴定结果表明,刺梨自然发酵液中共分离得到80株非酿酒酵母菌。采用嗅闻法筛选出1株果香和酒香味较浓的酵母菌株,命名为F119。F119菌种在WL培养基上,菌落深绿色、边缘平整、光滑湿润(图1-A);在YPD培养基上菌落黄白色、有光泽、边缘整齐、凸起、表面湿润(图1-B);菌株显微形态为柠檬状,出芽繁殖。结合菌落形态特点与细胞形态特征,初步认为F119为1株刺梨来源的汉逊酵母属菌株(Hanseniasporasp.)。

A-F119在WL培养基菌落形态;B-F119在YPD培养基菌落形态;C-F119的细胞形态(100×,bar=100 μm)图1 刺梨葡萄汁有孢汉逊酵母F119菌落与细胞形态Fig.1 Cellular and colonial morphologies of the F119 strain
PCR方法对F119 菌株26S rDNA D1/D2区域进行扩增,在约600 bp处扩增到1条特异性条带(图2)。扩增产物经测序和BLAST比对,发现与葡萄汁有孢汉逊酵母(Hanseniasporauvarum)同源性高达99.66%。因此,F119为1株来源于刺梨的葡萄汁有孢汉逊酵母。
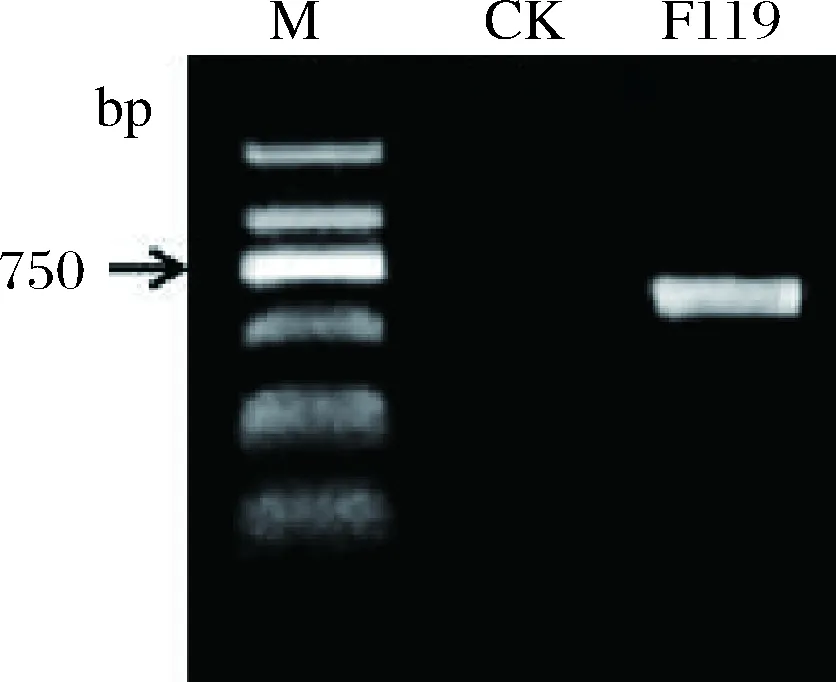
图2 F119菌株26S rDNA D1/D2区域PCR扩增结果Fig.2 Amplification of 26S rDNA D1/D2 domain of F119 strain
2.2 非酿酒酵母F119生长曲线
非酿酒酵母菌株F119生长曲线如图3所示,基本上包括了延滞期、对数生长期、减速期和稳定期。其中前4 h 为延滞期,4~12 h为对数生长期,12~24 h为减速期,24 h后基本上达到稳定期。在减速期F119生长速率小于商业化的酿酒酵母X16,且减速期时间比X16长;在稳定期F119菌体浓度要低于X16。

图3 非酿酒酵母F119生长曲线Fig.3 Growth curve of non-Saccharomyces yeast F119 strain
2.3 非酿酒酵母F119生理特性分析
菌株F119葡萄糖耐受性结果如图4-A所示,F119可耐受0~300 g/L葡萄糖浓度,在此均可生长。从葡萄糖质量浓度250 g/L开始,菌体浓度略微降低。但0~300 g/L葡萄糖质量浓度范围内,F119菌体浓度均低于商业化酿酒酵母X16。
菌株F119柠檬酸耐受性结果如图4-B所示,菌株F119在酸度1%~3%均可生长,不受影响,且与商业化酿酒酵母X16之间无显著差异,表明非酿酒酵母F119菌株具有较强的柠檬酸耐受性。
菌株F119乙醇耐受性如图4-C所示,F119菌体浓度随着乙醇体积分数的增大而逐渐降低,在乙醇体积分数6%时生长显著受到抑制。在各乙醇体积分数处理下,F119菌株浓度均低于商业化酿酒酵母X16。
菌株F119 SO2耐受性结果如图4-D所示,F119菌株在SO2质量浓度0~300 mg/L均可生长,变化较小,与商业化酿酒酵母X16之间无显著区别,暗示F119可耐受300 mg/L SO2。
2.4 硫化氢产生能力
在酒类酿造中,菌体自溶分解可产生硫化氢。硫化氢具有臭鸡蛋味,对酒体风味具有不良影响。硫化氢产生能力一般是由菌体本身遗传背景决定的。菌株F119硫化氢产生能力如图5-A所示,滤纸片无色,表明F119不产生硫化氢。而对照组X16滤纸片为棕色,说明具有较强的硫化氢产生能力(图5-B)。因此,菌株F119产硫化氢产生能力要低于X16。
2.5 β-葡萄糖苷酶产生能力
以对硝基苯酚浓度为横坐标,400 nm下的吸光值为纵坐标,绘制标准曲线,其回归方程为:y=0.130 2x+0.022 6,R2=0.999 5,吸光值与对硝基苯酚浓度之间具有较好的线性关系。p-NPG测定结果发现,F119分泌β-葡萄糖苷酶能力较低,为(13.98±0.21)mU/mL(表1)。而对照组,商业酿酒酵母X16产β-葡萄糖苷酶量为(25.41±0.06)mU/mL,为F119产酶量的1.8倍。
2.6 非酿酒酵母F119对刺梨果酒品质的影响
2.6.1 对刺梨果酒常规理化指标的影响
以商业化酿酒酵母X16纯种发酵为对照,将非酿酒酵母F119与X16进行混合发酵刺梨果酒。刺梨果酒基本理化指标如表2所示,F119混合发酵刺梨果酒的pH值、乙醇体积分数、挥发酸与X16纯种发酵刺梨果酒相比,无显著区别;F119混合发酵刺梨果酒的总糖、总酸低于X16纯种发酵刺梨果酒。
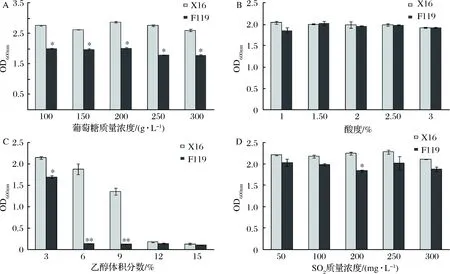
A-葡萄糖质量浓度;B-酸度;C-乙醇体积分数;D-SO2质量浓度图4 非酿酒酵母F119生理耐受性Fig.4 Physiological tolerance of non-Saccharomyces yeast F119 strain注:与X16组相比较,*表示差异显著(P<0.05);**表示差异极显著(P<0.01)

A-F119;B-X16图5 F119硫化氢产生能力鉴定结果Fig.5 Analysis of hydrogen sulfide production ability of F119 strain

表1 p-NPG显色法产β-葡萄糖苷酶能力测定Table 1 Determination of β-glucosidase production by p-NPG chromogenic method
2.6.2 非酿酒酵母F119对刺梨果酒感官品评的影响
采用电子舌传感器,分析了非酿酒酵母F119对刺梨果酒感官品评的影响。结果表明,在酸味、苦味、涩味、丰富度、后味B、后味A、鲜味、咸味等滋味方面,非酿酒酵母F119、酿酒酵母X16混合发酵刺梨果酒与酿酒酵母X16纯种发酵刺梨果酒之间无显著区别(图6)。

表2 刺梨果酒的理化指标Table 2 Physical and chemical indicators of R. roxburghii wine
注:*表示与X16组相比较差异显著(P<0.05)(下同)
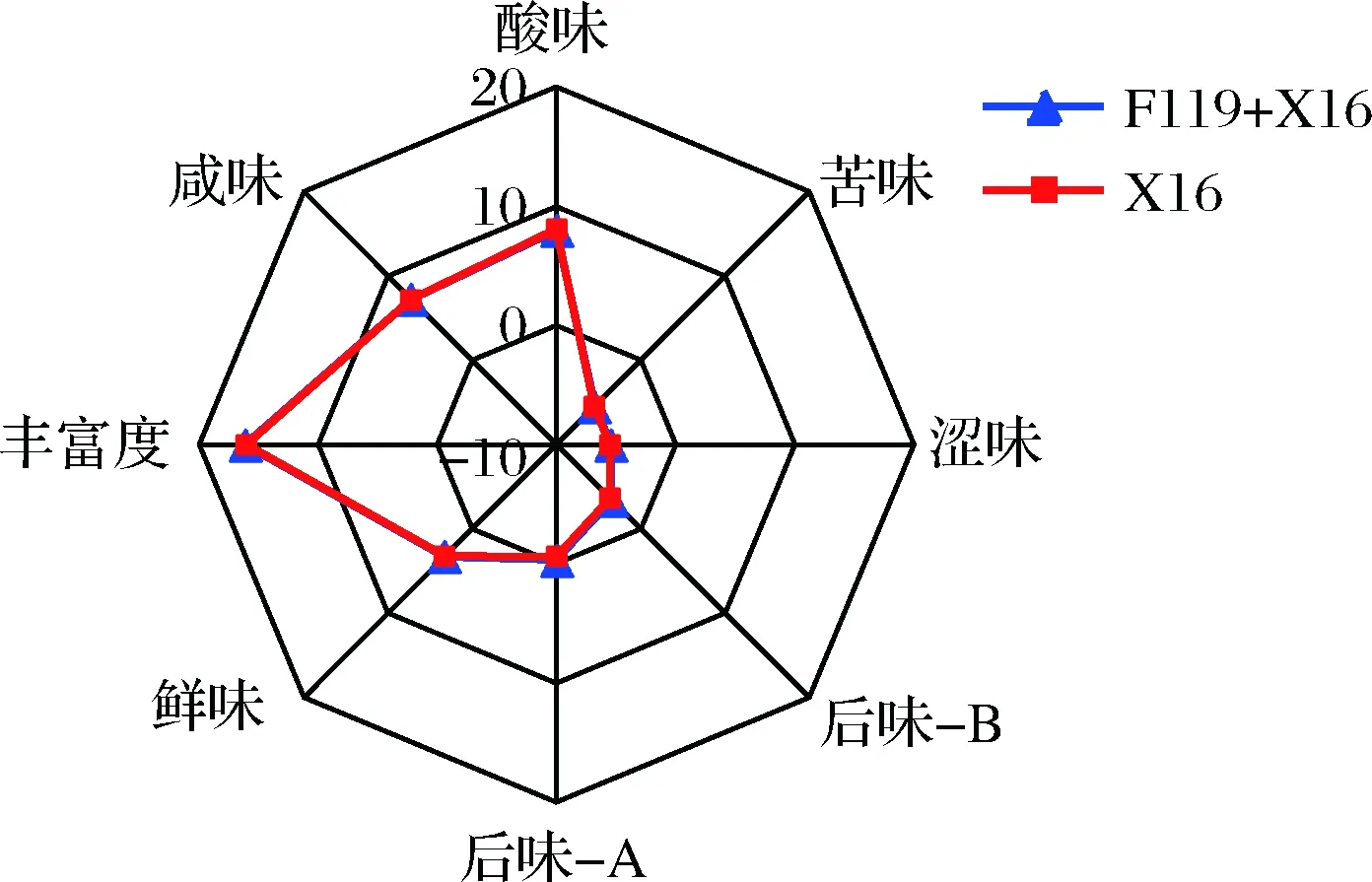
图6 刺梨果酒滋味属性雷达图Fig.6 R. roxburghii wine taste attribute radar chart
2.6.3 非酿酒酵母F119对刺梨果酒香气物质的影响
为分析非酿酒酵母F119对刺梨果酒香气物质的影响,利用SPME-GC-MS技术测定非酿酒酵母F119与酿酒酵母X16混合发酵刺梨果酒(F119+X16)挥发性香气物质成分。结果如表3所示,F119混合发酵刺梨果酒中共检出40种挥发性物质成分,包括酸类4种、醇类8种、酯类17种、酮类4种、醚类2种、酚类1种、醛类1种以及烷烃类3种;对照组酿酒酵母X16纯种发酵刺梨果酒中也检测出了40种挥发性物质成分,包括酸类1种、醇类12种、酯类20种、酮类2种、醚类1种、酚类2种以及醛类2种,未检测到烷烃类。F119混合发酵减少了刺梨果酒中醇类、酯类、酚类、醛类物质的种类,增加了酸类、酮类、醚类以及烷烃类物质的种类。
尽管F119混合发酵增加了酸类物质的种类,但酸类物质的总量相比X16纯种发酵,发生了显著降低,表明F119混合发酵在一定程度起到了降酸的作用;在醇类物质方面,F119混合发酵既减少了发酵果酒中醇类物质的种类,也降低了醇类物质的总含量,高级醇的种类和含量均减少;F119混合发酵降低了酯类物质的种类,但酯类物质总量未减少;酮类、酚类、醛类物质在F119混合发酵果酒中含量均比X16纯种发酵低。
酯类物质是酒类中主要的呈香物质,具有花香和果香。2种刺梨发酵果酒中主要的酯类物质均为辛酸乙酯、乙酸异戊酯、己酸乙酯、癸酸乙酯、2-糠酸乙酯,其在F119混合发酵刺梨果酒酯类物质中比例分别为45.15%、17.00%、12.94%、8.67%和3.44%;(9Z,12Z,15Z)-9,12,15-三烯十八酸苄酯、7-氧代二环[3.3.1]壬烷-3-甲酸甲酯、N-正己基-2,6-二异丙基氨基甲酸苯酯为F119混合发酵刺梨果酒中所特有的香气物质,而异丁酸乙酯、戊酸乙酯、己酸甲酯、十一酸甲酯、丁二酸(环己-2-烯基)甲基异丁基酯、5-羟基-2′,4′-二叔丁基戊酸苯酯是酿酒酵母X16发酵刺梨果酒中所特有香气物质。

表3 刺梨果酒香气物质种类及含量Table 3 The aroma substances and their contents in R. roxburghii wine
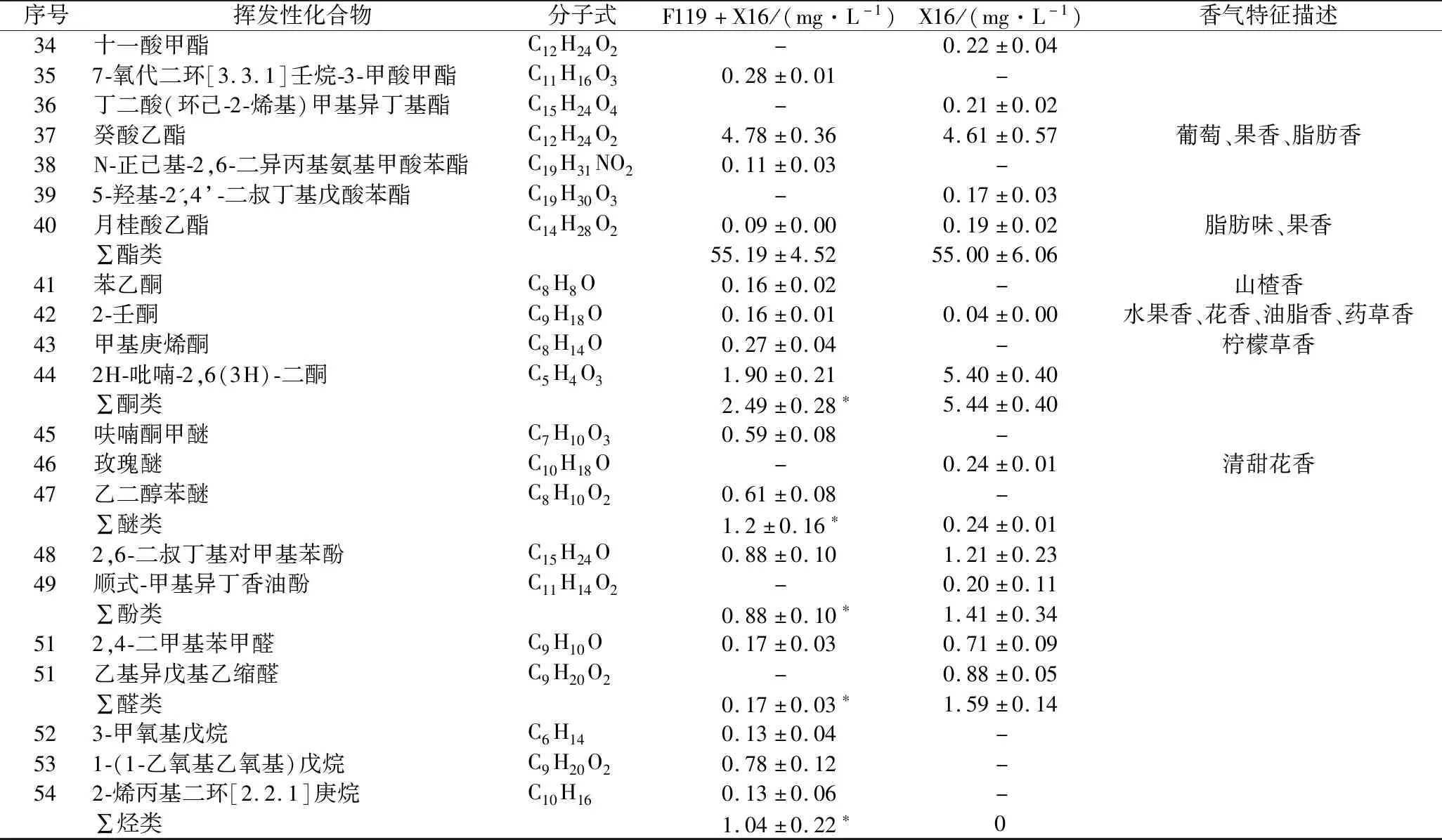
续表3
注,-表示无
风味活性值(odour activity value,OAV)可评价某种挥发性化合物对酒体香气的贡献度,OAV>1时,该化合物对酒体香气有突出的贡献度,反之OAV<1表明该化合物对酒体贡献度不突出。刺梨发酵果酒中主要的挥发性化合物的OAV如表4所示。在F119混合发酵刺梨果酒中OAV>1的成分有13种,OAV<1的有3种。其中正辛醇在F119混合发酵刺梨果酒中OAV<1,在X16纯种发酵果酒中OAV>1。

表4 刺梨果酒香气成份OAVTable 4 The OAV of aroma substances in R. roxburghii wine
3 讨论
由于刺梨果实本身酸、涩特性,一般以加工产品形式出售。作为贵州省主打特色产业之一,刺梨种植规模增速较快,但其加工产业发展还较为滞后,且服务于加工产业的基础研究还比较薄弱。如对刺梨酵母研究还比较少,加工刺梨果酒的优质酵母还比较缺乏。刺梨果实上天然存在着大量的野生酵母酵母菌,其中不乏一些优质的种属,因此从中分离优质酵母是可行的[20]。本研究采用自然发酵法对刺梨果实上非酿酒酵母进行了分离,赖氨酸培养基共鉴定出80株非酿酒酵母。嗅闻法从中发现1株产香较为浓郁菌株F119,对其进行了深入分析。生理耐受性结果发现,该菌株对葡萄糖、柠檬酸和SO2均具有一定的耐受性,且不产硫化氢。因此,对酿酒环境具有较好的耐受性。但该菌株与商业化的酿酒酵母X16相比,在乙醇耐受性,产β-葡萄糖苷酶量以及菌体生长速率等方面还有些差距。但目前微生物育种技术已发展较为成熟,可以此菌株为出发菌株,进行诱变育种,原生质体融合育种、杂交育种等技术进行相关改造,使其酿酒特性更优。
TRISTEZZA等在黑曼罗(Negroamaro)葡萄酿造过程中,将葡萄汁有孢汉逊酵母菌株ITEM8795和酿酒酵母ITEM6920以共接种和顺序接种形式作为混合发酵剂[21]。结果表明,混合发酵可降低酒体中挥发酸含量,调节酒体感官特性,包括降低醇类挥发性物质的含量,增加醛酮类物质的含量。本研究中形态学与分子生物学结果表明,F119菌株为1株来源于刺梨的葡萄汁有孢汉逊酵母,将其与酿酒酵母X16以共接种的形式混合发酵刺梨果汁,可增加发酵果酒中挥发性酸性物质的种类,降低挥发性酸性物质和总酸的含量。降低醇类物质的种类和含量,增加酮类物质的种类,增加醚类和烃类物质的种类和含量。与TRISTEZZA等[21]研究结果较为相似。
混合发酵果酒中酯类物质的种类较酿酒酵母单独发酵的少,可能与F119产β-葡萄糖苷酶能力较低相关。包括β-葡萄糖苷酶在内的糖苷酶可水解含糖苷键类的风味前体物质,促进挥发性风味物质的释放[22-23]。但本研究仅分析了F119中β-葡萄糖苷酶含量,其他糖苷酶如α-L-阿拉伯呋喃糖苷酶[24]、α-L-吡喃鼠李糖苷酶[25]、β-D-木糖苷酶[26]活性还未知。对风味物质产生机理还需做进一步的研究。
综上,本研究系统分析了刺梨来源的葡萄汁有孢汉逊酵母F119酿酒特性,并以此与酿酒酵母进行了混合发酵,分析了其对刺梨果酒品质的影响。结果表明,该菌株具有一定的酿酒环境耐受性,且不产硫化氢,混合发酵可调节刺梨果酒风味物质的种类和含量,因此具有一定的应用潜能。但还需要放大进行工业化的中试实验,进一步评价该菌株特性。
