JAM3基因甲基化是食管鳞状细胞癌潜在的分子标志物
2020-05-11苏小茉郭明洲
王 勤,苏小茉,郭明洲
1.新乡医学院第三附属医院消化内科,河南 新乡 453000; 2.中国人民解放军总医院消化内科
食管癌是常见的消化系统恶性肿瘤之一,其发病率和死亡率在全球分别位居第7位和第6位。食管癌具有地域性分布的特点[1]。在我国,食管癌高发于太行山地区,农村地区食管癌发病率高于城市[2]。食管癌的主要病理类型为鳞状细胞癌和腺癌,在食管癌高发区,主要的病理类型为鳞状细胞癌,而在西方国家主要为腺癌[3-4]。种族、性别、吸烟、饮酒、胃食管反流病、饮食、营养失衡、遗传因素是食管癌发生的主要危险因素[5]。近年的研究表明,环境因素引起的遗传和表观遗传学改变在食管癌的发生、发展中起着重要作用[4]。
抑癌基因启动子区高甲基化和基因组范围低甲基化被认为是肿瘤发生的重要原因[6]。P15、P16、BRCA1、MGMT和DAPK1等基因在不同肿瘤中均发生甲基化而表达沉默[6-8]。
DAPK、P16、MGMT、MLH1、RARβ2、HIN1、TFPI-2、DACH1和SOX17等基因均发现在食管癌及其癌前病变中频繁发生甲基化。而CHFR甲基化发生在较晚期,CHFR甲基化患者对紫杉烷类药物敏感性增加。FHIT甲基化与食管鳞状细胞癌预后不良有关[9]。这些结果表明,肿瘤相关基因DNA甲基化可能成为食管癌早期诊断、预后和化疗敏感的标志物。
连接黏附分子(JAMs)属于免疫球蛋白超家族,已被证明与上皮细胞和内皮细胞紧密连接相关,对于建立和维护细胞极性至关重要。在肿瘤发展过程中,紧密连接被重塑,肿瘤细胞能够摆脱细胞间连接的限制,促进肿瘤的迁移[10]。连接黏附分子-3(JAM3)是JAM家族中的一员,又称连接黏附分子-C(JAMC),Mandicourt 等证明JAM3可以改善肺癌细胞发育过程中的紧密连接屏障[10-11]。JAM3基因与垂体腺瘤的侵袭性有一定相关性[12]。在胃腺癌中JAM3基因的表达下调,可能参与了胃腺癌的发生[13]。JAM3在宫颈上皮内瘤变(CIN)和宫颈癌中均发生高甲基化,且甲基化水平与CIN的预后密切相关[14-15]。最近研究发现,JAM3在结肠癌中频繁发生甲基化,且JAM3在结肠癌中为抑癌基因[16]。JAM3基因在食管癌中的表达和调控机制尚不清楚。本文就JAM3基因启动子区在食管癌中的甲基化情况及其表达调控机制作一分析。
1 材料与方法
1.1 食管癌细胞系本实验所采用的食管癌细胞系KYSE410、KYSE150、KYSE520、COLO680N、KYSE140、KYSE450 和TE13均为已建立的人原发性食管癌来源的细胞。
1.2 组织标本83例原发性食管鳞状细胞癌组织标本来源于2009年8月至2011年6月收集的新鲜组织标本(中国人民解放军总医院)。5例正常食管黏膜组织来源于非肿瘤患者食管黏膜。取材的所有患者术前均未接受任何放化疗等治疗。临床分期依据美国癌症联合委员会第8版食管癌TNM分期。本研究获得中国人民解放军总医院伦理委员会批准。标本采集过程按照规范严格执行,获得患者知情同意。
1.3 实验方法
1.3.1 细胞培养:细胞置于质量浓度为100 g/L胎牛血清的RPMI-1640培养基中,在37 ℃、体积分数为5%的CO2及饱和湿度孵箱中培养,每1~2 d更换1次培养基。待细胞生长为80%~90%融合时,按照1∶3传代接种于75 cm2培养瓶中。
1.3.2 细胞5-Aza-dc处理:对数生长期的食管癌细胞,按照1∶3比例传代,12 h后更换浓度为2 μmol/L的5-Aza-dc(Sigma)RPMI-1640培养基,每24 h换液,共处理96 h,处理结束后提取RNA。
1.3.3 组织及细胞DNA与总RNA的提取:常规酚氯仿法抽提DNA,乙醇沉淀后溶于TE缓冲液。用Trizol (Invitrogen公司)提取总的RNA,紫外分光光度计检测浓度及纯度,琼脂糖凝胶电泳检测核酸质量,经筛选后分别置于-20 ℃(DNA)与-80 ℃(RNA)储存备用。
1.3.4 半定量RT-PCR检测:取5 μg总RNA用cDNA第一链合成试剂盒(Invitrogen公司)逆转录成cDNA,稀释5倍后取2.5 μl为模板在25 μl反应体系扩增。JAM3引物序列为:5′-ACGGATTCCAGAGCCAATC-3′(forward)和5′-CGCCAATGTTCAGGTCATAG-3′(reverse),扩增产物长度为187 bp,反应条件为:95 ℃ 5 min;95 ℃ 30 s,64 ℃ 30 s,72 ℃ 40 s,3 cycles;95 ℃ 30 s,61 ℃ 30 s,72 ℃ 40 s,3 cycles;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 40 s,3 cycles;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,25 cycles;72 ℃ 7 min。双蒸馏水(ddH2O)作为空白对照,排除体系污染。GAPDH作为参照检测cDNA质量,其引物序列为:5′-GACCACAGTCCATGCCATCAC-3′(forward)和5′-GTCCACCACCCTGTTGCTGTA-3′(reverse),扩增产物长度为454 bp,反应条件为:95 ℃ 5 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 40 s,25 cycles;72 ℃ 7 min。PCR产物经质量浓度为20 g/L琼脂糖凝胶电泳检测。
1.3.5 甲基化特异性PCR(methylation specific PCR,MSP):2 μg细胞或组织DNA经亚硫酸氢钠处理,Wizard DNA clean-up纯化DNA后溶于20 μl ddH2O储存于-80 ℃备用。JAM3启动子区特异性甲基化引物序列为:5′-AGAATTTATGTGTCGGTTTAGAGTATC-3′(M-forward)和5′-CCGCCCCAATTACCATAACGACCG-3′(M-reverse);扩增产物长度为118 bp。启动子区特异性非甲基化引物序列为:5′-GAGAATTTATGTGTTGGTTTA-GAGTATT-3′(U-forward)和5′-ACCCACCCCAATTACCATAACAACCA-3′(U-reverse);扩增产物长度为121 bp。反应条件为:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,35 cycles;72 ℃ 7 min。体外甲基化DNA(in vitro methylated DNA,IVD)作为甲基化对照,正常人外周血淋巴细胞(normal lymphocyte,NL)DNA作为非甲基化对照,ddH2O作为阴性对照。取MSP扩增产物10 μl,质量浓度为20 g/L的琼脂糖凝胶电泳检测。
1.4 统计学分析采用SPSS 17.0软件进行统计处理,食管癌患者的年龄、性别、肿瘤大小、TNM分期、肿瘤位置、吸烟史、饮酒史、家族史与JAM3启动子区甲基化的关系采用χ2检验进行单因素分析,检验水准α=0.05;P<0.05为差异有统计学意义。
2 结果
2.1 JAM3在食管癌细胞系中的表达情况JAM3在KYSE520、KYSE140、KYSE450细胞中高表达,在KYSE410、COLO680N、TE13、KYSE150细胞中表达缺失。经过5-Aza-dc处理后,KYSE520、KYSE140、KYSE450细胞中JAM3表达水平不变,KYSE150、KYSE410、COLO680N、TE13细胞中JAM3表达恢复(见图1A)。
2.2 食管癌细胞系中JAM3基因启动子区甲基化情况JAM3基因启动子区在KYSE520、KYSE140、KYSE450细胞中表现为非甲基化;在KYSE150、KYSE410、TE13、COLO680N细胞中呈完全甲基化状态(见图1B)。
2.3 原发性食管鳞状细胞癌组织中JAM3基因启动子区的甲基化情况原发性食管鳞状细胞癌组织中JAM3的甲基化率为50.6%(42/83),而正常食管黏膜组织中JAM3均为非甲基化(0/5)(见图2)。
2.4 JAM3甲基化与原发性食管鳞状细胞癌临床因素的关系JAM3 启动子区甲基化与原发性食管鳞状细胞癌病灶的位置相关(P<0.05),与年龄、性别、TNM 分期、肿瘤大小、吸烟史、饮酒史、家族史无相关性(P>0.05,见表1)。
图1 JAM3在食管癌细胞中的表达及甲基化状态A:5-Aza-dc处理前后食管癌细胞系中JAM3的表达情况;B:MSP检测食管癌细胞系JAM3基因启动子区甲基化情况
Fig 1 The expression and methylation status of JAM3 in esophageal cancer cellsA: expression of JAM3 analyzed before and after 5-Aza-dc treatment in esophageal cancer cell lines; B: promoter region methylation of JAM3 in esophageal cancer cell lines detected by MSP
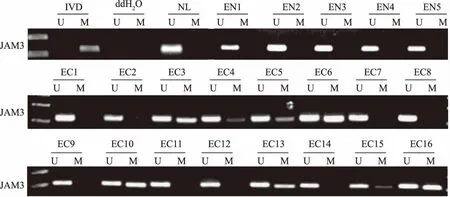
注:M:甲基化;U:非甲基化。EN1~EN5:正常食管黏膜组织;EC1~EC16:原发性食管鳞状细胞癌组织。

表1 JAM3甲基化与原发性食管鳞状细胞癌临床因素的关系 Tab 1 The association of JAM3 methylation with clinical factors in primary esophageal squamous cell carcinoma
续表1
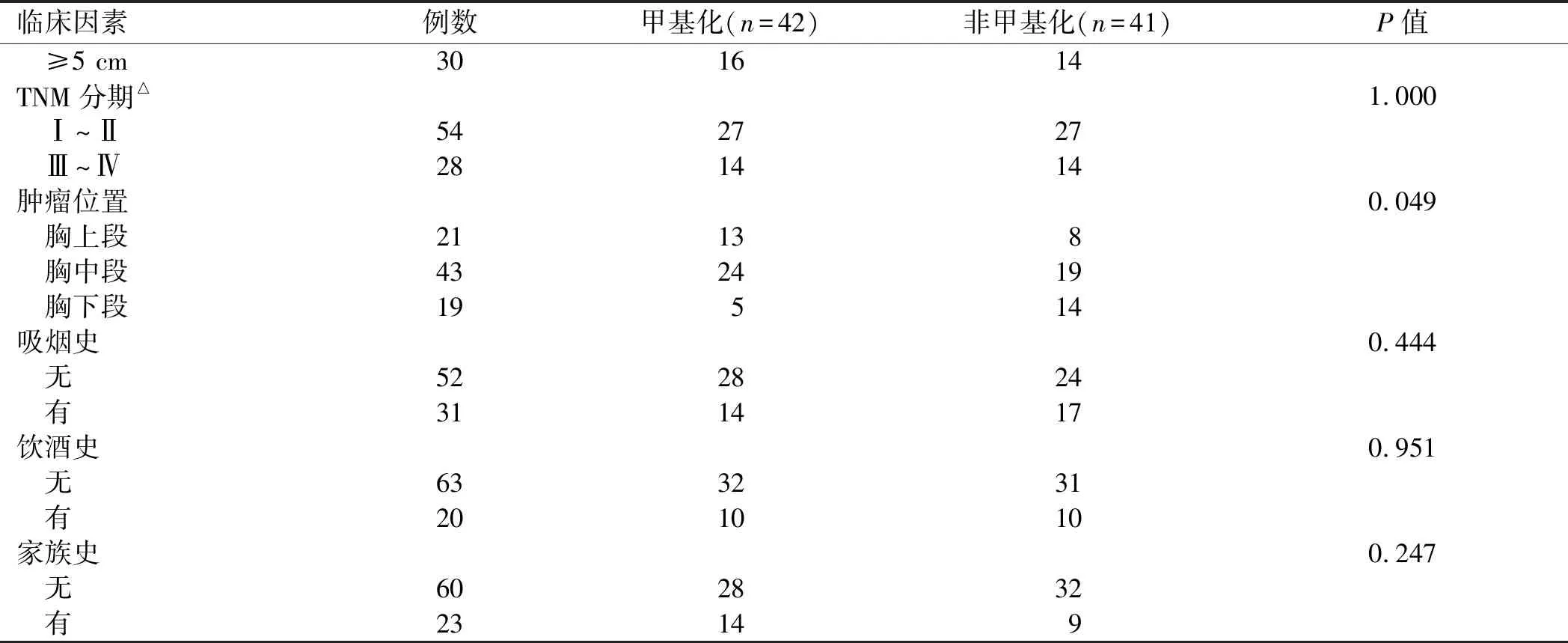
临床因素例数 甲基化(n=42)非甲基化(n=41)P值 ≥5 cm301614TNM分期△ 1.000 Ⅰ~Ⅱ542727 Ⅲ~Ⅳ281414肿瘤位置 0.049 胸上段21138 胸中段432419 胸下段19514吸烟史 0.444 无522824 有311417饮酒史 0.951 无633231 有201010家族史 0.247 无602832 有23149
注:*:2例患者肿瘤大小数据缺失;△:1例患者肿瘤TNM分期数据缺失,均未记入统计学分析。
3 讨论
JAM3是JAM家族的成员之一,由两个Ig样结构域组成,在其羧基端有一个PDZ结构域结合位点,与上皮细胞和内皮细胞紧密连接相关[10, 17]。Guo等[15]收集139例CIN患者随访24个月,发现JAM3甲基化与CIN的进展有关。结直肠癌组织的甲基化与肿瘤TNM分期显著相关[16]。
本研究发现,JAM3在原发性食管鳞状细胞癌中50.6%发生甲基化,其甲基化与肿瘤的位置相关, 而与年龄、性别、TNM 分期、肿瘤大小、吸烟史、饮酒史、家族史无关。进一步明确JAM3在食管癌中的表达受启动子区甲基化的调控。该研究的局限性是检测的样本量较小,增加样本量进一步研究有望获得更多的信息。另外,该研究对JAM3在食管癌发生、发展过程中的功能未进行深入研究,今后拟对其功能和作用机制进行深入研究,以获得可能的治疗靶标。
