P2型层状钠离子电池正极材料的研究
2020-05-10李婷婷钟盛文周苗苗黄吉丽
李婷婷 , 钟盛文 , 周苗苗 , 黄吉丽
(江西理工大学,a.材料冶金化学学部;b.江西省动力电池及材料重点实验室,江西 赣州 341000)
锂离子电池具有能量密度大、循环寿命长、工作电压高、无记忆效应、自放电小、工作温度范围宽等优点,但是锂在地壳和海水中的含量较低[1-2]。相比于锂而言,钠在地球上资源丰富,价格便宜,分布广泛。所以钠离子电池也被公认为是锂离子电池的替代品。同时,钠和锂在元素周期表的同一主族,具有相似的物理化学性质[3-5]。钠离子电池与锂离子电池具有相同的结构:正极材料、负极材料、电解质、隔膜。电池充放电过程中,Na+在两个电极之间往返嵌入和脱嵌:充电时,Na+从正极脱嵌,经过电解质嵌入负极,负极处于富钠状态;放电时,Na+从负极脱嵌,经过电解质嵌入正极,正极处于富钠状态[6-7]。钠离子电池的电极材料主要有层状 NaxMO2(M=Co、Ni、Fe、Mn 和 V 等)材料,金属氟化物,聚阴离子型材料等。由于Mn在地壳中储量丰富,无毒,比容量较高,则层状NaxMnO2材料比容量高,毒性较低,被广泛应用于钠离子电池材料中,所以层状NaxMnO2材料的技术研究已经成为热点[8]。
层状NaxMnO2材料的结构由Mn-O八面体,通过共边形成层状结构。钠的大离子半径(0.102 nm)有利于八面体或棱柱位点的六重配位。NaxMO2系统主要结构是 O3,O,3,P3或 P2型[9]。 最常见的结构一般为O3和P2型结构,O型层状氧化物在八面体位置容纳钠离子,而P型材料在棱柱位点包含钠离子[10]。O3相结构由于钠离子迁移要通过狭窄的四面体中心位置,具有更大的扩散势垒[11]。而层状P2型结构中钠离子需要通过相对宽阔的平面四边形中心位置,所以P2相比O3相扩散势垒更低,一般表现出更好的电化学性能[12-14]。这四种结构的电池材料均能够发生可逆脱嵌。前3种材料O3↔O,3↔P3相之间发生了相互转变,会导致循环性能恶化。但P2相的NaxCoO2材料在充放电过程中,保持其原结构,具有较优的电化学性能[15-17]。Bruce等[18]认为层状的P2型NaxMnO2拥有较高的理论比容量,而且价格低廉,相对于NaxCoO2更加有优势。
虽然P2型Na0.5MnO2具有较好的性能,但其电化学性能仍需提高。为了改善其电化学性能,通常在MO2片中加入过渡金属(Fe[19]、Co[20]、Ni[21]等)取代一部分Mn3+来改善NaxMnO2的结构,这样化合物表现出层状相变,不会转变为尖晶石结构,改善材料的循环稳定性,提高其电化学性能[22-23]。过渡金属层中的活性Ni2+[24,25]取代可以通过抑制Mn3+在高电压(>4 V)下的溶解来稳定层状结构,从而提高整个电池电压。合成温度和保温时间都是影响材料合成的重要因素[26-27]。本研究通过将Ni2+掺入Na0.5MO2化合物中,来提高层状正极材料电化学性能。采用溶胶-凝胶法合成P2型结构正极材料Na0.5Ni0.25Mn0.75O2,并研究该材料的最佳制备条件。该材料做成电池后,在4.2 V的电压下具有稳定的充放电曲线,具有优良的电化学性能。
1 实验
1.1 样品Na0.5Ni0.25Mn0.75O2的制备
采用溶胶凝胶法制备Na0.5Ni0.25Mn0.75O2前驱体,将 Na2CO3(99.9%),Ni(CH3COO)2·4H2O(99.9%)和Mn(CH3COO)2·4H2O(99.9%)按化学计量比称取,溶解于去离子水中。在快速搅拌过程中将络合剂一水合柠檬酸加入该溶液中,反应过程中将pH值保持在8~9,然后在85℃下蒸发浓缩,制得凝胶,最后将凝胶放进120℃烘箱中干燥。在空气气氛中加热到400℃高温热解5 h,去除样品中的H2O、NH4和CO2,待马弗炉自然冷却后,再一次研磨样品后放入马弗炉中,在空气气氛下按不同煅烧制度(如表1所示)合成不同的样品材料。
表1是样品在400℃下高温热解后,转移到马弗炉中,在空气气氛下进行二次焙烧的煅烧制度。合成温度和保温时间都是影响材料合成的重要因素,探索在800、850℃和900℃温度下,分别保温12 h和16 h,对样品性能的影响。
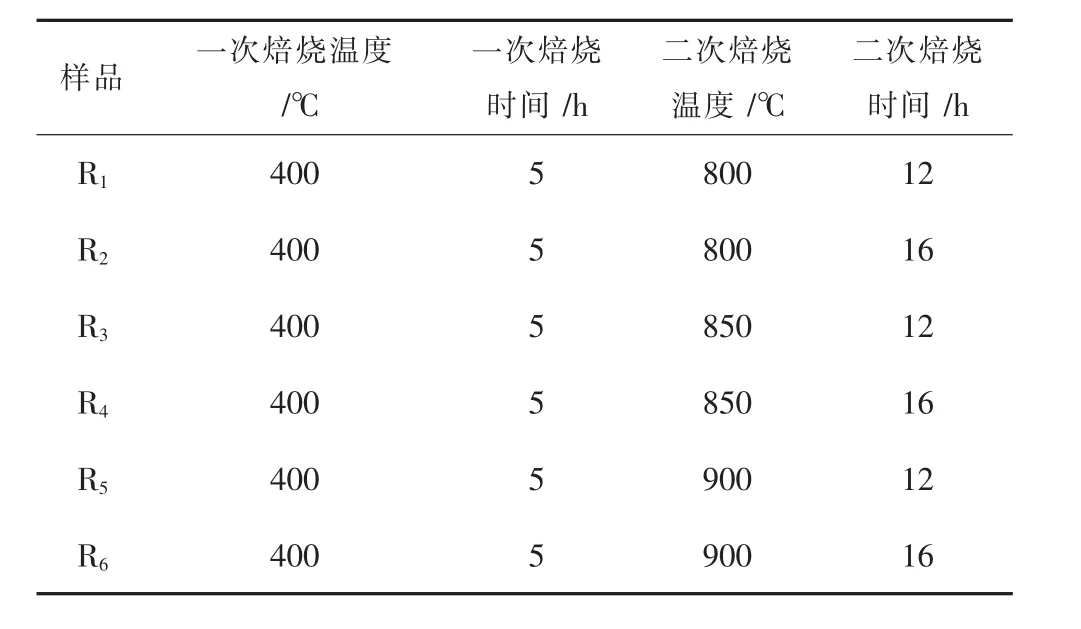
表1 样品的煅烧制度Table 1 Calcination system of samples
1.2 样品Na0.5Ni0.25Mn0.75O2的表征
本实验采用日本理学公司生产的MiniFlex 600型X射线衍射仪(XRD)对样品进行物相分析。其测试管压为40 kV;管流10 mA,使用 CuKα射线在2θ为 10°~80°的范围内对材料进行测试,扫描步长0.02°;配备EDS能谱仪的S-4800型扫描电子显微镜(SEM)表征材料的形貌和显微结构。
1.3 样品Na0.5Ni0.25Mn0.75O2的电化学性能测试
以样品为活性物质,以有机物N-甲基吡咯烷酮(NMP)为溶剂,以乙炔黑(S-P)为导电剂,以聚偏氟乙烯(PVDF)为粘结剂,将样品与 S-P、PVDF 按 8∶1∶1质量比混合,使用行星式球磨机混合均匀后将浆料涂在铝箔上,并制成正极片,然后以钠箔(厚度约0.6 mm)作为负极,电解液为 1 M NaClO6/(EC+PC)(体积比 1∶1),VMP32340玻璃纤维作为隔膜,在填充氩气的手套箱 (Mbraun MB200G)中组装CR-2032电池,手套箱内氧气和水份含量控制在0.0001‰以下。在室温下,使用Land系统对电池进行进行循环伏安测试(CV),工作电压范围在 1.5~4.2 V(vsNa+/Na),扫描速率为0.1 mV/s。相同条件下,以0.1 C的电流进行恒电流充放电测试和循环性能测试。
2 结果与讨论
2.1 不同煅烧制度对材料结构的影响
不同煅烧制度下样品的XRD图谱如图1所示。可以看出,制备的材料具有层状P2型的结构,对应于标准卡片(PDF#54-0894)。合成的Na0.5Ni0.25Mn0.75O2材料,空间群为P63/mmc。合成的Na0.5Ni0.25Mn0.75O2材料吸收峰越尖锐,峰强度越大,材料结晶性能和结构稳定性越好,更有利于材料的电化学性能。通过X射线衍射未检测出碳的衍射峰,表明柠檬酸在热分解后形成的是无定形碳,而且碳的存在未影响Na0.5Ni0.25Mn0.75O2晶体结构的完整性。保温时间保持在12 h,在800~900℃温度范围,随着温度升高,样品的衍射峰逐渐增强,而且峰形更尖锐,这是由于温度升高更有益于晶核的形成,结晶也越来越完善。而R1(800℃,12 h)样品在2θ=12.611°处出现一个杂相的衍射峰,随着温度升高,该相消失,所以Na0.5Ni0.25Mn0.75O2的合成温度不宜过低。当保温时间延长到16 h,在800~900℃温度范围,随着温度升高,材料的衍射峰逐渐增强,峰越来越尖锐,这说明延长保温时间有利于材料的结晶和晶粒生长。 而 R2(800 ℃,16 h)样品在 2θ=12.611°处有一个杂峰,R4样品在 2θ=38°和 46°处出现衍射峰,表明层状的P3型相出现。随着煅烧温度达到900℃,煅烧时间达到16 h后,获得的XRD图表明没有任何其他不纯的第二相。 此外,在 2θ=38°,46°,53°和 58°处未观察到衍射峰,表明没有层状的P3型相出现。这是因为Na0.5Ni0.25Mn0.75O2中的Na/Mn比低(Na/Mn<1),形成P2型相的高温煅烧(>850℃)有助于实现高的电化学性能。因此,随着温度升高,时间的延长,表明材料的衍射峰逐渐增强,峰越来越尖锐均能使材料的晶型更加完善,晶体结构趋于完整,高温下保温时间的增加可以促进材料晶体的生长。
2.2 形貌分析
不同煅烧制度下制备的样品形貌如图2所示。从图中可以发现,煅烧温度对材料微观形貌影响很大:当温度较低时,样品的形貌不规则,而且颗粒尺寸小,不均匀,容易发生团聚,材料结晶和生长条件受到限制,结晶不完全。随着温度的不断升高,颗粒尺寸逐渐变得均匀,材料的形貌越来越规整。当煅烧温度为800℃时,合成时间为12 h时,样品的形貌不规则延长保温时间对样品结晶度没有影响,这可能是因为煅烧温度不够高,样品结晶不完全造成的。当煅烧温度提高到850℃时,样品团聚严重。保温时间增加到16 h时,样品的颗粒变大,并且团聚更多,这可能是烧结温度不够,结晶不完全,烧结时间延长,样品晶粒过分生长造成的。材料的颗粒尺寸对材料的电化学性能发挥起到很大的作用,因为离子在脱嵌过程中与Na+和电子的迁移相关,颗粒尺寸较大不便于电解液往电极内部渗透,使得Na+在充放电循环中的扩散路径延长,从而使得Na+迁移受到阻碍。当煅烧温度为900℃,保温时间为12 h时的SEM图显示样品的粒径均匀,可以观察到片束状形态,片状尺寸在4 μm范围内。随着保温时间延长到16 h,样品的颗粒变大,晶体结构趋于完整,晶粒表面光滑,便于材料与电解液充分接触,利于钠离子在充放电过程中Na+的嵌入/脱出,高温下保温时间的增加可以促进材料晶体的生长。
2.3 电化学性能分析
图3 是在 1.5~4.5 V(vsNa+/Na)扫描速率为 0.1 mV/s条件下,进行循环伏安测试。可以看出,六种产品前两个周期的曲线基本相似,在800℃(R1、R2)合成的样品, 氧化还原峰的数目比 800 ℃以上(R3、R4、R5、R6)合成的样品少,相应的峰面积小,比容量不高,这是由于煅烧温度不够高,样品结晶不完全造成的。在900℃(R5、R6)合成的样品,峰面积最大,说明该产品的比容量最高。图上出现的四对氧化还原峰源自于充放电过程中的复杂相变。首次扫描时,在4.22/3.99 V处观察到高电压可逆氧化还原峰,对应于P2/O2相变,而在3.43/3.35 V,3.73/3.63 V处的两个氧化还原峰归因于Ni2+/3+、Ni3+/4+的氧化还原过程;在2.15/1.93 V处的氧化还原峰与Mn3+/4+的氧化和Mn4+/3+的还原相关。
表2列出了不同煅烧制度下合成材料的电化学性能,不同的样品的充电比容量、放电比容量、首次充放电效率、循环60次后的比容量及其容量保持率。由R1和R3和R5,R2和R4和R6分别进行对比。可以看出,提高烧结温度,延长保温时间,充电比容量和放电比容都有所提升,这是因为随着温度的不断升高,颗粒尺寸逐渐变得均匀,材料的形貌越来越规整。高温下保温时间的增加可以促进材料晶体的生长。但是循环性能随着温度和时间的改变,变化不明显。
图4 是前驱体在不同煅烧温度和不同保温时间条件下合成的Na0.5Ni0.25Mn0.75O2,以0.1 C电流在室温下,在 1.5~4.2 V(vs Na+/Na)电压范围内的首次充放电曲线。充放电曲线中的两个平台区域对应Mn3+/4+,Ni2+/4+氧化还原过程。这些充放电平台的位置与图3中的峰位置相对应。可以看出,在900℃以下合成的样品首次充放电比容量都在200 mAh/g以下。在900℃,保温时间为12 h和16 h,材料的首次放电比容量达到201 mAh/g和205 mAh/g,首次充放电效率达到93.584%、99.858%,首次不可逆容量是由于材料表面形成了SEI膜,消耗了钠离子。
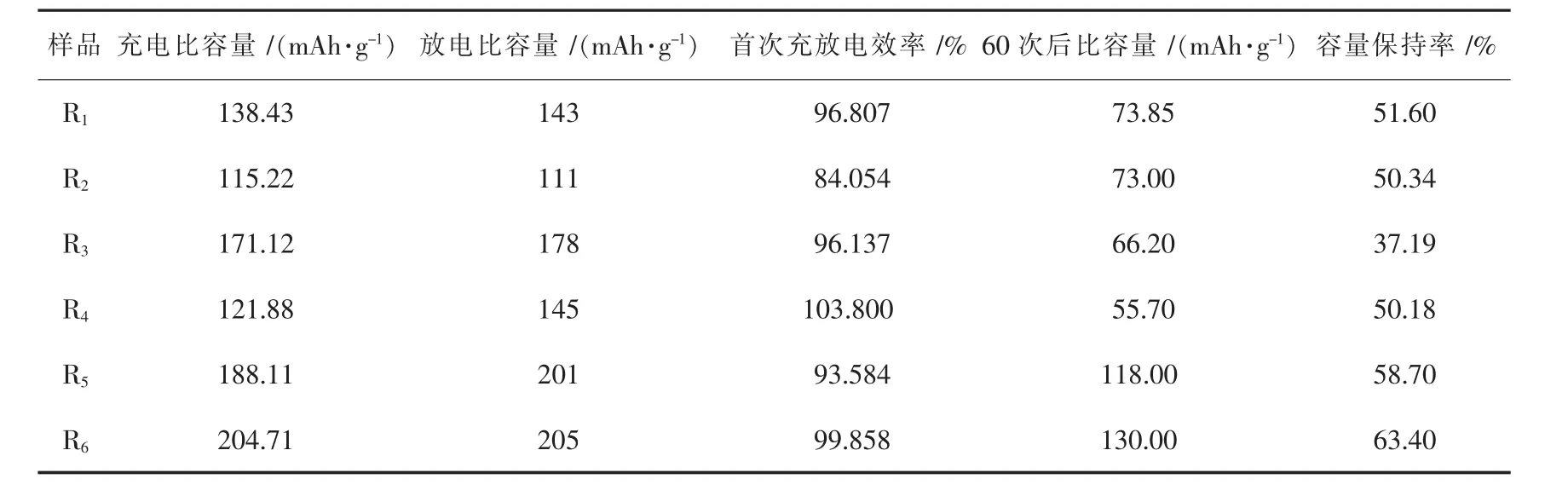
表2 不同煅烧制度下合成材料的电化学性质Table 2 Electrochemical properties of synthetic materials under different calcination regimes
图5是前驱体在不同煅烧温度和不同保温时间条件下合成的Na0.5Ni0.25Mn0.75O2,以0.1 C电流在室温下,在 1.5~4.2 V(vs Na+/Na)电压范围内的循环性能曲线。在0.1 C电流下循环60次比容量还能保持118 mAh/g和130 mAh/g,容量保持率为58.7%和63.4%。这与图3的循环伏安曲线相吻合。
3 结 论
1)通过溶胶凝胶法合成具有六方层状P2型结构的Na0.5Ni0.25Mn0.75O2正极材料。
2)当煅烧温度达到900℃,煅烧时间达到16 h后,获得的XRD图清楚地显示出样品地高度结晶性,样品的粒径比较均匀,可以观察到片束状形态,晶粒表面光滑。
3)适宜的煅烧时间可以保证材料充分生长接触,反应并且减少杂相的生成,从而提高材料的电化学性能。
4)在0.1 C,1.5~4.2V的电压范围内充放电测试,具有非常平滑的充放电曲线,并且具有非常高的放电容量205 mAh/g和良好的容量保持率。
