基于分子模拟和光谱法分析漆酶与甲酚的相互作用
2020-05-09刘红艳谢世伟张文强易忠胜
刘红艳,唐 琳,谢世伟,张文强,易忠胜,李 霞,单 杨,2
(1.桂林理工大学 化学与生物工程学院,广西 桂林 541006;2.湖南省农业科学院 湖南农产品加工研究所,湖南 长沙 410125)
漆酶(EC 1.10.3.2)是一种含铜离子的多酚氧化酶蛋白,自发现以来在环境污染物的分解和治理过程中起着至关重要的作用[1-6]。甲酚是常见酚类化合物中的一种,包括邻、间、对3种异构体,被大量应用于化工、医药、香料、农药、染料等行业,是一种污染性强的工业原材料,可在生产及使用过程中释放从而造成环境污染[7-9]。甲酚具有强烈的毒性和腐蚀性,对皮肤和粘膜有强烈刺激和腐蚀作用,吸入可引起各个器官受损,尤其对肝肾的毒害作用较大,严重者甚至导致死亡[1,10-11]。此外,甲酚作为消毒剂的主要原料,除医疗消毒外,也被养殖业主用于牲畜出栏后的消毒杀菌,而这些消毒剂残存在牲畜的粪便中,最后作为农家肥的一部分又进入到环境甚至人体中。虽然进入环境中的甲酚一般浓度较低,甚至是微量的,但其进入环境后极难降解,会通过食物链危害生物体和人类健康。由此可见,开展甲酚的降解研究对于环境污染控制及修复至关重要。Anna等通过将漆酶固定在螺旋膜反应器上,对包含甲酚在内的18种酚类底物进行生物降解,得到漆酶对间甲酚、对甲酚和邻甲酚的降解率均为40%左右[12]。Gonzalez-Coronel等将纯化漆酶固定在3种载体上,选择相对最好的漆酶固定系统降解间甲酚[13]。
本文以间甲酚为目标化合物,通过计算模拟从理论角度预测了两者之间的相互作用机制、结合信息等;选取3种同分异构体的最佳计算结果,采用光谱法进行定量和定性研究。通过两种方法相互验证多角度分析了漆酶与甲酚的相互作用,提高了实验结果的准确性,为研究环境中漆酶降解转化甲酚污染物提供了理论和方法基础。
1 实验部分
1.1 试剂与仪器
漆酶(Laccase from Trametes versicolor,LAC,0.94 U/mg),购自上海源叶生物有限公司。邻甲酚(o-Cresol,OC)、间甲酚(m-Cresol,MC)、对甲酚(p-Cresol,PC)、冰醋酸、乙酸钠等均为分析纯试剂,购自汕头西陇生化有限公司。
日立F-4600荧光光谱仪(日本株式会社日立制作所);iS10傅立叶红外光谱分析仪(Thermo Fisher公司)。
1.2 分子对接与分子动力学模拟
本研究采用Autodock 4.2软件进行分子对接模拟,从分子水平上分析漆酶与甲酚同分异构体的相互作用。受体大分子漆酶(ID:1gyc)直接从PDB数据库下载其PDB文件格式(htpp://www.rcsb.org/pdb),下载完成后进行水分子删除、加氢并计算点电荷等处理[14-17];配体小分子甲酚通过ChemBioDraw Ultra软件绘出并进行几何优化;在分子对接过程中,为了能包括化合物所有原子,盒子尺寸设为122Å× 106Å× 114Å,用Autogrid计算格点能量,对接运算采用拉马克遗传算法,其他参数设置为默认值。
采用GROMACS 4.6 软件对漆酶与甲酚体系进行 20 ns 的分子动力学模拟。在分子动力学模拟中模拟力场设定为GROMOS96 43A1,对漆酶与复合物进行添加溶剂、建立水盒子、添加抗衡离子、能量最小化处理,建立平衡系统。
1.3 荧光猝灭实验
荧光试验均在荧光光谱仪上完成。在温度298 K、扫描速度1 200 nm/min、电压900 V及反应时间2 s的条件下,分别测定漆酶与间甲酚混合物的荧光猝灭情况。在一系列10 mL比色管中,分别加入2 mL漆酶储备液(最终浓度为1.0× 10-4mol/L)和不同体积(10~90 μL)的间甲酚(1.0×10-5mol/L)储备液,用醋酸-醋酸钠缓冲溶液定容。于290、300 K两个温度下恒温反应5 min,以280 nm 为激发波长,激发和发射荧光狭缝宽度均设为2.5 nm,测定体系在300~450 nm 波长范围的荧光光谱。
1.4 红外光谱
依次扫描0.01 mol/L的醋酸-醋酸钠缓冲液、0.1 mmol/L游离的漆酶溶液、0.1 mmol/L游离的间甲酚溶液、漆酶与间甲酚混合物溶液(物质的量之比1∶1)4个样品。
游离漆酶光谱通过漆酶在缓冲液中的光谱减去缓冲液的光谱得到,漆酶-间甲酚光谱等于漆酶与间甲酚混合物的光谱减去游离间甲酚的光谱。
在傅立叶反卷积后,通过二阶导数拟合曲线,计算特征峰面积以得到每个二级结构的含量。
2 结果与讨论
2.1 漆酶与甲酚同分异构体的分子对接
经Autodock 4.2软件分别得漆酶与邻甲酚(Laccase-o-cresol,LAC-OC)、间甲酚(Laccase-m-cresol,LAC-MC)及对甲酚(Laccase-p-cresol,LAC-PC)的最优对接结果(表1)。

表1 漆酶与甲酚同分异构体对接信息Table 1 Docking information of laccase and cresol isomers
从表中可以看出,漆酶与3种甲酚结合能相差不大,其中间甲酚相较于其他两个甲酚异构体结合能最小,说明在3种同分异构体中漆酶与间甲酚更容易结合;通过比较抑制常数可知,漆酶与间甲酚的结合相对来说最稳定。漆酶与邻甲酚、对甲酚的结合略有差异,但与对甲酚结合更稳定,以上结果说明漆酶能与甲酚反应形成复合物。
图1显示了漆酶与甲酚同分异构体的结合特征信息。从图1中可以看出,漆酶与邻甲酚和间甲酚的结合位点相似且都被Phe69、Phe68、Gln70、Ala71、Gln102、His98等残基包围。此外,从蛋白质分子表面的结合位点图(中间位置的图)可以看出,邻甲酚和间甲酚基本镶嵌在蛋白内部,而对甲酚只是依附在蛋白表面。
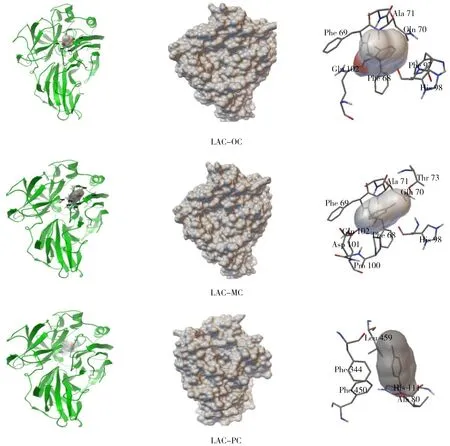
图1 漆酶与甲酚同分异构体结合特征信息图Fig.1 Binding characteristics of laccase and cresol isomers from left to right:binding site diagram based on protein skeleton,binding site map based on the surface of protein molecular,the detail drawing of binding site(从左至右:基于蛋白质骨架的结合部位图,基于蛋白质分子表面的结合位点图,结合部位局部详图)
2.2 漆酶与甲酚同分异构体的相互作用力
将分子对接结果导入Ligplot+软件分析漆酶与甲酚同分异构体的氢键和疏水作用。漆酶与甲酚同分异构体的相互作用如图2所示。由图可知,漆酶与邻甲酚和间甲酚分别形成两个氢键,而与对甲酚形成4个氢键,氢键键长如图所示。此外,漆酶氨基酸残基均是与甲酚上的羟基形成氢键。这一结果表明氢键对漆酶与甲酚复合物的形成起重要作用。另外,邻甲酚、间甲酚与漆酶形成的复合物中,甲酚被蛋白质氨基酸残基形成的疏水性“半包裹”界面包围,其中漆酶与邻甲酚形成疏水作用的主要氨基酸残基分别为Pro100、Val99、Phe68、Phe97、Gln70、Ala71、Thr73、Phe69、His98,与间甲酚形成疏水作用的关键氨基酸残基为Pro100、Phe68、Gln70、Ala71、Thr73、Asp101、His98。然而漆酶中与对甲酚发生疏水作用的氨基酸残基和前两者有很大不同,它们分别为Leu459、Phe344、Phe450和Pro79。这主要是由甲酚与漆酶的对接位点不尽相同造成的。综上所述,氢键和疏水作用是漆酶与甲酚形成复合物的主要作用力,但因结构差异,所形成的氢键数目及参与疏水作用的氨基酸残基略有不同。
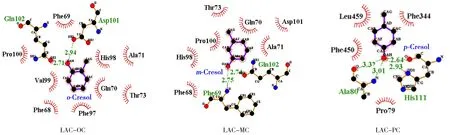
图2 漆酶与甲酚同分异构体相互作用力图Fig.2 Interaction between laccase and cresol isomers
2.3 分子动力学模拟
分子动力学模拟(Molecular dynamics simulation,MD)可以进一步找出模拟环境条件下漆酶-甲酚复合物的稳定性和动力学行为。为了探索MD模拟过程中漆酶的构象稳定性和进行有效的构象采样,本文基于起始结构计算了均方根偏差(Root mean squared deviation,RMSD),将模拟后的结构与初始结构进行比较,RMSD值越小,模拟的系统越稳定。从图3A可以看出,曲线在8 ns左右趋于水平,说明该时间下无论漆酶蛋白还是漆酶-甲酚复合物体系都达到了平衡。
回旋半径Rg代表蛋白的紧密度,Rg值越高,表示蛋白质特定区域的结构越松散。很显然,在图3B中Rg值的大小顺序是LAC-OC > LAC > LAC-PC > LAC-MC,说明漆酶与间甲酚结合后蛋白结构更紧密、更稳定,而漆酶与邻甲酚结合后蛋白构象比初始状态松散,这与分子对接及RMSD图所得结果相同。
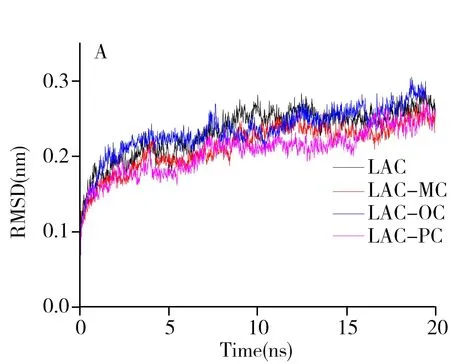
均方根波动(Root mean square fluctuation,RMSF)是基于时间对所有残基进行灵活性的平均。观察图3C可知,漆酶残基在60~100这个区域内波动较明显,说明漆酶与甲酚极有可能在这一区域发生作用。综上所述,漆酶与甲酚同分异构体大致在残基60~100区域结合且漆酶与间甲酚结合最稳定,对甲酚次之,邻甲酚相对较差。这一结果与分子对接所得结果完全一致。
2.4 间甲酚与漆酶的荧光猝灭机制
由分子对接及分子动力学模拟结果,选取结果最佳的间甲酚作为研究对象。生物大分子会产生荧光主要是由于其包含3种荧光团,即色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)残基。且计算机模拟分析中发现,漆酶与间甲酚结合时的主要氨基酸残基为Phe,因此本研究通过荧光试验检测漆酶与间甲酚结合前后荧光强度是否发生改变,并通过荧光信号的变化鉴定配体-蛋白质之间的相互作用。由于290、300 K两个温度下,间甲酚对漆酶的荧光猝灭趋势相同,故只列出了290 K时的荧光猝灭谱图(图4A)。由图可知,在芳香族残基激发波长280 nm的作用下,漆酶在发射波长344 nm左右有很强的固有荧光。随着间甲酚浓度增加,漆酶荧光强度不断下降。荧光猝灭现象表明间甲酚能够与漆酶发生相互作用。
蛋白质的荧光猝灭过程因机理的不同主要分为动态猝灭和静态猝灭。荧光强度随配体浓度增加而降低的物理现象,可归因于蛋白质与配体之间的碰撞导致的动态猝灭,或是形成了非荧光复合物的静态猝灭。可使用稳态荧光设备和改变样品的温度来区分两种机理。本文通过改变温度的方法来判断机理并利用Stem-Volmer 方程[18-22]进行数据分析:
IF0/IF=1+Kqτ0[Q]=1+KSV[Q]
(1)
式中,IF0和IF分别表示加入猝灭剂前后漆酶的荧光强度;Kq为双分子动态猝灭速率常数;τ0是无猝灭剂时生物大分子的内源性荧光寿命,约10-8s;KSV为Stern-Volmer猝灭常数;[Q]为间甲酚的浓度。以IF0/IF对[Q]作290 K和300 K两个温度下的Stern-Volmer 曲线图(图4B),并由Stern-Volmer 方程求出各个温度下的猝灭常数(R2,表2)。
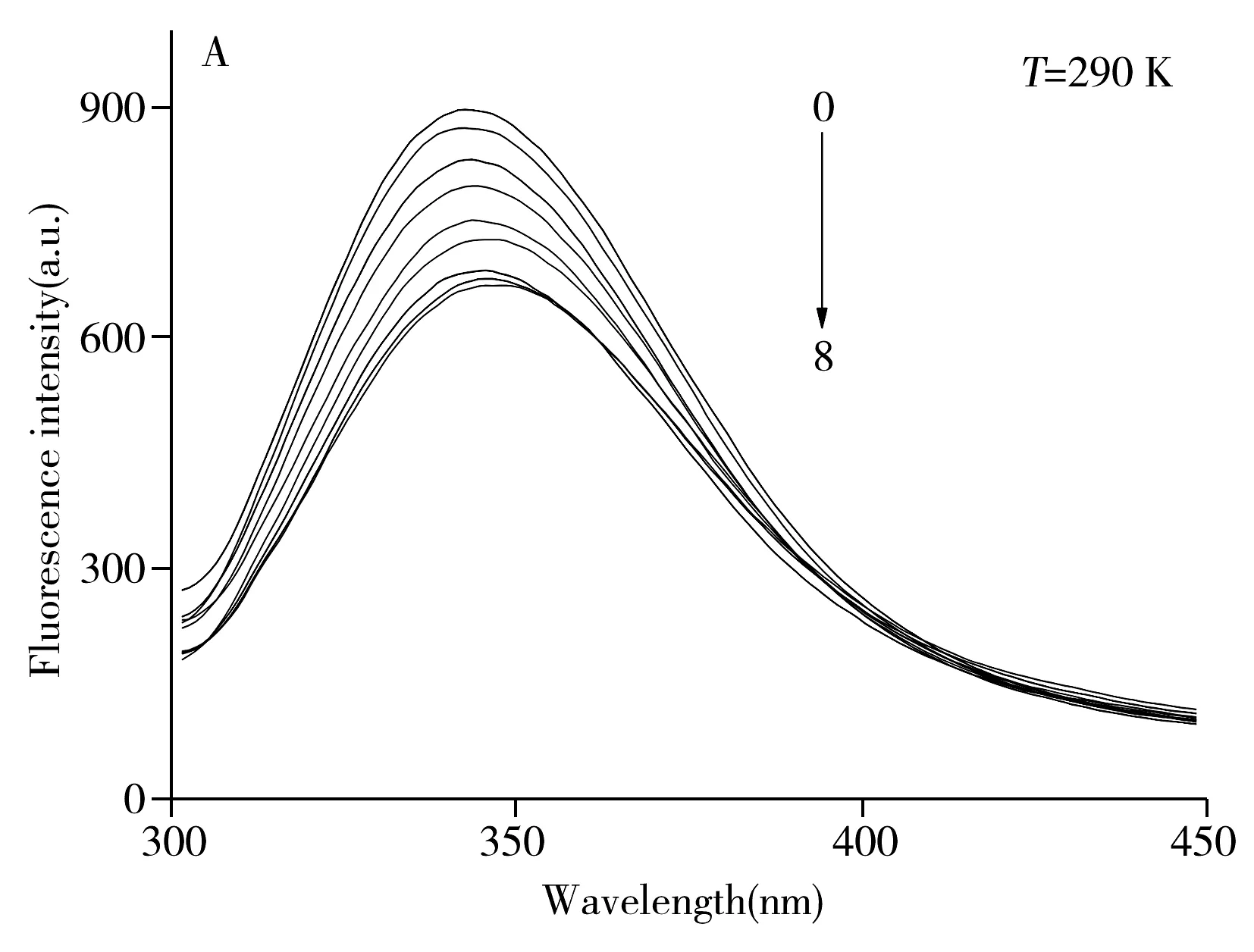
图4B为不同浓度的间甲酚与漆酶相互作用的Stern-Volmer曲线。通常,在动态猝灭中,猝灭剂和荧光之间发生分子间碰撞,最终导致KSV随着温度的升高而增加。在静态猝灭中,漆酶与间甲酚之间通过弱相互作用形成基态复合物,温度升高则可能会降低复合物稳定性,从而降低KSV[14]。根据漆酶荧光猝灭滴定数据计算的KSV值见表2。由表2可知,随着温度的升高,KSV值降低,表明漆酶荧光主要通过静态机制被间甲酚猝灭,且是由于形成漆酶-间甲酚复合物而引起的。此外,漆酶与间甲酚之间的猝灭常数Kq的数量级为1014,远大于各类猝灭剂对大分子的动态猝灭常数2.0×1010L·mol-1·s-1,进一步证明了漆酶的猝灭机制为静态猝灭[18-19]。

表2 不同温度下间甲酚对漆酶的荧光猝灭常数Table 2 Fluorescence quenching constants of laccase by m-cresol at different temperatures
2.5 傅立叶变换红外光谱
蛋白质二级结构的变化可以使用傅立叶红外变换光谱来估算。从图5A可以观察到,游离漆酶的特征性酰胺Ⅱ和Ⅰ吸收峰在1 153 cm-1和1 646 cm-1处,漆酶与间甲酚结合后峰位置移至1 170 cm-1和1 639 cm-1且峰强度变小。由于蛋白质二级结构中酰胺Ⅰ带最敏感,所以常用该范围的光谱变化来分析不同二级结构含量[23]。酰胺Ⅰ吸收峰位置的移动及峰强度的变化表明,漆酶与间甲酚结合,导致漆酶的二级结构发生变化。
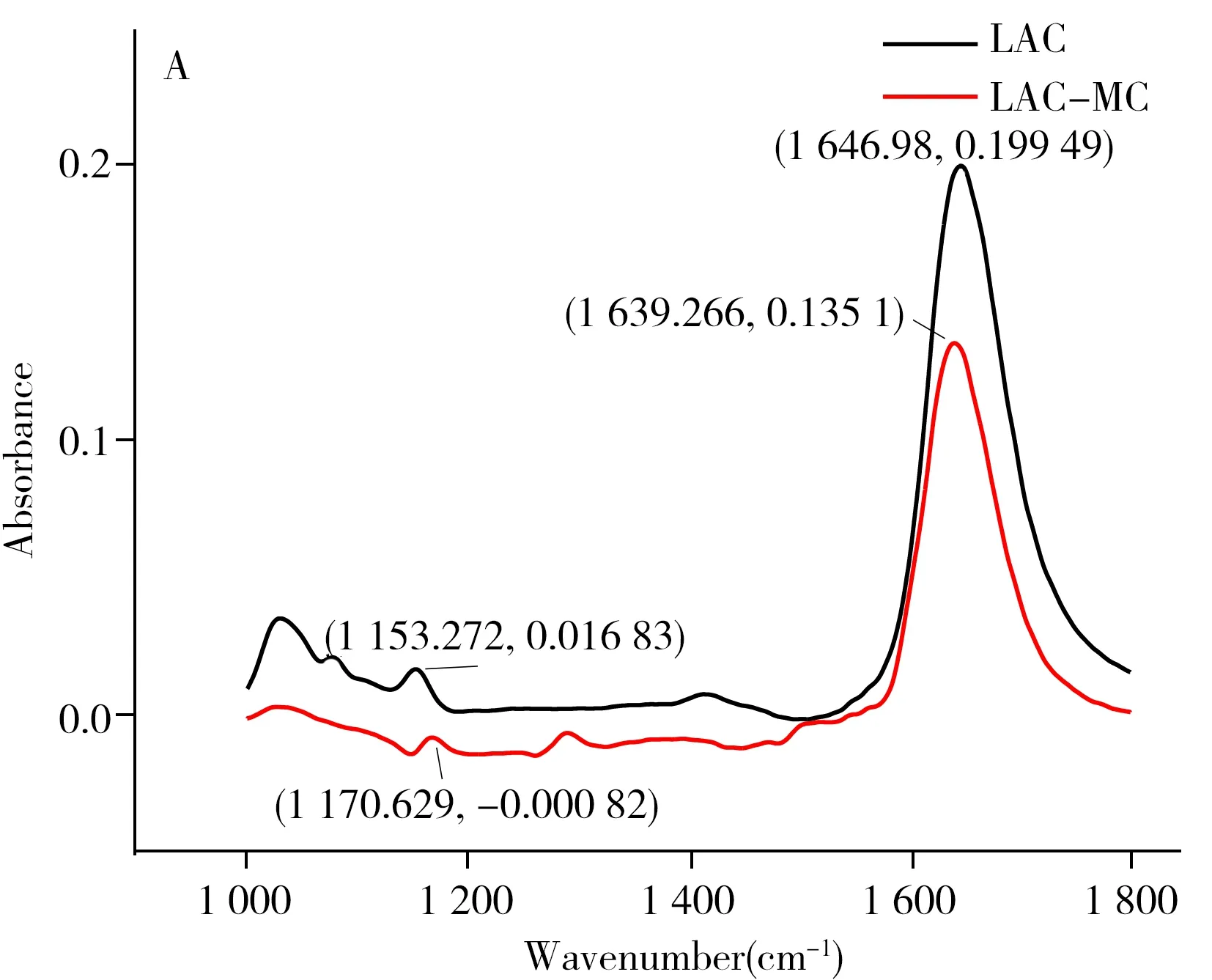
借助酰胺Ⅰ带的拟合曲线进一步对游离漆酶和漆酶-间甲酚复合物蛋白的二级结构进行定量分析[24]。酰胺Ⅰ带中,1 610~1 637 cm-1、1 638~1 648 cm-1、1 649~1 660 cm-1、1 661~1 680 cm-1、1 681~1 692 cm-1分别为β-折叠、无规则卷曲、α-螺旋、β-转角和β-反向平行结构。由图5B的拟合结果可知,游离的漆酶由1.14%的β-折叠、7.45%的无规则卷曲、23.20%的α-螺旋、40.23%的β-转角和27.98%的β-反向平行结构组成。与间甲酚结合后,漆酶的二级结构发生了明显变化。β-折叠、无规则卷曲和α-螺旋结构的含量分别增加至13.56%、31.36%和31.16%;而β-转角和β-反向平行结构分别降至21.53%和2.39%,由此可知,漆酶与间甲酚结合后,漆酶内部的β-转角和β-反向平行向β-折叠、无规则卷曲和α-螺旋转化。综上,漆酶与间甲酚结合后,蛋白质的二级结构发生了变化,该结果验证了分子动力模拟的结果。
3 结 论
本研究通过分子对接和分子动力学模拟探究了漆酶与甲酚同分异构体的相互作用,分子对接结果表明,漆酶与间甲酚更容易结合,生成的复合物更加稳定。此外,通过光谱分析方法研究了漆酶与间甲酚的猝灭机制。稳态荧光表明漆酶与间甲酚能够发生相互作用,猝灭常数随温度的变化情况证明了漆酶荧光主要通过静态机制被间甲酚猝灭。酰胺Ⅰ带的红外光谱揭示了漆酶与间甲酚相互作用后漆酶二级结构的变化,其中β-折叠、无规则卷曲和α-螺旋结构的含量增加,β-转角和β-反向平行结构的含量减少。计算模拟与光谱方法所得结果一致。本研究可为漆酶催化降解甲酚提供理论基础及数据信息。
