基于系统药理学和分子对接探讨葛根抗肿瘤作用机制
2020-05-09刘潇潇宋红霞刘亚琦于春雪
闫 浩,刘潇潇,宋红霞,刘亚琦,于春雪
(1.陕西中医药大学药学院,陕西 咸阳 712046;2.陕西中医药大学医学技术学院,陕西 咸阳 712046)
葛根(RadixPuerariae)为豆科植物野葛的干燥根,在解饥退热、生津、透疹等方面具有显著的应用价值。近年来,越来越多的研究表明葛根在抗肿瘤方面发挥着重要作用,如葛根素对肝癌细胞的生长具有抑制作用[1]、葛根散对小鼠结肠腺癌细胞具有抑制作用[2]等,但有关葛根抗肿瘤机制的研究并不多见。
系统药理学是将生物信息学、计算机网络等技术相互融合[3],揭示疾病与药物的相互关系,将“一种药物一种疾病一个基因”的思想转变为“多基因-多靶点-复杂疾病”的新思想。分子对接是预测蛋白与配体亲和能力和结合模式的强有力的工具,通过对靶点蛋白与小分子亲和能力和结合模式的预测[4],进一步研究其作用机制。
基于系统药理学和分子对接,作者对葛根在抗肿瘤方面的机制进行研究,为临床抗肿瘤药物的开发提供理论基础。
1 实验
1.1 葛根活性成分的筛选
TCMSP(traditional Chinese medicine systems pharmacology)数据库包括《中华人民共和国药典》注册的499种中药,含有29 384种成分、3 311个靶标和837个相关疾病,它为每种化合物提供了药物药代动力学信息,是进行网络药理学研究的重要工具[5]。
本研究通过TCMSP数据库搜索葛根的相关参数,然后查阅文献[6]并结合实际,以DL≥0.18为筛选标准,筛选葛根的活性成分。
1.2 肿瘤靶点的预测
首先,通过TCMSP数据库中的Targets Infomation寻找与候选活性成分相关的潜在靶点;然后,使用基因卡片(GeneCards)数据库和在线人类孟德尔遗传(OMIM)数据库,以“tumour”为关键词检索肿瘤靶点,并将两个数据库检索到的有效信息合并,去除重复项,与葛根活性成分映射,绘制韦恩图。
1.3 可视化网络模型的构建
采用Cytoscape软件进行可视化分析,对各项属性进行设置,将葛根、活性成分、对应靶点、疾病导入Cytoscape软件,构建药物-成分-靶点-疾病关系图,将葛根多成分、多靶点的复杂抗肿瘤机制清晰呈现。
1.4 靶点蛋白的筛选
将映射交集基因导入STRING数据库中,选择物种为Homo sapiens,设置相互作用分值,下载tsv文件,利用R语言绘制靶点蛋白图,选取degree值较大的前5个靶点蛋白进行分子对接。
1.5 分子对接
首先,利用PubChem数据库查找葛根候选活性成分的(二维)三维结构,绘制ChemBio3D结构,使用MM2力场进行构象优化,转存为PDBQT格式备用;再在RCSB PDB数据库中查找蛋白质-蛋白质相互作用(PPI)网络中degree值最大的5个靶点蛋白,对原PDB蛋白分子进行如下处理:去除水分子、去除复合配体、蛋白分子加氢;最后,利用Scripps研究所Olson课题组开发的Autodock Vina软件将葛根的候选活性成分与5个靶点蛋白进行分子对接,选择能量最低的结合模式利用PyMOL作图。
1.6 基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路富集分析
利用Bioconductor进行GO富集和KEGG通路富集分析,得到葛根抗肿瘤作用的主要功能富集和作用通路。
2 结果与讨论
2.1 类药性筛选与疾病-药物靶标预测
通过TCMSP数据库检索到18个葛根化合物。以DL≥0.18为筛选标准,共筛选到16个葛根活性成分,如表1所示。
表1葛根的活性成分
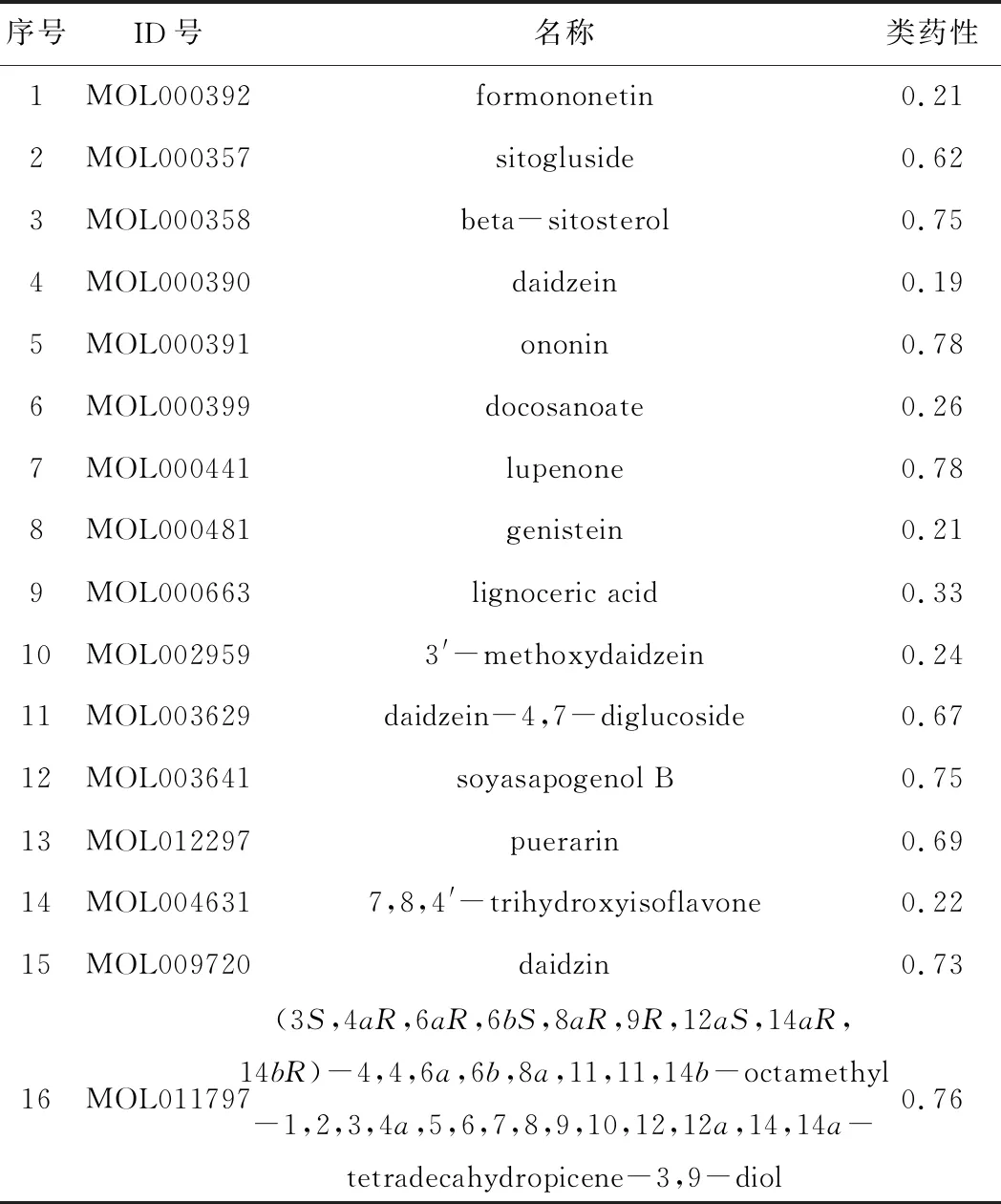
Tab.1 Active ingredients of Radix Puerariae
2.2 韦恩图及药物-成分-靶点-疾病关系图构建
通过TCMSP数据库中的Targets Information,查找到16个葛根候选活性成分的相关靶点共104个;将这些靶点经过Uniprot数据库查询转化成基因符号格式;通过GeneCards数据库和OMIM数据库查找到肿瘤靶点共8 352个,映射得到97个交集基因,如图1所示。

图1 韦恩图Fig.1 Venn mapping
采用Cytoscape软件将葛根、活性成分、疾病以及交集基因进行可视化分析,绘制葛根抗肿瘤机制的药物-成分-靶点-疾病关系图,如图2所示。

图2 药物-成分-靶点-疾病关系图Fig.2 Network of drug-ingredient-target-disease
2.3 靶点蛋白的筛选
将映射交集基因复制到STRING数据库中,设置minimum required interaction score>0.8,同时设置隐藏离散的点,下载tsv文件,运用R语言处理,得到靶点蛋白,如图3所示。
从图3可知,degree值较大的前5个靶点蛋白分别是:表皮生长因子受体(EGFR)、雌激素受体(ESR1)、白介素6受体(IL6)、核受体辅激活因子(NCOA1)、血管内皮生长因子A(VEGFA)。

图3 PPI中的靶点蛋白Fig.3 Target proteins in PPI
2.4 分子对接
利用Autodock Vina软件,对16个候选活性成分与degree值较大的5个靶点蛋白(EGFR、ESR1、IL6、NCOA1、VEGFA)进行分子对接,选取结合能最低的最优结合模式利用PyMOL作图,如图4所示。
从图4可知,胡萝卜苷(sitogluside)与EGFR的亲和能量最低,亲和力最强,其占据了由Lys745、Thr854、Cys797、Asp800、Pro794残基组成的活性空腔。羽扇豆酮(lupenone)与ESR1的亲和力最强,其占据了由Tyr526、Leu536、Trp383、Asp351、Ala350、Thr347、Leu525、Cys530残基组成的活性空腔。大豆苷元-4,7-二葡萄糖苷(daidzein-4,7-diglucoside)与IL6结合图中显示由His105、Gln39、Val93、Pro42、Tyr175、Glu85残基组成的活性空腔能够很好地包裹大豆苷元-4,7-二葡萄糖苷,其7位糖苷上的羟基与Gln39形成氢键,4′位糖苷键上的羟基与Tyr175、Glu85形成氢键。Phe388、Ile397、Leu324、Ala327、Val361、Gln286、Arg364、Leu287、Arg367、Ala368、Phe401构成了NCOA1的活性空腔,β-谷甾醇很好地占据了NCOA1的活性空腔。VEGFA的活性空腔由Gln22、Tyr21、Tyr25、Cys26、Cys102、HSD27、Pro28组成,羽扇豆酮能够很好地嵌入空腔结合。
2.5 GO富集分析
利用Bioconductor对葛根PPI网络中涉及的靶点蛋白进行GO富集分析,生物过程、细胞组分、分子功能均设定pvalueCutoff=0.05、qvalueCutoff=0.05,对前20个的基因富集绘制条形图,如图5所示。

图4 候选活性成分与靶点蛋白的最优结合模式Fig.4 Optimal binding mode of candidated active ingredients with target proteins
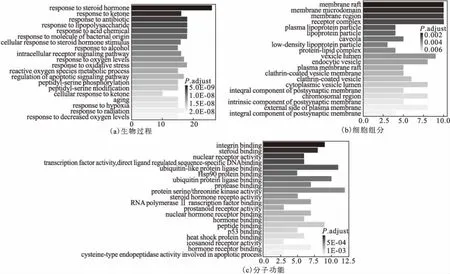
注:P.adjust值的大小代表富集的显著性;颜色越深,P.adjust值越小;反之,颜色越浅,P.adjust值越大。
由图5a可知,靶点蛋白参与类固醇激素、抗生素、活性氧代谢、氧化应激等生物过程;由图5b可知,靶点蛋白在膜筏、膜微区、膜区、受体复合物、血浆脂蛋白颗粒、囊泡腔、质膜筏等部位均有分布;由图5c可知,靶点蛋白具有蛋白结合、类固醇结合、核受体活性、转录因子活性、泛素样蛋白连接酶结合、RNA聚合酶Ⅱ转录因子结合等分子功能。因此可以得出,葛根可能是通过多途径、多靶点来发挥抗肿瘤作用。
2.6 KEGG通路富集分析
利用Bioconductor对PPI网络中涉及的靶点蛋白经R语言进行KEGG通路富集分析,设定pvalueCutoff=0.05、qvalueCutoff=0.05,经过R程序运行之后将其中显著性最大的20条通路富集结果绘制条形图,如图6所示。

注:纵轴表示通路名称,横轴表示靶点蛋白数;颜色越深,P.adjust值越小;反之,颜色越浅,P.adjust值越大。
由图6可知:前列腺癌(prostate cancer)、人巨细胞病毒感染(human cytomegalovirus infection)、p53信号通路(p53 signaling pathway)这3条信号通路与葛根抗肿瘤关系最为密切;除此之外,还得到糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、HIF-1信号通路(HIF-1signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、内分泌抵抗(endocrine resistance)、细胞凋亡(apoptosis)、大肠癌(colorectal cancer)、流体剪切应力与动脉粥样硬化(fluid shear stress and atherosclerosis)、TNF信号通路(TNF signaling pathway)、蛋白聚糖在癌症中的信号通路(proteoglycans in cancer)等显著性较高的17条信号通路,涉及多个靶点蛋白、多条信号通路。说明葛根抗肿瘤是通过多靶点、多途径发挥作用。
2.7 讨论
本研究通过TCMSP 数据库筛选出DL≥0.18的葛根活性成分16个,主要活性成分为胡萝卜苷、大豆苷元-4,7-二葡萄糖苷、葛根素、β-谷甾醇、羽扇豆酮等。胡萝卜苷是一种天然的甾醇类化合物,具有抗肿瘤作用,Lee等[7]发现胡萝卜苷对人乳腺癌细胞具有显著的抑制迁移作用且具有剂量依赖性。大豆苷元-4,7-二葡萄糖苷能使大鼠乳腺肿瘤的微血管密度下降,有效抑制乳腺肿瘤生长[8]。葛根素具有抑制肿瘤细胞周期、调控线粒体途径、肿瘤细胞凋亡信号途径,相关研究还表明葛根素纯品以及葛根粗提物都能起到诱导小细胞肺癌凋亡的作用[9]。β-谷甾醇能抑制胃癌细胞增殖并促进其凋亡,其抗癌机制可能与β-谷甾醇通过PI3K/AKT/mTOR通路诱导细胞自噬作用有关[10]。羽扇豆酮为五环三萜类化合物[11],也具有抗肿瘤作用。
葛根抗肿瘤作用主要作用于EGFR、ESR1、IL6、NCOA1、VEGFR等5个靶点,主要涉及前列腺癌、人巨细胞病毒感染、p53信号通路。研究表明,细胞内信号传导通路的异常与前列腺癌的进展与转移密切相关。Mitchell等发现AR信号转导通路能促进前列腺上皮细胞的生长,参与前列腺癌的发生、发展以及前列腺癌细胞由雄激素敏感型向抵抗型转变[12]。人巨细胞病毒是目前已知最大的β疱疹病毒,近年来的研究显示在结直肠癌[13]、乳腺癌[14]和前列腺癌[15]及小细胞型肝癌等多种类型的肿瘤组织中都存在人巨细胞病毒感染和病毒基因表达,并与肿瘤的恶性程度相关[16]。p53转录激活多种线粒体凋亡信号基因,包括Bax、PUMA、NOXA、Apaf-1和Caspase-9,进而促进线粒体膜解体和随后的Caspase激活[17]。细胞表面的跨膜蛋白与其同源配体结合后,激活细胞内Caspase-8/Caspase-10,最终激活Caspase-3、Caspase-6、Caspase-7等凋亡蛋白酶。这些结果与本研究一致,说明预测结果可靠。
3 结论
通过系统药理学分析,探讨葛根抗肿瘤作用机制;采用分子对接进一步验证其可靠性。结果表明,多种成分可作用于同一个靶点,同一成分可与多个靶点作用,说明葛根抗肿瘤是通过多成分、多靶点、多途径作用。通过对靶点蛋白基因分析可知:细胞周期控制和血管生成对其影响较大,且异黄酮类和β-谷甾醇类成分能起到干预作用,为新药研发提供了新的途径和策略。
