壳聚糖载纳米氧化铁颗粒吸附剂的配比优选与除磷性能
2020-05-09李莞璐吕建波杨金梅王少坡苏润西孙力平
李莞璐 ,吕建波 ,杨金梅 ,王少坡 ,苏润西 ,孙力平
(1.天津城建大学 环境与市政工程学院,天津 300384;2.烟台大学 土木工程学院,山东 烟台 264005)
水体富营养化是多年来人们一直关注的重大水环境问题,氮、磷等营养物质含量超标是引起水体富营养化的主要原因.最新研究表明,与控氮相比,控磷是更有效控制水体富营养化的方法[1-2].为将水中磷的浓度降到较低,亟需开发水与废水高效除磷技术.其中,吸附法因具有操作简单、绿色低廉、不产生污泥等优点[3]受到人们的高度重视,是一种有效除磷技术.在吸附技术中,通过开发设计高效除磷吸附剂,利用吸附剂的选择性除磷作用,可有效将磷浓度降到较低值[4].
氧化铁是常用的水处理除磷吸附剂,作为一类典型的两性化合物,对水中的含氧阴离子(如砷、磷和铬酸盐)和重金属阳离子(如铅、镉和铜)均显示出良好的吸附活性;但氧化铁也存在一些缺点,如多为粉末状,用于水处理时存在易聚集、分离困难和可能泄漏到水中等问题.为了克服上述问题,将金属氧化物纳米颗粒负载到大尺寸的多孔固体(如活性炭、介孔硅酸盐、生物质、砂、硅藻土)是一条有效途径[5].本文采用一种生物聚合物——壳聚糖作为纳米氧化铁的载体.壳聚糖广泛来源于虾类、贝壳生产加工业,价格低廉,由于其有利的环境友好特点和独特的分子结构而被广泛用作工程吸附剂[6].壳聚糖具有丰富的氨基和羟基官能团,本身的磷吸附容量虽然较低,但若将壳聚糖与金属氧化物两者复合,可充分利用二者之优点,设计出颗粒化的有机-无机复合吸附剂(毫米尺寸),并通过吸附柱的方式用于水处理工艺,从而解决粉末状铁氧化物工程应用时难以分离的问题;另外作者的前期研究也发现:复合吸附剂具有良好的吸附除磷协同性能[7],具有用于水处理工艺的良好潜力.
为设计出高效除磷壳聚糖载纳米氧化铁(CNFeOOH)吸附剂,其主要组分——壳聚糖和Fe(Ⅲ)盐的配比优选是亟需解决的重要问题.因此,本文在前期研究的基础上,设计出不同Fe(III)/壳聚糖单体摩尔配比的复合吸附剂,并基于磷去除率对其摩尔配比进行优化筛选,进而考察最优配比吸附剂的磷去除性能和机理,为该复合吸附剂用于水处理深度除磷提供科学依据和技术支持.
1 材料与方法
1.1 不同配比壳聚糖载纳米氧化铁的制备
吸附剂采用原位水解-浸渍法制备,共设定8个配比(R=0,1.6,2.4,3.2,4.0,4.8,5.6,6.4).在制备过程中,将定量的壳聚糖粉末与不同摩尔浓度的FeCl3·6H2O溶液混合,在50℃水浴锅中加热,并用玻璃棒搅拌至均匀形成黏稠状液体,放置至室温后滴入0.5 mol/L的NaOH溶液中,形成颗粒状固体;颗粒成形后,用去离子水浸泡至溶液pH接近中性,在50℃恒温烘箱中烘干后研磨成粉末,备用.当R=5.6和R=6.4时,吸附剂颗粒难以形成.因此,确定R=4.8为临界点,共制备出6个配比的吸附剂(R=0~4.8).
1.2 吸附实验
除吸附动力学实验外,其他吸附实验的反应时间均为24 h,且在50 mL塑料瓶中进行,所有吸附剂投加量均为0.5 g/L.用NaOH或HCl调节pH值,除pH影响实验外,其他实验的pH值均稳定在7.0±0.1;除离子强度影响实验外,其余实验的背景电解质均为0.01 mol/L的NaCl溶液;除热力学实验外,其余实验温度均为(20±1)℃.吸附反应平衡后,水样过 0.45 μm混合纤维微孔滤膜后分析磷的浓度.
动力学实验在0.5 L烧杯中进行,磷浓度分别为10,30 mg/L,在磁力搅拌下,不同时间点(5~2 880 min)取样,分析水样中磷的浓度.
等温吸附和热力学实验中,取40 mL不同初始浓度的磷溶液置于50 mL塑料瓶中,调节温度分别为20,25,30℃,然后置于旋转摇床上反应 24 h,实验结束取样分析水样中磷的浓度.
为研究共存离子与磷的竞争吸附影响,分别考察不同浓度(0,0.1,1.0,10 mmol/L)的 SiO32-、CO32-、SO42-、Mg2+和Ca2+对磷吸附效果的影响,反应24 h结束后,取样分析溶液中磷浓度.
吸附-解吸实验:在磷浓度分别为10,30 mg/L的0.5L烧杯中室温下进行,在恒温磁力搅拌下反应24h,取出吸附剂,分析溶液中剩余磷浓度.将吸附剂置于0.5 mol/L的200 mL的NaOH溶液中解吸8 h,然后再用水进行冲洗至溶液的pH呈中性,置温度为50℃的烘箱中烘干;再将该吸附剂放入另外两组初始浓度相同的含磷溶液,重复如上实验4次.每次吸附剂烘干后测量其质量,计算出质量损失的百分数.
实验中涉及到的吸附量计算为q=(C0-Ct)V/m,其中:q为吸附量,mg/g;V为磷酸盐溶液的体积,L;C0、Ct分别为吸附前后溶液中 PO43-的浓度,mg/L;m 为吸附剂的质量,g.
1.3 测试方法
将制备的吸附材料用去离子水冲洗,经冷冻干燥后,进行以下测试分析.比表面积和孔径分布:用NOVA-6000型比表面积和孔径分析仪得到吸附剂的氮气吸附-脱附等温线,分别用BET(brunauer-emmettteller)方法和 BJH(barrett-joyner-halenda)方法计算比表面积和孔径分布[8];机械强度:采用YHKC-2A型颗粒强度测定仪进行分析,通过选取50个颗粒材料,测定其压力大小,然后取平均值;采用Tecnai G2 F20型场发射透射电子显微镜(FETEM)和D/MAX-2500型X射线衍射(XRD)仪观察材料的形貌和主要晶体结构.
2 结果与讨论
2.1 吸附剂最佳摩尔配比的确定
为优选最佳吸附剂,采用吸附等温线对不同配比吸附剂在pH=7±0.1、T=(20±1)℃条件下的磷吸附容量进行了考察,结果如图1所示,所对应的各摩尔配比吸附剂的饱和吸附容量见表1.由图1可见:随着配比从R=0增加至R=4.8,各吸附剂的磷吸附容量呈增加趋势;R=4.8的吸附剂对磷的吸附容量最大(18.72 mg/g),吸附效果最好.由表1可见,相对应的CNFeOOH吸附剂的比表面积和孔径随着Fe(Ⅲ)摩尔比的增加总体呈增加趋势;当R=4.8时,比表面积增大到102.28 m2/g,孔径为7.81 nm,机械强度为10.43 N,物理性质良好.因此,采用配比为R=4.8的CNFeOOH吸附剂进行后续研究.
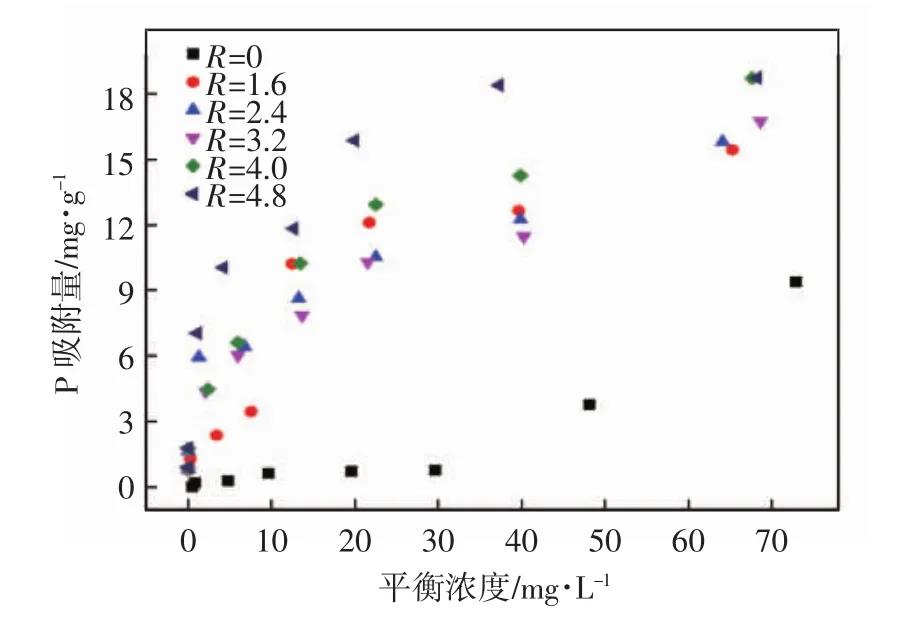
图1 6种摩尔配比材料的等温线吸附
2.2 吸附剂的物化性质
所制备的CNFeOOH吸附剂呈不规则的颗粒状,表面粗糙多孔.场发射透射电镜照片(FETEM)可以观察颗粒化材料的微观形貌特征.图2a为获得的纯壳聚糖球(R=0)的FETEM照片,其呈现出带孔隙的囊泡状结构,并紧密排列;图2b为获得的最佳配比CNFeOOH吸附剂的FETEM照片,该吸附剂呈现出清晰的纳米棒状结构,长约300 nm,直径约为50 nm,纳米结构有助于增加吸附剂的比表面积和活性位点数量,强化其吸附性能.
图3a为CNFeOOH的XRD图谱.由图3a可见,CNFeOOH 吸附剂在 26.725°、35.161°、39.219°、46.433°、55.901°和61.642°处出现了6个较明显的特征峰,与此对应的标准图谱的PDF卡片为34-1266,相对应的是针铁矿(β-FeOOH)晶体结构.图3b是CNFeOOH的选区电子衍射,由于CNFeOOH是条状,则出现的是同心圆的衍射环,且衍射环清晰,可判断该晶体为多晶衍射.根据Rd=Lλ的公式,求出选区电子衍射与XRD 6个峰相对应,各个衍射环所对应的d分别为0.142,0.154,0.175,0.215,0.247,0.330 nm.

图2 壳聚糖和CNFeOOH的场发射透射电镜图

图3 CNFeOOH吸附剂的XRD及SAED图
2.3 吸附动力学及其拟合
对动力学数据分别用拟一级和拟二级动力学方程进行拟合[9],结果见图4.由图4可见,在吸附反应进行的前5 h内速率很快,12 h时基本上达到吸附平衡.对数据进行拟合得到的吸附动力学参数见表2.通过比较相关系数R2可知,拟二级动力学方程对CNFeOOH对磷的吸附动力学的拟合效果更好,说明该吸附过程主要为化学吸附[10].

图4 不同磷初始浓度时吸附时间对CNFeOOH吸附的影响

表2 CNFeOOH吸附动力学拟合参数
为确定吸附过程的速率限制因素及扩散机制,采用Weber和Morris提出的颗粒内扩散方程来描述动力学的吸附机理,该方程表达式为
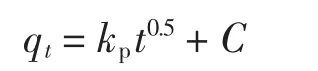
式中:qt为吸附反应在t时刻的吸附量,mg/g;C为截距,mg/g,与边界层厚度的影响成正比,即截距越大,边界层影响越大;kp为颗粒内扩散的过程中吸附快慢的速率常数[11],mg/(g·min0.5).
内扩散模型拟合结果如图5所示,拟合曲线均分为3部分,分别代表了吸附的3个过程,表层吸附、颗粒内扩散、吸附质与吸附位点相互作用.由图5可知:三个阶段的相关系数R2值均较高,两种浓度下的拟合曲线均未经过原点,且三个阶段的直线斜率由陡变缓,表明吸附过程中吸附速率也逐渐变得缓慢,因此,颗粒内扩散是限制吸附速率的主要步骤[12].同时,当溶液中吸附质的浓度增大,所对应的相同吸附时间段内CNFeOOH的吸附量越高,表明吸附反应过程中适当地增大磷的浓度,可以促进吸附反应的进行,即吸附速度会明显加快,并且吸附量也相应地提高.
2.4 吸附等温线与热力学拟合
CNFeOOH在不同温度下的等温线结果如图6所示.由图6可知:随着环境温度的升高,相应的吸附量逐渐增大.CNFeOOH对磷吸附的热力学性质通过计算吉布斯自由能(ΔG)、焓变(ΔH)、熵变(ΔS)和反应活化能(E)来评价,相关热力学参数见表3.

图5 内扩散模型拟合曲线

图6 不同温度下CNFeOOH对磷的吸附等温线
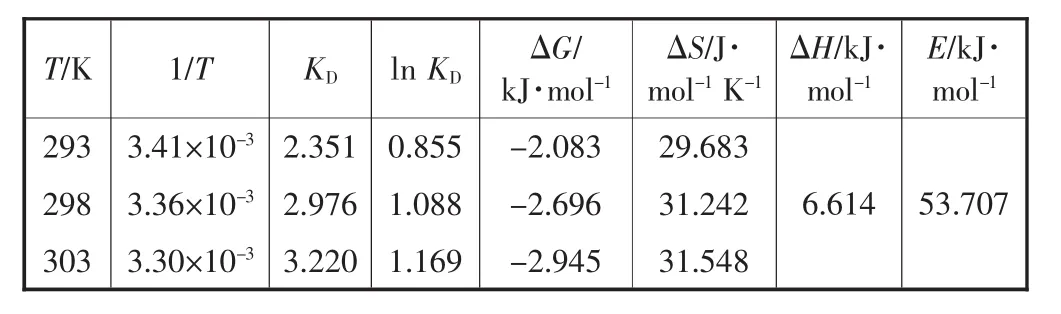
表3 CNFeOOH的热力学参数
图7为吸附过程的热力学拟合结果.根据图7a曲线拟合计算得到ΔH=6.614 kJ/mol>0,且在三个不同的温度下,ΔG的值在-2.945~-2.083 kJ/mol范围内,表明该吸附过程是吸热的、自发的,其相互作用为物理吸附;由图7b曲线拟合计算得到E为53.707 kJ/mol>42 kJ/mol,表明吸附过程中存在化学吸附[13].由此可以判断,CNFeOOH对磷的吸附过程是物理吸附和化学吸附结合,主要是化学吸附,且是吸热反应.
进一步对磷的吸附等温线用Freundlich方程和Langmuir方程进行拟合(T=30℃),结果如图8所示,所得的各项参数见表4.

图7 吸附过程的热力学拟合
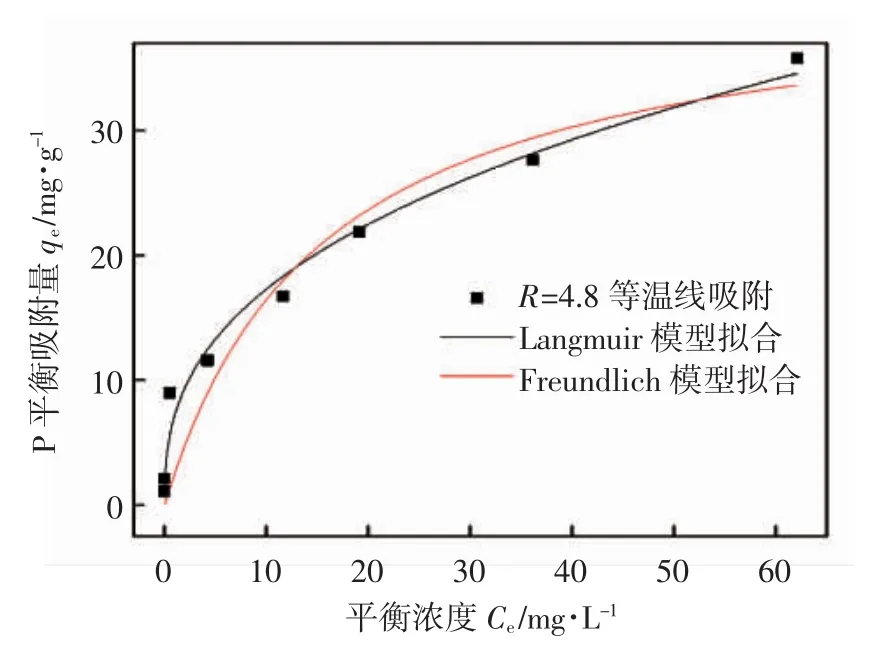
图8 CNFeOOH对磷的吸附等温线拟合
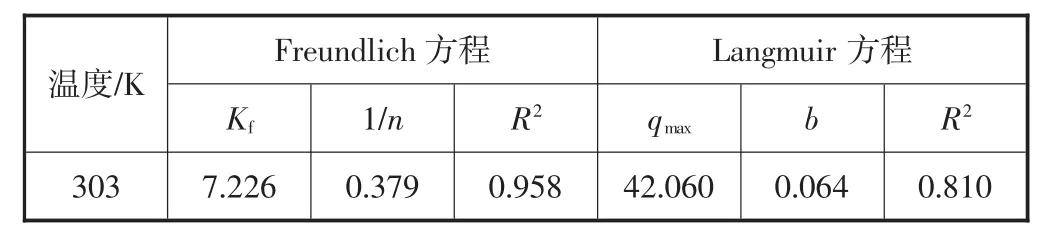
表4 Freundlich和Langmuir吸附等温线拟合结果
Freundlich方程拟合的相关系数R2为0.958,1/n为0.379<0.5,表明容易吸附;而Langmuir方程拟合的相关系数R2为0.810.可见CNFeOOH对磷的吸附等温特征由Freundlich方程描述更好,表明此过程主要为多分子层吸附[14].表5为其他相关除磷吸附材料与CNFeOOH的最大吸附量的对比,可见CNFeOOH材料的除磷效果明显优于其他材料,具有良好的用于水处理的潜力.

表5 不同除磷吸附材料的对比
2.5 共存离子的影响
天然水体中常见的离子有 CO32-、SiO32-、SO42-、Mg2+、Ca2+等,它们对CNFeOOH吸附除磷的影响如图9所示.
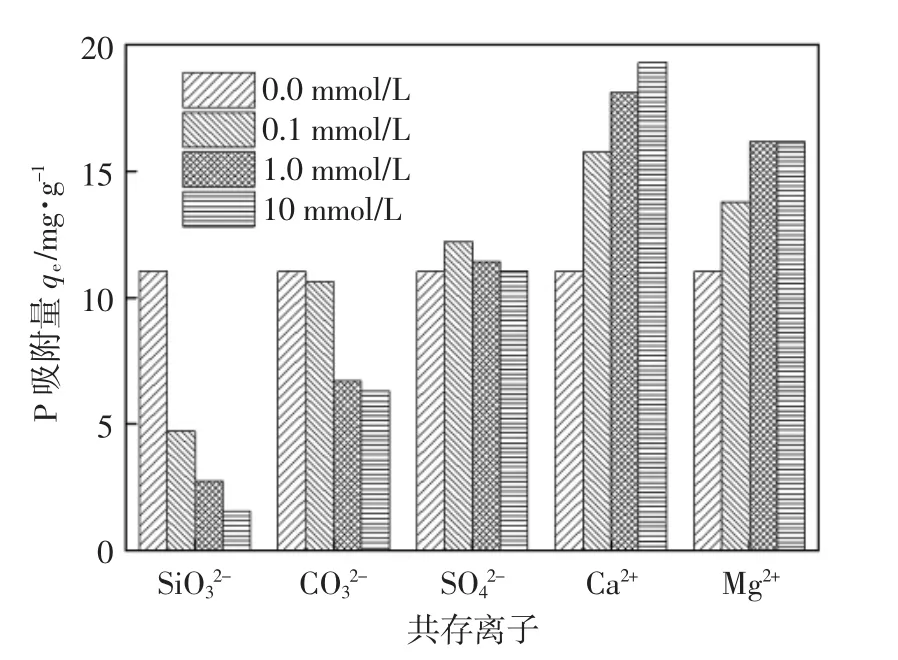
图9 共存离子对CNFeOOH吸附磷的影响
由图9可知:随着Mg2+、Ca2+离子浓度的增加,磷的吸附量由11.03 mg/g分别增加到16.15,19.30 mg/g,说明阳离子对吸附具有促进作用[20],这是因为Mg2+、Ca2+与PO43-之间产生共沉淀;当阴离子浓度从0 mmol/L增大到10 mmol/L时,SiO32-对磷的吸附抑制影响最为明显,磷的吸附量从11.03 mg/g降至1.58 mg/g;CO32-对吸附的影响较小,磷的吸附量从11.03 mg/g降至6.30 mg/g;而SO42-对磷的吸附几乎没有影响.3种阴离子对磷吸附效果的影响顺序为SiO32->CO32->SO42-.这是因为硅和磷在元素周期表中处于同一周期,且两个元素的位置关系是左右相邻,碳与硅在元素周期表中属于同一主族,与磷为下对角线,因此判断硅和碳的阴离子形态空间分布与磷酸根的很相似,因此,SiO32-、CO32-与磷酸根竞争活性吸附位点,从而导致磷的吸附量明显降低[21].
2.6 吸附剂的再生回用性能
为了有效评价CNFeOOH吸附材料的重复利用性能,解吸剂采用0.5 mol/L的NaOH溶液,循环4次,实验结果如图10所示.由图10a可知:0.25 g CNFeOOH吸附磷浓度分别为10,30 mg/L的溶液,经过4次再生后CNFeOOH对磷的吸附量均低于初始吸附量,降低率分别为27.43%和31.25%.图10b为循环4次的质量损失率.由图10b可知:经过4次再生后,CNFeOOH吸附材料的质量损失率均低于初始质量的10%,说明CNFeOOH有很好的回收性.

图10 CNFeOOH的脱附再生性能
3 结论
(1)pH=7 时,Fe(III)/壳聚糖单体的摩尔配比 R=4.8时获得的CNFeOOH吸附除磷性能最优,其BET比表面积为102.28 m2/g,机械强度为10.43 N,孔径为7.81 nm;CNFeOOH吸附剂中嵌入的纳米铁氧化物为β-FeOOH,化学稳定性好.
(2)CNFeOOH吸附剂对磷的最大吸附量为42.06 mg/g(pH=7.0± 0.1,温度 T=30℃),Freundlich方程能够更好地描述CNFeOOH对磷的吸附等温线(属多分子层吸附);拟二级动力学方程更适合描述CNFeOOH对磷的吸附动力学过程,CNFeOOH对磷的吸附过程主要为化学吸附,且反应过程是吸热反应.
(3)CNFeOOH吸附剂可以通过NaOH溶液再生后多次重复使用,回收性能良好.
