剑突下胸腔镜胸腺切除术的安全性和可行性研究
2020-05-09江文坛杨建胜林良安吴敬阳林贤宾
江文坛, 杨建胜, 林良安, 吴敬阳, 林贤宾
根据ChART数据库分析,22.8%的胸腺肿瘤患者存在重症肌无力(myasthenia gravis,MG)[1],而MG患者往往有胸腺肿瘤或胸腺增生异常。胸腺肿瘤根治需要完整切除肿瘤及周围的胸腺和脂肪组织,并进行彻底探查排除非连续但可切除的病变[2-3]。MG患者除了切除整个胸腺和周围脂肪组织外,还必须去除双侧心膈角脂肪组织以达到最佳效果。传统的胸腺切除手术路径是经正中胸骨途径,视野清晰但创伤大,且存在胸骨感染等严重的并发症。随着微创理念的深入及外科技术的进步,胸腔镜胸腺切除已在世界范围内广泛开展[4-7],主要方法为经右胸(或左胸)的肋间入路,近年来,剑突下入路才逐渐受到重视。针对剑突下胸腔镜胸腺切除术的可行性和安全性方面,笔者所在团队作了一些探索。现收集2014年1月-2018年9月实施剑突下胸腔镜胸腺切除术的患者27例,另收集经肋间胸腔镜胸腺切除术患者27例作为对照,回顾两组患者的临床资料,并进行分析和比较,报告如下。
1 对象与方法
1.1对象 剑突下胸腔镜胸腺切除术患者27例(剑突下组),男性7例,女性20例,年龄(46.04±14.78)岁(18~76岁),体质量指数(body mass index,BMI)(23.26±1.54)kg/m2(19.8~26.0 kg/m2)。术前被诊断为MG 10例,按MGFA分型,Ⅰ型4例,Ⅱa型3例,Ⅱb型2例,Ⅲa型1例。术后病理确诊为胸腺肿瘤21例,胸腺增生6例。21例胸腺肿瘤患者按照Masaoka分期,Ⅰ期14例,Ⅱ期3例,Ⅲ期4例,Ⅳ期0例;按WHO分型,A型6例,AB型4例,B1型4例,B2型4例,B3型2例,C型0例,混合型1例。入选标准:(1)患者术前诊断胸腺肿瘤、MG合并胸腺增生或胸腺肿瘤;(2)Masaoka分期处于Ⅰ~Ⅲ期的胸腺肿瘤患者;(3)既往无胸腔或者纵隔手术,无肺结核、胸膜炎病史,无严重胸廓畸形如漏斗胸、胸骨塌陷等;(4)患者完善常规术前检查和准备,术前需再次评估手术指征,排除手术相关禁忌证。排除标准:(1)肿瘤直径>5 cm或与周围脏器关系不清楚、广泛粘连的患者;(2)术中发现为肿瘤晚期,直接转开胸手术;(3)BMI>26.0 kg/m2。
另收集同期采用经肋间胸腔镜胸腺切除术的患者27例作为对照组(肋间组),男性12例,女性15例,年龄(47.78±13.67)岁(21~72岁);BMI(23.04±1.77)kg/m2(19.5~26.0 kg/m2)。本研究经医院伦理审查委员会批准,所有患者或委托人均签署知情同意书。
1.2手术方法
1.2.1剑突下组 患者取“人字”分腿仰卧位,下胸部垫高。全身麻醉,单腔气管插管。剑突下取约2.0 cm纵向切口作为腔镜孔(如有必要,可延长),双侧肋弓下作长约0.8 cm小切口作为操作孔。手术步骤:取剑突下纵向切口,切开皮肤、皮下组织、白线,钝性分离剑突后方的结缔组织至胸骨后形成胸骨后隧道。向左、右钝性分离近双侧锁骨中线肋弓下缘处,在手指引导下分别于双侧肋弓下作长约0.8 cm小切口,放置5 mm穿刺套管,拔除套管芯,剑突下切口放置10 mm穿刺套管,拔除套管芯,接气腹机建立人工气胸,压力控制在8~10 cmH2O(1 cmH2O=0.098 kPa),置入30°(10 mm)腔镜,右侧肋弓下套管置入抓钳,左侧肋弓下套管置入超声刀。使用超声刀分离胸骨后组织,往双侧纵隔胸膜分离并切开纵隔胸膜,沿胸骨后往上分离前纵隔组织,上至胸骨上切迹后方胸腺上极顶部,双侧达胸廓内静脉内侧约0.5 cm(如为胸腺肿瘤患者,术中需探查肿瘤情况,包膜是否完整,肿瘤是否转移或侵犯纵隔胸膜及肺组织,以便决定是否继续微创手术或中转开胸等)。于心包中下部、膈神经前方约5 mm,紧贴心包往上分离前纵隔组织,分离至无名静脉时应注意胸腺静脉游离和切断,无名静脉上、下方如有淋巴结,应予清扫,游离胸腺上极组织时,应将气管前及颈总动脉前脂肪组织一并清除,完整切除胸腺组织。MG患者还需切除双侧心膈角脂肪组织。将切除的胸腺组织、淋巴结、心膈角脂肪组织等置入标本袋中取出,并送病理检查。充分止血后,经双侧肋弓下切口分别置入负压引流管于双侧胸腔,并接负压球(图1)。术后处理:所有患者在术后第1天接受胸部X线片检查,如果双肺充气良好,胸腔无明显积液,胸腔引流量<100 mL/d,则拔除胸腔引流管。
1.2.2肋间组(以经右胸肋间为例) 麻醉后单腔气管插管,患者取右侧垫高30°~40°卧位,以右侧第6肋间腋中线处切口长1.5 cm作镜孔,置入10 mm穿刺套管并接气腹机建立人工气胸,压力控制在8~10 cmH2O,置入30°胸腔镜,右侧腋前线第3肋间和第6肋间分别做0.8 cm切口为操作孔,置入5 mm穿刺套管,经操作孔分别置入抓钳和超声刀。探查前纵隔及肿物情况,然后按从胸腺下极往胸腺上极、从右侧到左侧的顺序,使用超声刀分离并切除胸腺组织,随后切除心膈角脂肪组织。手术完毕将标本置入标本袋后取出,视标本大小酌情延长操作孔切口。充分止血后,于右侧腋中线第6肋间放置引流管并接水封瓶。术后处理同剑突下组。
1.3评价指标 收集患者的临床资料,包括性别、年龄、BMI、MG病史、肿瘤直径、切口长度、手术时间、术中出血量、术中麻醉情况、术后胸腔积液量、术后胸管留置时间、术后住院时间、术后(24,48及72 h)疼痛评分、术后WHO分型、Masaoka分期、并发症。术后疼痛采用疼痛视觉模拟评分(visual analogue scale,VAS),≥5分者必要时给予止痛药。

2 结 果
两组在性别、MG例数、胸腺肿瘤及Masaoka分期等方面比较,差别无统计学意义(表1)。两组在手术时间、术中出血量、术后胸液量、胸管留置时间等方面比较,差别也无统计学意义。剑突下组术后住院时间为(4.22±1.99)d,明显少于肋间组的(7.44±2.12)d,两组间差别有统计学意义(P<0.05,表2)。剑突下组术后24,48,72 h的VAS明显低于肋间组,分别为(2.52±0.85),(1.74±0.81),(1.33±0.73)分和(3.74±1.97),(2.63±1.80),(2.00±1.57)分,两组间各时间点比较差别均有统计学意义(P<0.05,表3)。剑突下组围术期并发症发生率低于肋间组,分别为7.4%和18.5%,但差别无统计学意义(P>0.05,表3)。

表1 两组患者基本资料比较
n=27. MG:重症肌无力.
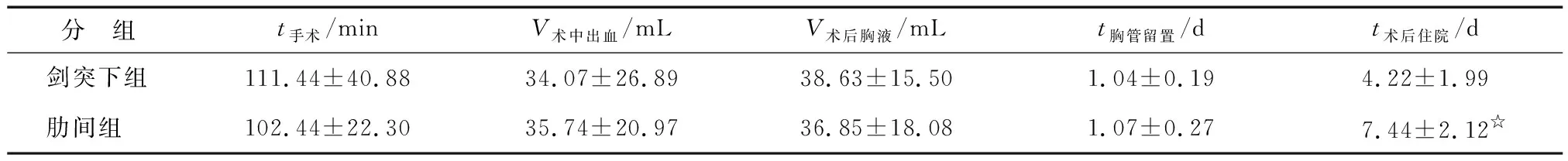
表2 两组患者手术相关指标比较
n=27. 与剑突下组比较,☆:P<0.05.

表3 两组患者术后疼痛VAS评分及围术期并发症比较
n=27. 并发症数据为n. 与剑突下组比较,☆:P<0.05.
3 讨 论
胸腺切除术在治疗胸腺肿瘤和MG中起重要作用。目前临床上针对胸腺疾病的胸腔镜微创手术基本上采用经右胸(或左胸)的肋间路径,其缺陷在于:对侧前纵隔区域显露较差,术中往往难以见到对侧膈神经,同时对于胸腺上极区域的显露也明显不足,存在治疗不彻底的可能。此外,经肋间途径容易损伤肋间神经和肋间呼吸肌,患者术后疼痛相对明显,不利于术后早期的呼吸锻炼。剑突下胸腔镜胸腺切除是近年来逐渐兴起的手术方式,虽然Hsu在2002年就曾提过剑突下胸腔镜前纵隔肿瘤切除具有独特的手术视野优势[8],但当时少有医生尝试。2014年以来,国内外多位专家再次认识到剑突下入路的重要性,并探索了经剑突下胸腔镜胸腺切除手术的临床应用,取得一定的疗效,尤其是疼痛减轻方面[9-13]。
本研究结果显示,与经肋间胸腔镜手术相比,剑突下胸腔镜胸腺切除术可以减少术后疼痛,缩短术后住院时间,且不增加围术期并发症发生率,同时能更好地显露前纵隔区域,包括双侧膈神经前方的脂肪组织及心膈角脂肪组织,手术切除更彻底。笔者团队的手术经验如下:(1)体位:取“人字”分腿仰卧位,适当垫高后背,主刀站立于患者双下肢中间,操作会方便些;(2)距离剑突下方1 cm左右行纵行切口,与双侧肋弓下切口构成三角形,顶部角度越大越好操作,顶部角度如果<60°,容易导致手术器械互相干扰,给操作带来较大困难,如果患者双侧肋弓夹角较小,尤其<60°者,不宜行剑突下入路手术;(3)剑突下的切口最好沿白线切开,勿切断腹直肌,建立胸骨后隧道很关键,双侧肋弓下的切口置入5 mm穿刺套管时可在手指引导下进行;(4)排气:可使用带排气孔的穿刺套管置入排气管道,或经胸骨旁穿刺置入中心静脉导管接吸引器,必要时去除烟雾以保证视野清晰;(5)操作时,左手持抓钳分离,右手使用超声刀操作,在处理胸腺静脉等细小血管时可使用超声刀直接切断;(6)注意显露双侧膈神经,避免误伤,切除左上纵隔脂肪组织时注意别误伤左侧迷走神经,部分患者左迷走神经紧挨着膈神经;(7)一般先行胸腺切除,后切除双侧心膈角脂肪组织,分步骤手术比较容易。
综上所述,剑突下入路胸腔镜胸腺切除术安全、可行,具有疼痛轻、恢复快等优点,是治疗胸腺肿瘤和MG较为完美的手术方法,适合推广。由于本次研究患者例数偏少,研究时间亦偏短,尚需积累更多患者,中远期疗效有待进一步随访证实。
