母猪接种PCV-2灭活疫苗可降低所产仔猪的PCV-2感染率和病毒血症发病率
2020-05-08刘国民摘译自2012年10月
刘国民 摘译自,2012年10月
宋庆庆,林文耀* 校 靳文广 审 罗静如 制表
猪圆环病毒2 型(Porcine Circovirus type 2,PCV-2)是一种无包膜的单链环状DNA病毒,与PCV-1同属于环病毒科,对全球猪群有很高的致病性。PCV-2分为多个基因型,其中PCV-2b 是猪群感染的PCV-2中的主要基因型。
PCV-2会导致猪群发生一系列临床疾病,人们称之为PCV相关病(PCV-associated Diseases,PCVAD)。在临床上,PCVAD可能表现为仔猪断奶后多系统衰竭综合征、呼吸道疾病、肠道疾病和母猪繁殖障碍,少数病猪还会发生猪皮炎肾病综合征。PCV-2无处不在的特性归功于它的传播途径多样化,如它可通过口鼻、粪便、精液、胎盘以及初乳等途径传播。给生长猪接种PCV-2疫苗可以有效降低PCVAD的发病率和严重程度。
近来,人们将精力放在通过对繁殖母猪接种PCV-2疫苗来预防生长猪发生PCV-2上。业已证明,母猪感染PCV-2后可以产生病毒血症,并且会感染子宫中的胎儿。有趣的是,在发生病毒血症期间,母猪仍能产下大量的仔猪,且所产仔猪似乎很健康。最近,美国的科研人员对5个商用繁殖母猪群进行了一项田间调查,以研究PCV-2的垂直传播情况。结果发现PCV-2 DNA在母猪群中的总体流行率为69.5%(89/128),在仔猪群中的流行率为44.8%(226/504)。另一个研究小组发现三家猪场的新生仔猪发生PCV-2病毒血症的比例介于58%~90%。
本研究旨在确定先前母猪群和仔猪群暴发的高比例PCV-2病毒血症是否也在2011年美国艾奥瓦州的繁殖猪场中发生,以及探讨母猪接种PCV-2灭活疫苗是否会影响PCV-2的垂直传播。
1 材料与方法
1.1 猪场
猪场1是一家多点式从繁殖到断奶的猪场,有将近2 400头繁殖母猪。母猪采用人工授精的方式配种,精液由美国艾奥瓦州的一家种猪场提供。猪场2是一家独立的繁殖场,有将近2 700头繁殖母猪,母猪采用与猪场1相同的配种方式。两家猪场的所有母猪都在分娩前接种大肠杆菌(Escherichia Coli)疫苗。所有繁殖母猪在断奶时按照常规免疫方案接种可预防猪细小病毒病、细螺旋体病和猪丹毒的疫苗,猪场2的母猪还接种猪流感疫苗。尽管经血清学检测两家猪场的繁殖母猪为猪繁殖与呼吸综合征病毒(Porcine Reproductive and Respiratory Syndrome Virus,PRRSV)阳性,但我们仍认为这些母猪群在PRRSV的流行上处于稳定状态,它们能够生产出PRRSV-RNA阴性的仔猪。引进的母猪或者猪场一直饲养的母猪未接种PCV-2灭活疫苗。
1.2 实验设计、疫苗接种方案、样本选择方式和母猪的繁殖参数
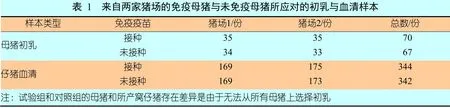
每家猪场选择约100头同步发情的母猪,按胎次(1胎~10胎)随机平均分入需接种疫苗的试验组(组内的母猪简称“免疫母猪”,50头)和不需接种疫苗的对照组(组内的母猪简称“未免疫母猪”,50头)。每组的初乳样本只从35头母猪上采集,其余15头为备用母猪,以确保在研究小组到达猪场时所选母猪中有35头同时分娩,从而可以防止因母猪怀孕失败或预产期不正确或分娩时未助产而出现分娩母猪数量不足的情况。一旦35窝仔猪的样本采集到位,采样工作立即停止,其余母猪不再采样和收集数据。
母猪断奶时,在试验组母猪颈部右侧肌肉接种2 mL Suvaxyn PCV 疫苗(美国富道动物保健有限公司生产);18 d后于相同部位进行一次加强免疫,剂量为1 mL。所有母猪都于断奶后第一次发情时进行人工授精。
在母猪分娩时,从每组中随机选择35头母猪,收集它们的初乳样本,再从每窝仔猪中随机选择5头临床健康的仔猪采集血液样本。根据仔猪血清中IgG的总光学密度(Optical Density,OD)的评估值,我们可以断定猪场1 和猪场2 的仔猪血液样本分别是在仔猪吮吸初乳之后和之前采集。
猪场1 的试验仔猪由场内工人选择,再负责将它们带入不同的房间交给研究小组的成员采集血液样本。血液样本通过仔猪的脐带或颈静脉采集。为了避免仔猪之间发生交叉污染,同时避免在采集血液样本和初乳样本的过程中样本受到环境的污染,每采集一头仔猪的样本后更换一副手套,软管的打开、关闭和储存由未捕捉过仔猪的工作人员执行。猪场2 的试验仔猪的选择和血液样本采集由研究小组的成员进行。最终的样本数见表1。所有的样本都用血清学方法检测是否含有PCV-2IgG,并用实时定量PCR检测是否存在PCV-2DNA及确定其数量和亚型。
1.3 血清学检测
所有血液样本和初乳样本都用之前介绍的基于ORF-2的ELISA检测PCV-2抗体。一个样本的样本转阳性(Sample-to-Positive,S/P)值不低于0.2即判定为阳性。猪场1的样本还用SERELISA PCV-2 ab Mono Blocking ELISA 试剂盒检测。
所有的仔猪血液样本还用猪体内总IgG ELISA进行检测。简单来说,用溶于PBS的0.5 µg/mL羊抗猪IgG(Fc)抗体包被微量滴定板,并在室温下孵育过夜。在用含有0.05%吐温20的PBS洗板3次后,用1%的牛血清蛋白在室温下封闭2h。该血清样本用添加了牛血清蛋白的PBS按1∶100稀释,滴在平板上后再在37℃下孵育45h。洗板后,将按1∶40 000稀释的过氧化物酶共轭山羊抗猪IgG加入孔中,37℃下孵育30 min。再次洗板后,将四甲联苯胺氢过氧化显色底物加入每个孔中,在室温下放置15min后,再在每个孔中加入50μL的0.25M硫酸终止反应,随后用分光光度计测定450 nm处的吸光度值。已哺乳的或哺乳前的仔猪血清作为分析对照。比较两家猪场的仔猪血清的平均OD值。
1.4 PCV-2实时荧光定量PCR
在7500快速实时PCR系统中,用针对PCV-2ORF1的引物和探针检测PCV-2DNA。在25μL反应体系中加入2.5μL的DNA,反应程序为:50℃20min,95℃10min,95℃15s(40个循环),60℃1min(40个循环)。样本的循环阈值(Cycle Threshold,CT)大于40 判定为阴性。
1.5 PCV-2a/b多重PCR
利用可定向分析PCV-2ORF2中模式序列的多重实时荧光定量PCR鉴别检测PCV-2a和PCV-2b。25μL反应体系包括:12.5μL的混合液(master mix),0.5 μL DNA,引物各0.4 μM,探针各0.2 μM。反应程序为:50℃20 min,95℃10 min,95℃15 s(40个循环),60℃ 1 min(40个循环)。样本的CT值大于40判定为阴性。
1.6 数据分析
试验数据用JMP V.9.0.0软件和SAS V.9.2软件分析,P值小于0.05即认为在统计学上有显著差异。ELISA的S/P比值用“猪场”、“胎次”和“猪场与母猪接种状态的互作”建立的线性混合模型分析。接种状态与按胎次和猪场分级的PCV-2流行率之间的联系用CMH检验评估,各猪场的血清学结果用配对t检验分析。两组间的发病率差异通过费歇尔确切检验(Fisher's exact test)计算。
2 结果
2.1 窝生产性能
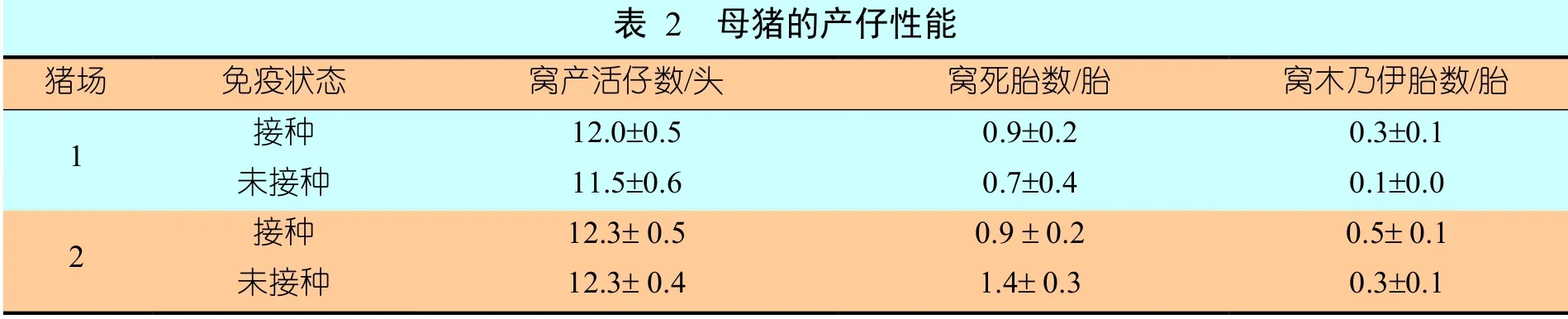
在猪场1 所选的仔猪窝中,平均窝产活仔数(用“平均值±标准差”表示,下同)为“12.2头±0.3头”,窝平均死胎数为“1.2胎±0.2胎”,窝平均木乃伊胎数为“0.4胎±0.2胎”。猪场2的平均窝产活仔数为“11.8头±0.4头”,窝平均死胎数为“0.8胎±0.2胎”,窝平均木乃伊胎数为“0.2胎±0.1胎”。试验组和对照组在统计学上无显著差异(表2)。
2.2 血清中的总lgG水平
猪场1 的仔猪血清IgG的OD值与从哺乳后的仔猪上采集的样本测得的结果相接近,而猪场2的仔猪血清IgG的OD值与从哺乳前的仔猪上采集的样本测得的结果相接近。猪场1仔猪血清的IgG的OD值显著高于猪场2仔猪的(P<0.000 1)。
2.3 抗PCV-2lgG抗体的流行率与ELISAS/P平均值
所有免疫母猪和97%的未免疫母猪分泌的初乳都检测到了PCV-2IgG抗体,免疫母猪的平均S/P值显著高于未免疫母猪的(P=0.0039)。PCV抗体阳性的母猪在发病率上无统计学上的显著差异。各猪场免疫母猪和未免疫母猪的检测结果见表3。
对两家猪场的免疫母猪和未免疫母猪所产仔猪的血液样本检测后发现,PCV-2 IgG抗体阳性的样本比例分别为44.5%和43.4%。猪场1 的免疫母猪所产仔猪的血液IgG 抗体水平显著高于未免疫母猪所产仔猪的。猪场1 血清阳性的仔猪比例高达88.1%,猪场2 的这一比例仅为1.1%。猪场1 免疫母猪所产仔猪的PCV-2 IgG 抗体水平显著高于未免疫母猪所产仔猪的。
2.4 PCV-2 DNA 检测率
表3 列出了按接种方式和猪场汇总的母猪初乳中PCV-2 DNA 的检测结果:猪场1 未免疫母猪初乳样本的PCV-2 DNA检测率为5.9%,未从猪场1 免疫母猪的初乳样本以及猪场2 未免疫母猪的初乳中检测到PCV-2 DNA。
综合猪场1 和猪场2 的检测结果发现,14.9%的未免疫母猪所产仔猪的血清样本和8.4%的免疫母猪所产仔猪的血清样本含有PCV-2 DNA,未免疫母猪所产仔猪血清样本的PCV-2 DNA检测率显著高于免疫母猪所产仔猪的。在PCV-2 阳性样本中,28 个样本只检测到了PCV-2a,28 个样本只检测到了PCV-2b,5个样本同时检测到了PCV-2a 和PCV-2b,另外19个样本未能确定所检测到的PCV-2的血清亚型。在猪场1,免疫母猪所产仔猪血清样本的PCV-2 DNA 检测率显著低于未免疫母猪所产仔猪的(P<0.001)(表3)。
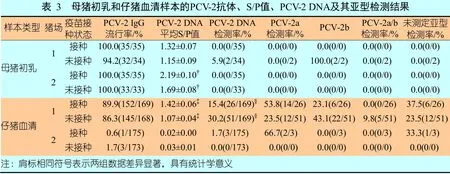

表4列出了不同猪场母猪所产窝中PCV-2 DNA 阳性仔猪的分布情况。在未免疫母猪所产窝中,至少有1~3头仔猪呈PCV-2 DNA 阳性的窝数显著高于免疫母猪所产窝的(P=0.036)。在单家猪场中,如猪场1,如果仔猪由免疫母猪生产,无PCV-2 DNA 阳性仔猪的窝比例极高(P<0.01);相反,如果仔猪由免疫母猪生产,有2~3头仔猪为PCV-2 DNA阳性的窝所占比例较低(P<0.05)。
3 讨论
本研究中,两家猪场的新生仔猪血清样本的PCV-2抗体阳性率为43.9%。在感染PCV-2后,大多数母猪会在妊娠第70天后出现高水平的PCV-2垂直传播率。Lai等和Vandeputte等证明,新生仔猪从初乳获得的抗体可在摄入初乳后2h内检测到,并且抗体水平可在摄入初乳后9h~24h达到峰值。在猪场1,母猪接种PCV-2灭活疫苗会显著影响所产仔猪的PCV-2IgG的S/P值。
PCV-2DNA阳性仔猪的分布率为11.7%。猪场1的仔猪血清样本在哺乳后采集,检测发现免疫母猪所产仔猪的病毒血症发病率显著低于未免疫母猪所产仔猪的,窝中仔猪的PCV-2DNA阳性发生率也呈现出类似的情况。有趣的是本研究检测到的PCV-2a阳性血清样本数和PCV-2b阳性血清样本数相接近,这与Shen等对499个来自哺乳前仔猪的血清样本检测后发现较多样本呈PCV-2b阳性的结果相悖,可能是由于本研究对一部分母猪接种PCV-2灭活疫苗会干扰PCV-2亚型特异性病毒复制。业已证明母猪在妊娠早期和中期感染PCV-2后会导致个别母猪发生繁殖障碍。但是,PCV-2在繁殖母猪群中的流行对仔猪和生长猪的影响可能大于对母猪的影响。Opriessnig等指出,当PCV-2的亚临床感染仔猪与敏感仔猪和生长猪混群时,PCVAD高发病率通常出现在仔猪的母源抗体开始衰退后。
尽管猪场给生长猪接种PCV-2疫苗目前已经很普遍,并且带来PCVAD的发病率下降,但是众多迹象表明接种PCV-2疫苗并不能完全有效地预防猪感染PCV-2。Ci-Ozuna等在多篇研究论文中报道了发生在美国堪萨斯和内布拉斯加州的与PCV-2相关的严重急性肺炎和肺水肿病例。2009年末,出现在加拿大的PCV-2重组病毒还引起了人们对PCV-2疫苗安全性的担忧。业已证明给母猪接种PCV-2疫苗无法彻底预防PCV-2通过精液或实验性攻毒引起的母猪子宫内感染,本研究的结果证实了先前的发现,即母猪接种PCV-2灭活疫苗后很可能会通过防止子宫内感染从而减少患病毒血症的仔猪的数量,或通过初乳降低出生不久感染PCV-2的仔猪的数量。
在实验条件下,给母猪接种商用PCV-2灭活疫苗可以提高其所分泌的初乳中抗PCV-2的IgG水平。同时,母猪接种PCV-2灭活疫苗可以显著减少出现病毒血症的仔猪数,并可降低有PCV-2 病毒血症仔猪的窝发生率。
