食用索马甜对小鼠血糖及血脂的影响
2020-05-08姜少磊刘兵峰刘钟栋
姜少磊,刘兵峰,刘钟栋,*
(1.河南工业大学粮油食品学院,河南郑州 450001;2.中国科学院深圳先进技术研究院,广东深圳 518055)
当下人民生活水平足以满足随时食用高糖食物需求,而过量摄入糖会直接带来情感障碍、药物滥用、肥胖、糖尿病和代谢综合症等健康问题[1]。如何能在人们享受甜味的同时保持能量摄入平衡,成为亟待解决的问题。因此,寻求合适的代糖产品便成为食品工业领域新的挑战。
2014年我国正式批准新型天然高倍甜味剂索马甜作为食品添加剂使用,为代糖食品以及功能性食品的开发与生产提供了新的机遇。索马甜是从热带植物非洲竹芋中提取出的甜味蛋白质,甜度最高可达蔗糖的10000倍,可以改善和增强食品风味,掩盖苦味和涩感[2]。索马甜平均分子量为22 kDa,等电点为12,对酸性环境和碱性环境均有良好的适应性,在pH2.5~9内可以保持性质稳定,75 ℃以下持续加热或100 ℃瞬时加热不影响其甜味[3],适用于饮料、牛奶制品、果酱、果胶、糖果、冰激凌、调味品和食品增补剂,以及基于微生物和矿物质的膳食补充饮品或咀嚼片等。索马甜甜味爽口、无异味、持续时间长,水解产物为18种人体所需氨基酸[4],经过毒理学验证,发现其无过敏、致死和致突变风险[5]。目前对于索马甜分子结构的解析以及其与甜味受体结合点的研究已经取得一定进展[6],但关于摄入含索马甜食物对机体代谢的研究存在空白。尤其是作为代糖产品,其在血糖、血脂代谢异常等由于长期食用高糖食品而引发的关键健康问题上缺乏研究数据,无法于健康饮食层面提供有力的科学依据,食用索马甜对糖、脂代谢的影响将牵动着消费者和特殊需求人群的敏感神经,决定着其在代糖产品以及功能性食品中能否得到进一步应用。
本文主要对持续四周食用索马甜较之蔗糖对小鼠的血糖、血脂相关生理特征的影响进行研究,以期为食品工业生产中直观表现索马甜代糖产品的核心优势提供科学依据,促进索马甜的开发与应用,促进食品工业的进一步发展。
1 材料与方法
1.1 材料与仪器
小鼠 平均体重为(16.05±0.75) g的成年8周龄C57BL/6J雄性小鼠90只,购买于北京维通利华实验动物技术有限公司,所有动物相关实验均获得中国科学院深圳先进技术研究院实验动物管理和使用委员会伦理审查(IACUC编:SIAT-IRB-171205-NS-ZYJ-A0387),且所有实验操作均符合实验动物福利伦理审查指南;正常饲料、25%蔗糖饲料、0.005%的索马甜饲料 睿迪生物科技有限公司,三种饲料热量组成均为:蛋白质15%,碳水化合物76%,脂质9%,饲料配比中筛选出索马甜与蔗糖的甜度最佳比例为1∶5000,采用此比例配制饲料;戊巴比妥钠 武汉东康源科技有限公司;4%多聚甲醛 阿拉丁试剂(上海)有限公司;20 x 磷酸缓冲溶液、50%葡萄糖溶液 生工生物工程(上海)股份有限公司;24孔板 康宁公司;Triton(分析纯)、蔗糖(分析纯)、牛血清白蛋白 西格玛奥德里奇(上海)贸易有限公司;一抗 c-Fos(9F6)Rabbit mAb Alexa Fluor 488-conjugated Cell Signaling Technology;二抗AffiniPure Fab Fragment Goat Anti-Rabbit lgG(H+L) Jackson Immuno Reseach Laboratories;一次性采血针、一次性采血管 佳康医疗器械有限公司;1 mL注射器 上海聚民生物科技有限公司;12 mm灌胃针 北京中科慧达科技有限公司;ELISA试剂盒 上海酶联生物科技有限公司。
Lecia CM195冰冻切片机 徕卡显微系统贸易有限公司;Leica TCS SP5玻片扫描仪 徕卡显微系统贸易有限公司;PS-390电子计时器 追日科技有限公司;infinite 200PRO光吸收微孔板检测仪 帝肯贸易有限公司;强生稳豪倍易型血糖仪 强生公司;HYC-940医用冷藏柜 海尔集团;5424R高速冷冻离心机 德国艾本德公司。
1.2 实验方法
1.2.1 小鼠取食偏好测试 15只C57BL/6J雄性小鼠每5只一笼饲养于恒温(23 ℃)、12 h明暗交替(07:00灯亮,19:00灯灭)SPF级动物房。基础饲料喂养l周后,将小鼠随机分为对照组、高糖组,索马甜组,每组5只。每组实验重复三组。使用双食盒间断喂养策略,各组小鼠1号食盒全天供应正常饲料,四周内每日于饲养间照明关闭时(19:00)分别于各鼠笼2号食盒添加相应的正常饲料、高糖饲料、索马甜饲料,同时各组仍然保留1号食盒内正常饲料。各组小鼠自由取食两个食盒内的饲料,并于2号食盒添加甜味饲料后2 h后测量各组小鼠对其鼠笼内两种饲料的取食量,同时取出相应的2号食盒内的额外添加饲料,保留1号食盒内的正常饲料。记录每日小鼠在提供两种饲料期间对各种饲料的取食量,以2 h内小鼠对2号食盒内饲料的取食量占此2 h期间两个食盒总食物消耗量的比例来表示小鼠对普通饲料、高糖饲料、索马甜饲料的偏好程度[7],即偏好程度计算为式(1):
偏好程度(%)=2号食盒食物消耗量(g)/(1号食盒食物消耗量(g)+2号食盒食物消耗量(g))×100
式(1)
1.2.2 免疫荧光染色 双食盒策略喂养四周后,在实验的最后一天,小鼠自由取食鼠笼内两种饲料2 h后(21:00),处死全部小鼠,取脑组织,进行免疫荧光染色。实验重复三组。具体操作过程为:用戊巴比妥钠(50 mg/kg)对小鼠进行深度麻醉,依次灌注生理盐水和4%多聚甲醛。取出大脑组织,并在4%多聚甲醛中固定过夜。随后将大脑置于30%蔗糖溶液中脱水,待大脑沉至底部后,使用冰冻切片机进行切片,脑片厚度为50 mm。将脑片置于24孔板,每孔6~8片。使用封闭液(5%牛血清,0.3% Triton)封闭脑片2 h。随后弃去封闭液,加入1∶1000浓度的一抗,置于4 ℃摇床过夜。过夜后使用0.3% PBST(1x PBS配制的0.3%浓度的Triton溶液)置于摇床洗三组,每次10 min,然后每孔加入300 μL 1∶200的二抗。室温摇床,避光2 h。2 h后,弃去二抗,以0.3% PBST洗三组。然后按脑片前后顺序将其贴放于载玻片,加带4,6-联脒基-2-苯基吲哚(DAPI)封片液封片[8]。使用玻片扫描仪成像。
1.2.3 日粮消耗与体重监测 另15只C57BL/6J雄性小鼠每5只一笼饲养于恒温(23 ℃)、12 h明暗交替(07:00灯亮,19:00灯灭)SPF级动物房。基础饲料喂养l周后,将小鼠随机分为对照组、高糖组,索马甜组,每组5只。整个实验重复三组。基础饲料喂养l周,测量每只小鼠的体重。将所有小鼠随机分为正常对照组、高糖组,索马甜组,每组15只。使用单食盒,三组小鼠全天分别只供应普通饲料、高糖饲料,连续四周。每天20:00记录各组小鼠日粮消耗及体重,计算各周小鼠平均日粮消耗和平均体重,在实验结束时测量小鼠体重,并计算各组小鼠四周总体平均日粮消耗。
1.2.4 血糖值的测定 为上述1.2.3中的小鼠持续供应四周正常饲料、高糖饲料、索马甜饲料后,在实验的最后一天,记录完小鼠的日粮消耗和体重后,对小鼠禁食12 h,于次日上午8:00于尾部末端约3 mm处剪尾,进行尾静脉取血,使用血糖测试仪测定空腹血糖值,实验重复三组。随后给予50%葡萄糖溶液灌胃(2 g/kg),分别在灌胃后0、5、10、15、30、60、90、120 min 7个时间点,使用血糖测试仪测定每只小鼠的血糖值[9]。
1.2.5 血清生化指标的测定 血糖测试结束后,恢复上述1.2.4中各组小鼠对应的饲料供应,在血糖测试结束后的第三日20:00,对小鼠禁食12 h,于次日8:00进行眼眶静脉丛取血。使用一次性采血管采取血液样品约200 μL,样品置于4 ℃医用冷藏柜静置20 min,随后用高速冷冻离心机于4 ℃条件下以4500 r/min离心15 min,取上层血清备用。使用酶联免疫吸附法(ELISA)测定小鼠血清胰岛素,血清总胆固醇(TC)和甘油三酯(TG)。根据血糖和血清胰岛素的数值分别计算稳态模型胰岛素抵抗指数(HOMA-IR)[10],实验重复三组。
1.3 数据处理
实验数据以X±SEM表示,使用MATLAB程序对脑组织进行荧光计数使用ImageJ 1.51软件处理图像。使用GraphPad Prism 7软件作图,使用SPSS 22.0软件进行数据分析,以P<0.05为有统计学意义。
2 结果与分析
2.1 小鼠取食偏好与奖赏效应
小鼠取食偏好结果见图1,在取食偏好测试实验中,小鼠在2 h内对二号食盒内的高糖饲料和索马甜饲料的取食量占该时间段内食物消耗总量的比例均达到99%以上,而对照组小鼠在此期间对其鼠笼内2号食盒内普通饲料的取食占比仅为36%,说明与普通饲料相比小鼠对此两种甜味饲料均有极显著(P<0.01)的取食偏好。小鼠的甜味感知系统与与人类相似,碳水化合物和无热量甜味剂均作用于异二聚体1型味觉受体2(T1R2)和1型味觉受体3(T1R3)从而引发甜味觉[11]。这一受体家族存在数量众多的结合位点,各种结构不同的甜味物质以不同的方式结合甜味受体,引起在味觉感受上的差异,这可能导致摄入不同甜味物质引发奖赏效应的不同。而小鼠对于索马甜饲料的偏好程度说明索马甜蛋白可能引起与蔗糖同样愉悦感。进食甜味物质,在神经细胞受到刺激后,c-fos基因会在15 min内迅速而短暂地诱发,同时由于c-fos常在神经元激发动作电位时表达,因此,c-fos的表达常被看作是神经元活动的间接标志[12]。以c-fos基因的表达来间接反映在食用不同饲料后小鼠大脑内神经细胞的活跃程度,以评价不同甜味剂带来的奖赏效应的强度。

图1 小鼠对不同甜味饲料的取食偏好

图2 不同甜味饲料引起的VTA脑区c-fos基因表达的扫描图
图3与图4显示了免疫荧光染色的结果,在与奖赏效应相关的的中脑腹侧被盖区[13-15],在取食高糖饲料时,中脑腹侧被盖区平均有124±12个神经细胞被激活,而取食索马甜饲料时该脑区平均有116±8个神经细胞被激活,高糖组和索马甜组小鼠的激活的细胞数量没有统计学差异,而对照组小鼠在进食普通饲料时该脑区仅有54±6个神经细胞被激活,提示在进食普通饲料时对照组小鼠负责奖赏效应的中脑腹侧被盖区的活跃程度显著低于高糖组和索马甜组(P<0.01),而索马甜组小鼠与蔗糖组小鼠的免疫荧光染色结果显示索马甜可以引起与蔗糖相同的奖赏效应。小鼠的取食偏好与中脑腹侧被盖区活跃程度可以说明小鼠对索马甜饲料存在强烈的喜好,并且摄食索马甜饲料可以带来与食用高糖饲料相同的奖赏效应。

图3 不同饲料引起的VTA脑区细胞激活数量

图4 各组小鼠平均每周日粮消耗量
2.2 小鼠取食量与体重
图4反映了小鼠在第一周的适应阶段日粮消耗量与为期4周的实验阶段每周平均日粮消耗量,图5反映了小鼠四周的实验阶段总体平均日粮消耗。在第1周小鼠的适应期内,各组小鼠均以普通饲料饲喂,对照组、高糖组、索马甜组的日均取食量分别为(16.06±0.28)、(15.98±0.56)、(16.12±0.48) g,相互之间没有显著差异。在为期四周的实验阶段,索马甜组小鼠日均取食量为(16.39±0.21) g,对照组平均日粮消耗(16.06±0.69) g,两组之间无显著差异。而高糖组小鼠日均取食高糖饲料(17.17±0.47) g,显著高于对照组和索马甜组(P<0.05)。各组定制饲料单位重量能量相同,四周内高糖组小鼠平均每日能量摄入比对照组高6.9%,比索马甜组小鼠日均能量摄入高4.7%。图6显示了小鼠的体重变化,在分组阶段,即第一周适应期开始阶段,对照组、高糖组、索马甜组小鼠体重分别为(18.86±0.65)、(18.58±0.59)、(18.45±0.62) g,各组间无统计学差异。在适应期结束后,即以不同饲料喂养开始阶段,三组小鼠体重分别为(20.82±0.62)、(20.53±0.74)、(20.68±0.68) g,各组间无统计学差异。随后以不同饲料喂养四周,实验结束时,三组小鼠体重分别为(26.05±0.48)、(27.67±0.75)、(26.45±0.69) g,高糖组小鼠平均体重增加了48.9%,对照组小鼠与索马甜组小鼠体重增加则分别为38.1%和43.4%,高糖组小鼠的体重显著高于对照组(P<0.05),索马甜组小鼠体重与对照组间无统计学差异。虽然糖类与其他非糖类高倍甜味剂作用于同一类受体,引起甜味觉,但糖类的摄入在胃肠道通过迷走神经将甜味感受反馈至大脑中枢神经,促进进一步的摄食行为[16]。而索马甜与甜味受体结合引发甜味觉的关键部位为两个赖氨酸残基K67和R82,作用于G蛋白偶联受体家族T1R3,引发甜味,由味觉感受器直接将甜味觉传输至中枢神经,引发甜味奖赏效应[17]。索马甜在胃蛋白酶作用下水解,以氨基酸的形式进入肠道进行进一步的消化吸收,不会引起该效应。因此,在提供甜味享受的同时,小鼠不会在胃肠道迷走神经信号传输的影响下过度进食索马甜饲料,从而避免小鼠能量摄入过剩导致的体重显著高于对照组。实验结果表明小鼠对索马甜饲料没有过度的取食倾向,这将是索马甜替代蔗糖作为甜味添加剂的一大优势。

图5 各组小鼠四周的平均日粮消耗量

图6 以不同日粮饲养4周后各组小鼠的体重
2.3 各组小鼠血糖代谢指标
表1的结果显示,索马甜组小鼠比对照组小鼠的空腹血糖值高仅0.02 mmol/L,无统计学差异,与蔗糖组小鼠相比,索马甜组小鼠连续四周摄入此甜味饲料不会诱发高血糖症状。索马甜组和对照组小鼠的空胰岛素值相同,均为0.93 nmol/L,高糖组小鼠出现了显著的胰岛素分泌异常症状。相对于高糖组小鼠出现显著(P<0.05)的胰岛素抵抗指数(HOMA-IR)异常,索马甜组小鼠的胰岛素抵抗指数与对照组相同,均为0.26,无异常现象。这些结果显示以索马甜替代蔗糖作为甜味剂加入日粮饲料,小鼠连续食用四周不会对胰岛功能造成影响。胰岛素抵抗的形成具有非常复杂的机制[18]。胰岛素抵抗是代谢综合征的核心,是许多疾病的始发因素[19]。持续四周高糖饲养的小鼠出现明显的胰岛素分泌增多,提示持续四周高糖饮食存在致代谢紊乱的风险。而索马甜的组成为207个氨基酸,且均为人体所需氨基酸[20],而且索马甜的消化过程无需胰岛素参与调节代谢[21],因此,小鼠持续四周取食索马甜饲料,在获得甜味享受的情况下,并未给胰岛功能造成负担。同时,索马甜甜度极高,只需要极少的添加量即可达到与蔗糖相同的甜度,在相同能量的热值下,对食物的营养素配比几乎不产生影响。这使得应用索马甜进行食物配伍时可以有效控制食物总热量,从而在不减少食物甜度的情况下合理控制食物热量。

表1 各组小鼠的糖代谢指标
2.4 各组小鼠口服葡萄糖耐量测试
四周之后对各组小鼠进行口服葡萄糖耐量测试。图7的结果显示,各组小鼠以50%葡萄糖灌胃后血糖变化趋势相同,在接受葡萄糖灌胃后血糖值迅速上升,在第10 min达到峰值,随后下降,在120 min时回复到接近空腹血糖值。索马甜组小鼠在峰值点(10 min)血糖值为(15.56±1.24) mmol/L、与对照组小鼠[(15.16±1.61) mmol/L]相比无统计学差异,两者均显著低于高糖组[(18.72±2.17) mmol/L]小鼠(P<0.05)。在60 min时索马甜组小鼠血糖即可快速回复至(7.84±1.44) mmol/L,接近空腹血糖值[(6.29±0.59) mmol/L],此时血糖值与对照组小鼠[(7.66±0.84) mmol/L]无差异。葡萄糖耐量测试结果显示,索马甜组与对照组小鼠的血糖波动曲线几乎完全吻合,未出现血糖波动异常现象。实验结果表明,持续四周以高糖饲料喂养小鼠,会造成显著的葡萄糖耐受异常,而以索马甜蛋白替代蔗糖,持续四周食用不会引起葡萄糖耐受异常。索马甜能量热值为4.2 kcal/g,每千克饲料中索马甜占总能量供应的0.005%,相对于空白饲料,几乎不提供热量。研究[22]发现,葡萄糖耐受异常的人群T2DM发病率显著增加。葡萄糖耐受的结果显示,与高糖组小鼠相比,小鼠持续四周食用索马甜饲料未出现葡萄糖耐受异常现象,大大降低了患Ⅱ型糖尿病的风险。
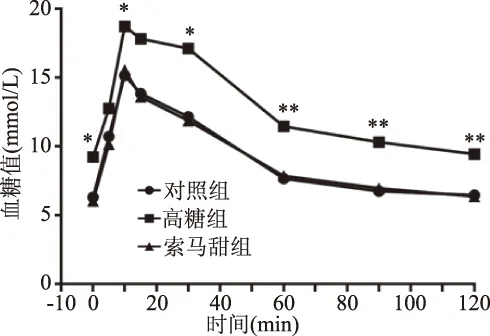
图7 不同甜味饲料饲养的小鼠的口服葡萄糖耐量
2.5 各组小鼠血脂代谢
胆固醇以及甘油三酯等的数量超过正常范围的状态,可以称为血脂紊乱[23]。在图8及图9的结果中,索马甜组小鼠的血清甘油三酯为(3.45±0.099) mmol/L,与对照组小鼠[(3.27±0.075) mmol/L)无统计学差异,与高糖组小鼠[(3.75±0.073) mmol/L)相比有极显著差异(P<0.01)。索马甜组小鼠血清胆固醇为(1.34±0.030) mmol/L,显著低于高糖组小鼠(P<0.05),同时也低于对照组小鼠[(1.35±0.029) mmol/L)但无统计学意义。高糖组小鼠出现血脂显著增高,可能是因为高糖环境对脂肪细胞的破坏[24]。而索马甜组小鼠日粮虽然甜度与高糖饲料相当,但并不产生影响脂肪细胞的高糖环境,既不含碳水化合物,也不含异常/修饰氨基酸[2]更重要的是,索马甜氨基酸组成中,含量最高的甘氨酸占索马甜氨基酸总量的12%,有研究表明,甘氨酸具有降低血脂水平,保护脂肪细胞稳态的作用[25]。实验结果显示,小鼠持续四周食用索马甜饲料未出现血脂异常现象,与高糖组小鼠相比,索马甜组小鼠持续四周食用甜味饲料没有诱发高血脂症的风险。
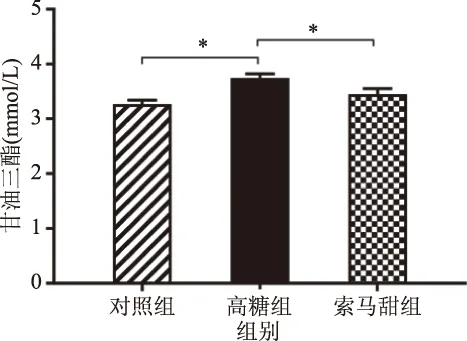
图8 各组小鼠的血清甘油三酯浓度
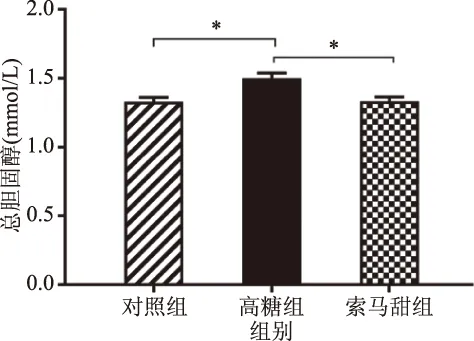
图9 各组小鼠的血清胆固醇浓度
3 结论
小鼠对索马甜饲料的取食偏好达到99%以上,可以达到与蔗糖同样的偏好程度,并且由取食索马甜饲料引发的大脑内奖赏效应强度也可达到与取食蔗糖饲料相同水平。表明在取食偏好与生理水平的愉悦感获得方面,索马甜均表现出了与蔗糖相当的优势,因此,以索马甜替代蔗糖进行食品生产与开发具有巨大潜力。持续以索马甜饲料喂养小鼠四周,小鼠对索马甜饲料的取食量与对照组未表现出显著差异,小鼠的体重与对照组相比也未表现出显著差异,而高糖组小鼠的日粮消耗与体重都显著高于对照组(P<0.05),说明索马甜饲料不存在诱导小鼠过量进食而导致能量过剩,从而引起肥胖的风险。同时,持续四周取食索马甜饲料,小鼠的血糖及葡萄糖耐受均未出现异常,未出现高血糖症状。空腹胰岛素水平与对照组相同,胰岛素抵抗指数与对照组相同,说明持续四周取食索马甜饲料后小鼠的胰岛功能未受到损害。同时,索马甜组小鼠的血清甘油三脂与胆固醇浓度与对照组相比也未出现显著差异,说明小鼠持续四周食用索马甜不会引起血脂升高。胰岛素抗性、葡萄糖耐受异常、高血脂等等这些危险因素都会造成代谢疾病的发生,如Ⅱ型糖尿病、心血管疾病、非酒精性脂肪肝等等。综上所述,索马甜可以达到与蔗糖相同的甜味效果,小鼠持续四周食用索马甜未表现出能量摄入显著过量、体重显著增加、高血糖、高血脂、葡萄糖耐受异常以及胰岛素抵抗的症状,可以排除这些高危因素潜在的致病风险。而索马甜的具体代谢特点以及生理活性需要进一步的活体实验研究,从而使索马甜在食品开发中得到更进一步的应用。
