D混料最优设计优化茶多酚微胶囊工艺及其脂肪氧化抑制作用
2020-05-08刘芝君黄业传
刘芝君,黄业传,夏 屿,卿 兰,王 洋
(西南科技大学生命科学与工程学院,四川绵阳 621010)
微胶囊化过程中包埋的粒子组分被称为“芯材”,用来包埋芯材的聚合物被称为“壁材”、“壳”、“涂层”、“载体”或“密封剂”等[1]。茶多酚(TP)主要由茶叶制备而来,具有抗菌和抗氧化活性,在食品工业中被作为防腐剂和抗氧化剂,特别在加工肉制品的贮藏领域表现出良好前景[2]。而多酚分子中存在不饱和键,使其非常不稳定,易受氧化剂、光、热、pH等环境因素的影响[3],且跟其他多酚一样具有不良风味,在加入食品或口服药品之前必须掩盖这些味道[4]。茶多酚微囊化就能保护其避免各种环境因素的影响,以延长保质期和稳定性[5],防止不必要的味道和风味[6],同时根据不同条件以受控制的形式释放[7]。
已有许多将茶多酚添加到肉制品中抑制脂肪氧化的研究,如Faisal等[8]将绿茶提取物加入到牛肉中于4 ℃贮藏1、4、8、12 d,其研究结果表明,绿茶提取物能高效减少脂质氧化和酸败;Fan等[9]等通过在猪肉香肠中添加0.03%的茶多酚和不添加茶多酚的处理比较,研究发现茶多酚可以有效提高猪肉香肠的质量特性并延长其保质期。茶多酚微胶囊的制备方法已相当成熟,包括喷雾干燥[10]、冷冻干燥[11]、电喷[12]、脂质体和纳米脂质体[13]、高速剪切均质和高压均质[14]、成膜封装[15]等,而茶多酚微胶囊在肉制品中的实际应用还较少。
目前大多研究采用正交实验或Box-Behhken实验设计优化微胶囊制备工艺[16-17],本文采用混料设计中的D-optional方法优化自组装法制备茶多酚微胶囊,具有试验次数少、多目标同步优化、预测参数精密度高等特点[18],并结合电子鼻检测不同条件处理后肉制品风味变化情况,研究茶多酚微胶囊对猪肉脂肪氧化的影响。
1 材料与方法
1.1 材料与仪器
新鲜猪背肉 购于某超市;茶多酚、壳聚糖 食品级,郑州康本生物科技有限公司;明胶 食品级,河南博洋明胶有限公司;冰乙酸、无水乙酸钠、没食子酸、无水碳酸钠、硫代硫酸钠、碘化钾、可溶性淀粉、三氯甲烷、三氯乙酸、2-硫代巴比妥酸、EDTA-2Na 均为分析纯,成都科龙试剂厂;福林酚 上海源叶生物科技有限公司。
PHS-2F型pH计 上海仪电科学仪器股份有限公司;DF 101s集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;CR22GⅢ高速冷冻离心机 日本Hitachi Koki公司;FreeZone 2.5真空冷冻干燥机 美国LABCONCO公司;UV 1000单光束紫外可见分光光度计 上海天美科学仪器有限公司;HH-8数显恒温水浴锅 常州市金坛华特实验仪器有限公司。
1.2 实验方法
1.2.1 没食子酸标准曲线的制备 根据GB/T 31740.2-2015 茶制品第2部分:茶多酚[19]的检测方法进行制备。按照福林酚法测定茶多酚含量,制备浓度分别为10、20、30、40、50 μg/mL的没食子酸标准溶液,作校正标准定量茶多酚。以没食子酸的吸光度为纵坐标(y),其质量浓度为横坐标(x)作线性回归,得到标准曲线为:y=0.0108x+0.0021,R2=0.9994。
1.2.2 茶多酚-明胶-壳聚糖纳米微粒的制备 根据Chen等[20]、张力等[21]的方法,稍作修改,称取一定量的明胶和壳聚糖,分别溶解在0.2 mol/L的醋酸-醋酸钠缓冲液(pH=5.4)中,配制成0.2%的明胶溶液和0.2%的壳聚糖溶液。称取一定量的茶多酚溶解在一定量的0.2%的壳聚糖溶液中,室温下缓慢滴入装有一定量的0.2%明胶溶液的100 mL小烧杯中,放入转子,置于恒温磁力搅拌器上,转速为300 r/min,搅拌30 min,搅拌结束后在60 ℃恒温水浴加热20 min,即得到茶多酚-明胶-壳聚糖纳米粒悬浮液。以包封率为因变量,考察体系中茶多酚、明胶、壳聚糖的合适含量。
1.2.2.1 明胶含量对可溶性复合物形成的影响 将0.2%明胶溶液滴入10 mL 0.2%壳聚糖溶液中,以试验体系干物质质量总量为1,在600 nm波长处测定壳聚糖和明胶混合溶液质量比(1∶1、2∶1、3∶1、4∶1、5∶1、6∶1)的吸光度,此时体系中明胶含量分别为0.50、0.67、0.75、0.80、0.83、0.86,0.2%壳聚糖溶液为测定的空白对照。以浊度及形成可溶性复合物的稳定性为评价指标,探究确定体系中明胶与壳聚糖复合凝聚反应形成可溶性复合物的合适含量[21]。
1.2.2.2 茶多酚含量对包封率的影响 试验体系干物质质量总量为1,固定明胶-壳聚糖质量比为3∶1,称取一定量的茶多酚,按体系中不同的茶多酚∶明胶质量比(1∶1、1∶2、1∶3、1∶6、1∶10)添加,此时体系中茶多酚含量分别为0.43、0.27、0.20、0.11、0.07,测定其包封率,同时结合悬浮液稳定性确定合适的茶多酚含量范围。
1.2.3 D-混料最优设计优化 纳米粒制备工艺根据单因素实验结果运用Design Expert 8.0.6,采用混料设计中D-optional的方法,体系中各成分干物质含量总和为1,以体系中茶多酚含量(A)、明胶含量(B)、壳聚糖含量(C)为自变量,包封率为响应值进行试验设计。
1.2.4 不同茶多酚处理对猪肉脂肪氧化的影响 取新鲜肥瘦比例为4∶6的猪背肉,绞碎,将肉糜分成每200 g一份备用,每一组按表1分别添加不同质量比例的茶多酚和由上述混料设计优化配方后得到的茶多酚微胶囊,添加前用20 mL无菌蒸馏水溶解,然后与肉糜混合均匀,空白处理仅添加20 mL无菌蒸馏水。每一份肉样平铺于密封袋中置于4 ℃条件下冰箱中贮藏,在第0、1、2、4、6、8、10 d测定其丙二醛含量(TBARs值),并采用电子鼻测定其对风味的影响。

表1 样品处理
1.2.5 检测指标
1.2.5.1 包封率的测定 将制备得到的茶多酚-明胶-壳聚糖纳米悬浮液在17000×g的条件下离心30 min,取上清液按照1.2.1中的方法测定并计算茶多酚的含量,计算包封率,沉淀冷冻干燥即为茶多酚微胶囊。

1.2.5.2 TBARs值的测定 采用GB 5009.181-2016《食品安全标准食品中丙二醛的测定》的分光光度法[22]。
1.2.5.3 电子鼻测定及主成分分析 取贮藏第10 d均匀的1.0 g样品于15 mL顶空进样瓶中,双层保鲜膜封口,在常温下放置30 min后采用顶空吸气法进行电子鼻检测分析,每个样品重复3次。电子鼻的采样参数设置为:样品测定间隔时间1 s,传感器自动清洗时间60 s,传感器归零时间10 s,进样准备时间5 s,分析采样时间70 s,进样流量400 mL/min。随后提取电子鼻各传感器特征值,利用PEN3传感器配套的Winmuster软件对数据进行主成分分析(PCA)。为保证实验数据的稳定性和精确度,选取测定过程中的50~52 s的数据用于后续分析。
1.3 数据处理
所有试验均重复3次,利用Excel、SPSS及Design-Expert软件对实验数据进行处理并加以分析。不同平均值之间采用邓肯多重比较进行差异显著性检验,P<0.05为差异显著。
2 结果与讨论
2.1 茶多酚-明胶-壳聚糖微粒的制备
2.1.1 明胶含量对可溶性复合物形成的影响 由图1可知,随着明胶在体系中的含量增加,体系吸光度缓慢上升,浊度增加。试验中使用明胶为B型明胶,其等电点为4.8,体系pH为5.4高于其等电点,则此时明胶带负电荷,而壳聚糖因含有大量氨基在此条件下带正电荷,二者通过两性静电相互作用产生复合凝聚反应,形成凝聚物[23]。当两者比例超过3∶1,即明胶含量超过0.75时体系浊度迅速增大,且有白色絮状凝聚物析出,体系不稳定,故确定明胶含量范围为0.50~0.75。

图1 明胶含量对聚合物浊度的影响
2.1.2 茶多酚含量对包封率的影响 由图2可知随体系中茶多酚含量增加,茶多酚微胶囊包封率也显著增加,在茶多酚处于较低含量时,体系呈现为乳光悬浮液,超过一定含量后,体系有絮凝沉淀产生。当茶多酚含量超过0.43时,茶多酚在体系中溶解性变差,形成大块絮凝。根据张茵等[23]研究结果表明随着茶多酚含量的增加,其包封率增大,粒径也在增大,但超过一定比例后,其粒径超过微粒要求,且悬浮液不稳定,则确定茶多酚含量范围为0.20~0.43。

图2 茶多酚含量对包封率的影响
2.2 不同配比对包封率的影响
2.2.1 D-混料最优设计 以试验体系中干物质质量总和为1,由2.1的实验结果得到各因素实际含量,实验采用D-optional混料设计,经试验设计调整后确定体系中茶多酚含量为0.25~0.40,明胶含量为0.50~0.65,壳聚糖含量为0.10~0.25,考察茶多酚-明胶-壳聚糖纳米粒包封率,试验设计及结果如表3所示。以包封率为响应值,应用Design-Expert 8.0.6软件对试验数据结果进行二次项式回归分析,得到数学模型如下:

表3 D-混料最优设计及结果
包封率=51.07A+39.71B+40.05C+1.93AB+10.73AC+4.72BC

表2 混料设计因素和水平表
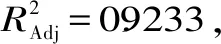

表4 试验结果方差分析
从图3中可以看出,响应面基本呈现出曲面趋势,说明各组分之间存在交互作用。从得到的数学模型和图3中可以看出茶多酚含量对包封率的影响最大,随含量在一定范围内增大,包封率随之显著提高,在体系茶多酚含量较低时,茶多酚分子未与明胶分子进行期望的氢键或疏水作用力相互交联进行包埋行为,而是通过弱相互作用力依附在明胶分子表面[24],试验测试包封率时通过高转速离心力可以使其小分子分离,导致在低茶多酚含量时包封率较低。
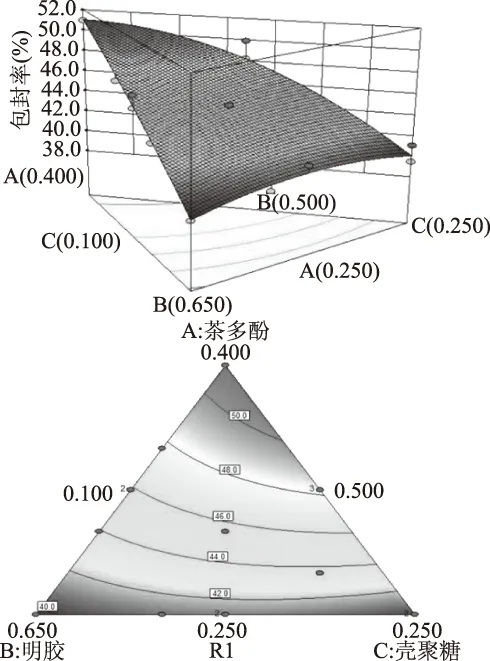
图3 不同配比对包封率的影响
2.2.3 验证试验 采用Design Expert 8.0.6软件的优化功能,以最大包封率为目标进行配方优选,选择期望值最大的一组进行验证试验。得到最优配方为茶多酚含量为0.40、明胶含量为0.50、壳聚糖含量为0.10,预测包封率为51.10%;按最优配方进行验证试验,三次实验重复,得到实际包封率为50.87%±0.25%,与实验预测值接近,说明采用D-混料最优设计进行茶多酚-明胶-壳聚糖微胶囊的工艺优化配方较准确。张力[21]采用自组装法以壳聚糖浓度、明胶浓度、丁香酚浓度为正交试验试验指标,优化丁香酚-明胶-壳聚糖纳米微粒的制备工艺,得到丁香酚-明胶-壳聚糖纳米微粒的最优工艺下包封率为 50.69%,与本方法试验结果相似。
2.3 不同茶多酚处理对猪肉脂肪氧化的影响
2.3.1 不同茶多酚处理对猪肉TBARs值的影响 TBARs值通常用来评价动物性食品中脂肪氧化分解程度,是脂肪分解所产生的衍生物,如丙二醛等与TBA反应的值,能够反应脂肪氧化程度[19]。在新鲜猪肉糜中添加不同比例的茶多酚及茶多酚微胶囊,其TBARs值在贮藏期间的变化如表5所示,添加不同茶多酚各组TBARs值在贮藏期的第1 d表现出下降,其原因可能是氧化产物丙二醛与冷却肉中活性氨基作用生成1-氨基-3-氨基丙烯,从而导致TBARs值下降[23];随贮藏时间的增加,各处理TBARs值也明显增加,且贮藏期间(0 d除外)对照组TBARs值均显著高于添加茶多酚和微胶囊处理组(P<0.05),说明添加茶多酚或者微胶囊茶多酚均能有限抑制脂肪氧化。与尹爱武等[25]研究刺儿茶多酚对冷却猪肉保鲜效果研究结果相同;孙承锋等[26]研究苹果多酚对对鲜肉色泽稳定性及脂肪氧化的影响结果表明添加0.01%~0.1%的苹果多酚能较好抑制脂肪氧化,随着苹果多酚添加量的增大,其抗氧化作用增强,TBARs值降低。有资料提出良质肉TBARs值≤0.664 mg/kg,TBARs值>0.5 mg/kg会有氧化异味产生,变质肉TBARs值>1 mg/kg[19]。贮藏前4 d,添加不同状态0.01%茶多酚的B、E组TBARs值无显著差异,C、D组TBARs值则显著高于F、G组(P<0.05),说明使用本方法制的茶多酚微胶囊能达到良好的脂肪氧化抑制效果。处理第6~10 d,添加茶多酚的B、C、D组TBARs值显著高于添加相同含量茶多酚微胶囊的E、F、G组(P<0.05),说明茶多酚微胶囊的缓释作用能有效延长茶多酚的抗氧化效力。处理第10 d,肉样TBARs值明显增加,除A组TBARs值>1 mg/kg,其余六组TBARs值仍保持在较低水平(≤0.664 mg/kg);E、F、G组分别使猪肉TBARs值较A组降低85.7%、89.4%和91.5%,较B、C、D组分别降低了67.7%、46.0%、50.7%。D组最终TBARs值为0.219 mg/kg,E组为0.183 mg/kg,说明添加0.01%的茶多酚微胶囊就能达到添加0.05%茶多酚的脂肪氧化抑制效果,可能是明胶蛋白和壳聚糖通过静电相互作用增强了芯材的稳定性和生物活性[27],使其脂肪氧化抑制效果更加显著,以此达到减少茶多酚用量的效果。

表5 不同茶多酚对猪肉TBARs值的影响(mg/kg)
2.3.2 不同茶多酚处理对猪肉风味的PCA分析 主成分分析(PCA)是将传感器提取的多元因子进行降维、简化和数据转换等,提取几个特征值(能较大程度上反映样本信息变量的因子)进行线性分类,最后得到可视化的二维散点图,散点图上PC1轴和PC2轴包含第一主成分和第二主成分的贡献率,贡献率用来反映原始数据信息,贡献率越大越能最大限度的反映样本的原本特征[28]。图4中的每个椭圆代表同批次猪肉风味的数据采集点,PCA分析中第一主成分的方差贡献率为98.82%,第二主成分的方差贡献率为0.94%,贡献率总和达到99.76%,大于95%以上,说明PC1和PC2已经包含足够的信息量,可以代表样品挥发性风味的主要特征。因PC1贡献率远大于PC2的贡献率,表明样品间的差异主要在PC1上,样品在横坐标上距离越大,其差异也越大。从主成分PC1和PC2两个主轴上看,贮藏10 d后空白组(A)的信息采集点的椭圆位于效果图右边,与添加茶多酚各处理组无交叉重叠,说明贮藏10 d后的空白组(A)与添加茶多酚各处理组在风味上有较大差别。
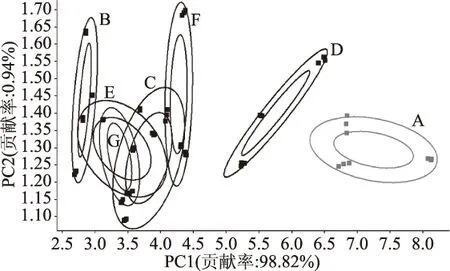
图4 不同茶多酚处理对猪肉风味的PCA分析
表6中数值代表各组区分度大小,其值越接近1区分度越大,说明区分越明显。B组与E组区分度较差,C组与E、F、G组区分度较差,E组与F、G组区分度较差,与TBARs结果有一定差异。相洋[29]研究了几种天然保鲜剂对冷鲜猪肉保鲜效果,运用GC-MS对经过处理的冷却猪肉挥发性组分进行了分析,其结果表明加入保鲜剂后,猪肉中烃类物质、醛类物质和酯类物质含量明显减少,而其它类物质的含量明显增加,醇类物质、酮类物质和羧酸类物质变化不大,其原因为添加的天然保鲜剂自身香气较为浓郁,挥发性成分丰富,对冷却猪肉含有的部分气味有所掩盖。本试验中可能是除脂肪氧化产生的风味外,添加的不同茶多酚自身携带一些味道,脂肪氧化程度较低时,在一定程度上掩盖了脂肪氧化味,则其风味差异不明显。虽然D组脂肪氧化指标处于较低水平,但其风味与其余组仍存在较为显著的差异,可能是因为高浓度的茶多酚添加会严重影响猪肉本身的风味,而同处在较高添加量的G组,由于微胶囊包埋掩盖了茶多酚本身的风味,则在实际应用中能减少对风味的影响。TBARs值测定结果表示A组处于变质肉水平,其余组均处于良质肉水平,脂肪氧化导致肉变质,出现明显的脂肪氧化味,其电子鼻测定结果与TBARs值结果保持一致,说明电子鼻能较好区分变质肉与良质肉。

表6 不同茶多酚处理猪肉风味PCA分析数据矩阵表
3 结论
利用Design Expert 8.0.6软件中的D-optional混料设计对自组装法制备茶多酚-明胶-壳聚糖微粒配方进行优化,得到最优配方为茶多酚含量为0.40、明胶含量为0.50、壳聚糖含量为0.10,其包埋率为为50.87%±0.25%。以得到的最优配方制备得到茶多酚微胶囊在猪肉中按一定比例添加后还能有效抑制脂肪氧化,添加0.01%、0.03%和0.05%的茶多酚微胶囊能分别使猪肉TBARs值较未添加茶多酚的空白组降低85.7%、89.4%和91.5%;分别较添加0.01%、0.03%和0.05%的茶多酚组降低67.7%、46.0%、50.7%;电子鼻测定结果也显示,添加不同茶多酚处理组的风味与空白组有较大区别,说明得到的茶多酚微胶囊能有效抑制脂肪氧化,延长猪肉的保藏时间。此外,高浓度的茶多酚也会严重影响猪肉的风味,因此,将茶多酚微胶囊化,除了能提高茶多酚的稳定性、保持其抗氧化活性外,还能掩盖其自身的异味,以此可减少其在食品加工中的添加量。
