裂叶荨麻体外降糖活性化学成分
2020-05-08杨文娟毛跟年何亚娟侯景龙马养民
杨文娟,胡 媛,毛跟年,何亚娟,侯景龙,马养民
(1.陕西科技大学食品与生物工程学院,陕西西安 710021;2.陕西科技大学化学与化工学院,教育部轻化工助剂化学与技术重点实验室,陕西西安 710021)
裂叶荨麻(UrticafissaE. Pritz.)为荨麻科荨麻属多年生草本植物,始载于《本草图经》,是常用的民族药和民间药[1],又叫蜇人草、蝎子草等,在我国西北、西南等地分布十分广泛[2],具有祛风除湿、活血止痛、降血糖等功能,其茎皮纤维可供纺织用,叶和嫩枝煮后可作为饲料[3]。目前国内外关于荨麻属植物的根、茎、叶、种子等不同部位的化学成分有较多研究,王梦月等[4-6]研究了裂叶荨麻根、叶的化学成分,Zhang等[7]研究了裂叶荨麻种子中具有细胞毒性的化学成分,何斌[8]用HPLC法检测了异株荨麻茎中的绿原酸和黄酮类化合物等,表明荨麻属植物含有黄酮、木脂素、有机酸、甾体、挥发油、多糖类等化合物[9-12]。此外,荨麻属植物具有良好的抑制良性前列腺增生、抗风湿、降血糖、镇痛、抗炎、抗菌、抗氧化等药理活性[13-16],荨麻属植物降血糖活性成为近年来的主要研究热点之一,Mehri等[17]从多个数据库中筛选出21篇文章,分析了荨麻水提物或醇提物在治疗糖尿病中的疗效和安全性,表明使用荨麻可显著降低血糖和糖尿病并发症。裂叶荨麻乙醇提取物对链脲佐菌素诱导糖尿病小鼠的肝脏、肾脏损伤的作用,发现其保护作用与抗氧化活性相关[18-19]。
糖尿病是一种慢性内分泌代谢紊乱疾病,发病率呈逐年上升的趋势。研究发现,机体长期的高血糖会引起糖尿病肾病、糖尿病足、糖尿病性脑血管病等并发症,而避免和控制糖尿病并发症的最佳方式就是控制血糖,控制血糖有多种途径,减少体内淀粉类物质分解为单糖的速度、降低餐后血糖就是临床常用方法之一[20]。α-葡萄糖苷酶在食物碳水化合物的代谢过程中发挥着重要的作用,它能促进淀粉、蔗糖、麦芽糖等分解为单糖,抑制α-葡萄糖苷酶能够减少单糖的产生,从而降低餐后血糖[21-22]。因此,对α-葡萄糖苷酶抑制作用的研究为评价体外降糖活性的常用研究方法。从中药或天然植物中筛选降糖活性成分如小檗碱、葛根素、黄芪多糖等具有明确的调节血糖血脂作用,临床用于缓解糖尿病及其并发症[23-25]。除了从传统中药筛选外,其他天然植物如木樨榄叶、鹰嘴豆、绿萝花等也进行了化学成分及降糖活性研究[26-28]。
目前荨麻主要集中于水提物或醇提物的降糖活性研究[29-30],而其降糖的物质基础鲜有报道。因此,本研究以α-葡萄糖苷酶的抑制作用为追踪手段,筛选裂叶荨麻体外降糖活性部位,并分离鉴定其化学成分,明确具有体外降糖活性的化合物。以期为阐明裂叶荨麻治疗糖尿病的物质基础,也为开发该植物资源提供科学依据。
1 材料与方法
1.1 材料与仪器
裂叶荨麻 采自陕西省旬阳县,经陕西中医药大学颜永刚教授鉴定为荨麻科荨麻属植物裂叶荨麻(UrticafissaE.Pritz.);α-葡萄糖苷酶(23.5 U/kg)、阿卡波糖、对硝基苯酚(pNP)、对硝基苯-α-D葡萄糖吡喃苷(pNPG) 上海源叶生物科技有限公司;二甲基亚砜(DMSO) 天津市科密欧化学试剂有限公司;柱层析色谱硅胶 青岛海浪硅胶干燥剂有限公司;其他试剂 均为分析纯。
全波长扫描式多功能读数仪 赛默飞世尔科技有限公司;BrukeravanceⅢ-400MHz超导核磁共振仪 瑞士Bruker公司;XW-80A涡旋混合仪 海门市其林贝尔仪器制造有限公司;XT5显微熔点分析仪 北京市科仪电光仪器厂;HH-4数显恒温水浴锅 金坛市江南仪器厂;JA26038电子天平 上海天美天平仪器有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 pNP标准曲线的绘制 精确称取0.0014 g pNP标准品,用PBS(磷酸盐缓冲溶液,0.1mol/L,pH=6.7)溶液超声溶解,定容至10 mL容量瓶中,得浓度为0.001 mmol/L的pNP母液,将其稀释成一系列浓度为1.000、0.500、0.250、0.125、0.063、0.031、0.016 mmol/L的溶液。分别取以上不同浓度的pNP溶液各100 μL加入96孔板,再加入1 mol/L的Na2CO3溶液100 μL,振荡10 s后,在波长405 nm处测定其吸光度,每组浓度平行测定三次,求其平均值。以吸光度为纵坐标,以pNP摩尔浓度为横坐标,绘制标准曲线。
1.2.2 裂叶荨麻提取部位的筛选 将裂叶荨麻植株分为根、茎、叶三部分,阴干使其含水量在5%之内,取根、茎、叶各200 g,粉碎,过60目筛,用10倍量70%乙醇浸提3次,每次2 h,合并提取液,在0.1 MPa,65 ℃下减压浓缩成浸膏,65 ℃干燥至恒重,备用。分别精密称取根、茎、叶干浸膏0.1000 g,用DMSO溶解配成10 mg/mL的母液,并分别稀释成一系列浓度为1、2、4、6、8、10 mg/mL的溶液,阳性对照阿卡波糖与样品配制成相同的浓度梯度,并检测α-葡萄糖苷酶抑制率。
1.2.3 裂叶荨麻乙醇提取物不同溶剂萃取相的筛选 选择体外活性较高的裂叶荨麻部位进行化学成分的初步分离,取其粗粉3 kg,用10倍量70%乙醇浸提3次,每次48 h,每隔8 h搅拌一次,合并提取液,在0.1 MPa 65 ℃下减压浓缩成浸膏,65 ℃干燥至恒重,得到醇提物干浸膏260.58g,然后将其悬浮于水中,依次用石油醚、乙酸乙酯、正丁醇萃取,分别减压回收溶剂,得到石油醚相浸膏20.00 g,乙酸乙酯相浸膏13.63 g,正丁醇相浸膏127.50 g,水相(萃余部分)浸膏76.37 g。分别精密称取以上四相浸膏0.1000 g,用DMSO溶解配成10 mg/mL的母液,并分别稀释成一系列浓度为1、2、4、6、8、10 mg/mL的溶液,阳性对照阿卡波糖与样品配制成相同的浓度梯度,并检测α-葡萄糖苷酶抑制率。
1.2.4 化学成分的分离及结构鉴定 选择体外活性较高的萃取相进行化学成分分离,取该萃取相浓缩后的浸膏13.00 g,用90 mL甲醇溶解,25.00 g硅胶拌样,在80 ℃的烘箱中放置24 h至恒重,经硅胶柱层析,石油醚-乙酸乙酯(100∶0、100∶10、100∶20、100∶50、100∶100)、乙酸乙酯-甲醇(100∶0、100∶10、100∶20、100∶50、0∶100)梯度洗脱,每个梯度设置6个洗脱体积,采用重结晶来进行分离纯化,石油醚∶乙酸乙酯=100∶10的第5个洗脱体积经重结晶得到化合物1(15.4 mg)、石油醚∶乙酸乙酯=100∶20的第1个洗脱体积经重结晶得到化合物2(7.7 mg)、石油醚∶乙酸乙酯=100∶20的第2个洗脱体积经重结晶得到化合物3(13.34 mg)和4(20.50 mg)、石油醚∶乙酸乙酯=100∶20的第2个洗脱体积经重结晶得到化合物5(10.23 mg),乙酸乙酯洗脱梯度的第6个洗脱体积经重结晶得到化合物6(20.39 mg),结合理化性质,通过1H-NMR、13C-NMR等方法对所得化合物的结构进行鉴定。
1.2.5 化合物对α-葡萄糖苷酶的抑制率 分别精密称取6个化合物0.0050 g,DMSO溶解配成1 mg/mL的母液,并分别稀释成一系列浓度为1、2、4、6、8、10 mg/mL的溶液,阳性对照阿卡波糖与样品配制成相同的浓度梯度,并检测α-葡萄糖苷酶抑制率。
1.2.6α-葡萄糖苷酶抑制率的测定 本实验参照Jeon等[31]的方法,选定200 μL的反应体系,首先在96微孔板中加入10 μL的样品溶液,再加入40 μLα-葡萄糖苷酶(0.5 U/mL),迅速放入37 ℃微孔板恒温振荡器中孵化10 min,然后在反应混合物中加入50 μL的底物溶液(pNPG),迅速放入37 ℃微孔板恒温振荡器中反应30 min。反应结束后加入100 μL终止液来终止反应,于405 nm波长处测定其吸光度。以阿卡波糖作为阳性对照,加样方法如表所示(表1),每组3孔,按式1计算α-葡萄糖苷酶的抑制率,并计算其半数抑制浓度(IC50)。
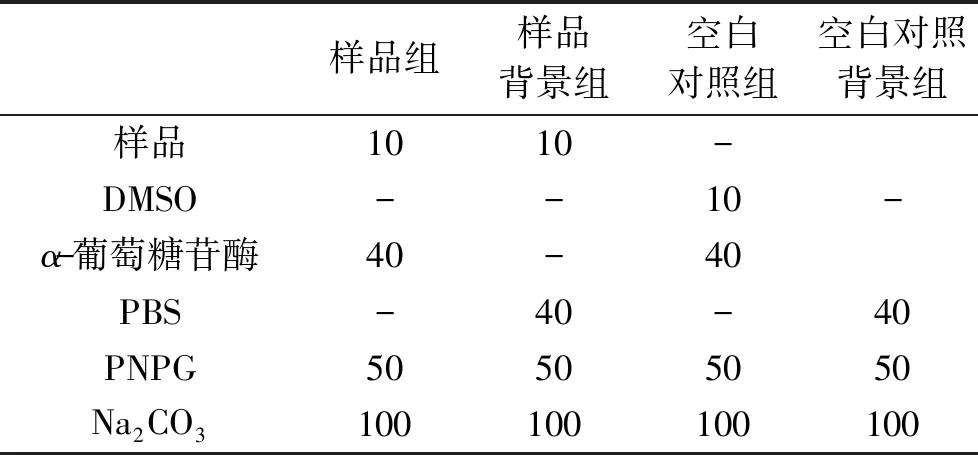
表1 α-葡萄糖苷酶抑制活性测定的加样量(μL)

随着我国社会的不断发展,我国经济增长的速度越来越快。在过去的发展历程中,我国很多经济增长是以环境的破坏为代价而取得的,在近些年,环境保护已经成为了我国新的发展重心。随着我国对于环境保护和生态建设的重视度越来越高,林业发展成为了人们关注的重点,本文针对林木种苗的现现状进行了阐述,并对其培育技术和管护要点进行了分析。
式中:A1为样品组的吸光度;A2为样品背景组的吸光度;A3为空白对照组的吸光度;A2为空白对照背景组的吸光度。
1.3 数据处理
实验重复3次,采用Origin 8.0及SPSS 24.0对数据进行分析,结果用平均数±标准误差表示。
2 结果与分析
2.1 pNP标准曲线
pNP的标准曲线见图1,得到回归方程为y=0.0009x+0.0552,R2=0.998,说明pNP在0.016~1.000 mmol/L浓度范围内具有良好的线性关系。
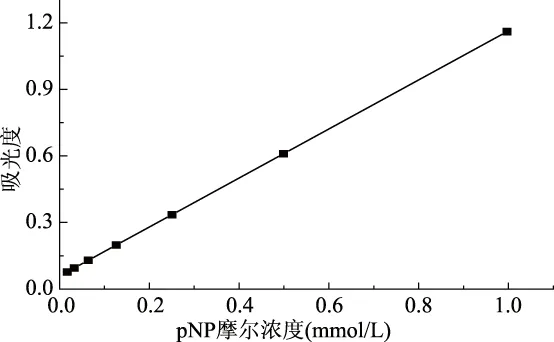
图1 pNP标准曲线
2.2 裂叶荨麻提取部位的降糖活性筛选
由α-葡萄糖苷酶抑制活性测定结果可知(图2),裂叶荨麻不同部位对α-葡萄糖苷酶均有一定抑制作用,但作用强度有差别,根、茎、叶的IC50值分别为11.809、12.402、20.169 mg/mL,由此可见,其抑制活性强弱顺序为根>茎>叶,裂叶荨麻根的抑制作用最强,因此,后续研究对裂叶荨麻根进行体外活性部位的筛选。

图2 裂叶荨麻不同部位对α-葡萄糖苷酶的抑制率
2.3 裂叶荨麻乙醇提取物不同溶剂萃取相的降糖活性筛选
由α-葡萄糖苷酶抑制活性测定结果可知(图3),裂叶荨麻根不同极性部位对α-葡萄糖苷酶的抑制作用有明显差别,其中,石油醚相对α-葡萄糖苷酶几乎没有抑制作用,乙酸乙酯相、正丁醇相和水相对α-葡萄糖苷酶抑制活性的IC50值分别为8.499、13.241、19.774 mg/mL,由此可知,萃取相对α-葡萄糖苷酶抑制活性强弱顺序为乙酸乙酯相>正丁醇相>水相>石油醚相,乙酸乙酯相的抑制作用最强,因此,对裂叶荨麻根乙酸乙酯相的化学成分进行系统分离及活性成分鉴定。

图3 裂叶荨麻根不同极性部位对α-葡萄糖苷酶的抑制率
2.4 化合物的结构鉴定
化合物1:白色针状结晶,ESI-HR-MS:576.43518[M+H]+,分子式为C35H60O6,mp297~299 ℃,1H-NMR(400 MHz,CDCl3)δH:5.34(1H,d,J=5.0 Hz,H-6),3.52(1H,s,H-3),1.01(3H,s,H-19),0.92(3H,s,H-21),0.70(3H,d,J=6.4 Hz,H-18),13C-NMR(100 MHz,CDCl3)δC:140.37(C-5),121.76(C-6),71.83(C-3),56.75(C-14)、56.01(C-17)、50.10(C-9)、45.79(C-24)、42.27(C-13)、40.56(C-4)、37.24(C-12)、36.51(C-1)、36.16(C-10)、33.92(C-20)、31.89(C-22)、31.64(C-8)、29.09(C-7)、28.28(C-2)、24.32(C-23)、27.23(C-25)、25.98(C-16)、23.01(C-15)、21.08(C-28)、19.86(C-11)、19.43(C-26)、19.43(C-27),19.03(C-19)、18.79(C-21)、12.00(C-18)、11.88(C-29)。以上数据与文献[32]报道基本一致,故鉴定为对β-谷甾醇。
化合物2:白色粉末,ESI-HR-MS:179.07028[M+H]+,分子式为C10H10O3,mp 216~218 ℃,1H-NMR(400 MHz,CDCl3)δH:7.67(1H,d,J=15.9 Hz,H-β),7.46(2H,d,J=8.2Hz,H-2,H-6),6.88(2H,d,J=8.2 Hz,H-3,H-5),6.33(1H,d,J=15.9 Hz,H-α),3.83(1H,S,-OCH3)。13C-NMR(100 MHz,CDCl3)δC:168.03(C=O)、157.70(C-4)、144.67(C-β)、130.02(C-3、C-5)、127.19(C-1)、115.89(C-2、C-6)、115.18(C-α)、51.75(-OCH3)。以上数据与文献[33]报道基本一致,故鉴定为对羟基桂皮酸甲酯。
化合物4:白色粉末,ESI-HR-MS:137.05972[M+H]+,分子式为C8H8O2,mp-2~-1 ℃,1H-NMR(400 MHz,CDCl3)δH:7.81(2H,d,J=8.5Hz,H-2,H-6),6.97(2H,d,J=8.2Hz,H-3,H-5),3.81(3H,s,H-OCH3),9.84(1H,s,H-CHO)。13C-NMR(100 MHz,CDCl3)δC:191.54(C-1)、162.68(C-4)、132.57(C-2、C-6)、130.01(C-CHO)、116.07(C-3、C-5),51.78(C-OCH3)。以上数据与文献报道[35]基本一致,故鉴定为对甲氧基苯甲醛。
化合物5:白色粉末,ESI-HR-MS:165.05449[M+H]+,分子式为C9H8O3,mp 210~212 ℃,1H-NMR(400 MHz,DMSO-d6)δH:7.53(2H,d,J=5.0Hz,H-2,H-6),6.79(2H,d,J=5.0 Hz,H-3,H-5),6.30(1H,d,J=15.9 Hz,H-α),7.50(1H,d,J=12.3Hz,H-β),根据耦合常数判断为反式双键,并且该双键和吸电子基团相连。13C-NMR(100 MHz,DMSO-d6)δC:168.46(COOH)、125.70(C-1)、144.68(C-β)、160.05(C-4)、115.75(C-α)116.19(C-3、C-5)、130.59(C-2,C-6)。以上数据与文献[36]报道基本一致,故鉴定为反式-对羟基肉桂酸。
化合物6:白色粉末,ESI-HR-MS:576.43518[M+H]+,分子式为C35H60O6,mp 297~299 ℃,1H-NMR(400 MHz,DMSO-d6),δH:5.34(1H,m,H-6),4.91(1H,H-1′),4.47(2H,t,J=11.50 Hz,H-6′),4.21(1H,d,J=7.70 Hz,H-4′),3.09(1H,m,H-3),0.99(3H,H-21),0.96(3H,H-19),0.91(3H,d,J=6.30 Hz,H-4′),0.84(3H,H-29),0.81(3H,H-27),0.68(3H,s,H-18)。13C-NMR(100 MHz,DMSO-d6)δC:140.37(C-5)、121.76(C-6)、99.98(C-1′)、77.36(C-3)、77.04(C-3′)、76.72(C-5′)、73.50(C-2′)、71.83(C-4′)、56.85(C-6′)、56.75(C-14)、56.01(C-17)、51.25(C-9)、45.79(C-24)、40.56(C-13)、39.76(C-12)、37.24(C-4)、36.58(C-20)、36.16(C-1)、35.89(C-10)、33.70(C-22)、31.91(C-7)、31.64(C-8)、28.97(C-2)、28.22(C-25)、27.23(C-16)、25.45(C-15)、24.32(C-18)、23.04(C-18)、21.24(C-11)、19.86(C-26)、19.43(C-19)、18.79(C-21)、18.27(C-27)、12.31(C-18)、12.06(C-29)。以上数据与文献[37]报道基本一致,故鉴定为对胡萝卜苷。
2.5 化合物对α-葡萄糖苷酶的抑制作用
由α-葡萄糖苷酶抑制活性测定结果可知(图4),裂叶荨麻根乙酸乙酯相分离的6种化合物对对α-葡萄糖苷酶的抑制作用有明显差别,其中,β-谷甾醇和对甲氧基苯甲醛对α-葡萄糖苷酶几乎没有抑制作用,对羟基桂皮酸甲酯、正十六烷酸、反式-对羟基肉桂酸、胡萝卜苷均有一定的体外活性,其IC50值分别为10.239、10.657、5.234、1.693 mg/mL,由此可知其活性强弱顺序为胡萝卜苷>反式-对羟基肉桂酸>对羟基桂皮酸甲酯>正十六烷酸>对甲氧基苯甲醛>β-谷甾醇,胡萝卜苷对α-葡萄糖苷酶具有很强的抑制作用,并且强于阳性对照阿卡波糖(IC50=4.254 mg/mL)。
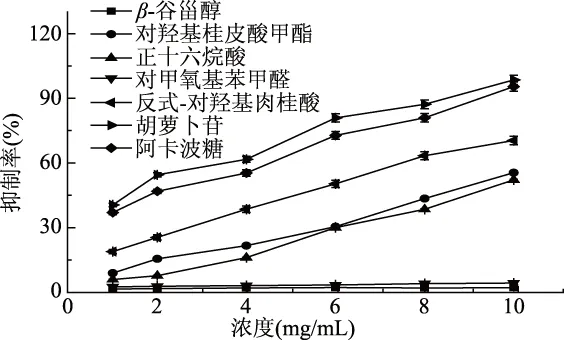
图4 化合物对α-葡萄糖苷酶的抑制率
3 讨论与结论
本研究以体外α-葡萄糖苷酶抑制率为降糖活性评价方法,对裂叶荨麻植物的根、茎、叶等不同部位进行考察,结果发现,裂叶荨麻各部位均具有体外降糖作用,其中根对α-葡萄糖苷酶抑制活性最强,这一结果与前期体内活性研究结果一致[19]。由裂叶荨麻根不同极性部位活性测定结果可知,除石油醚相外,水相、正丁醇相及乙酸乙酯相均有一定体外降糖活性,其中乙酸乙酯相作用最强,IC50值为8.499 mg/mL,这一结果应该与乙酸乙酯相存在丰富的化学成分有关[38-39]。从裂叶荨麻根的乙酸乙酯相中鉴定了6个化合物,其中对羟基桂皮肉桂酸甲酯、正十六烷酸、反式-对羟基肉桂酸、胡萝卜苷对α-葡萄糖苷酶均有抑制作用,胡萝卜苷和反式-对羟基肉桂酸抑制作用较强,IC50值分别为1.693、5.234 mg/mL,接近或超过阳性对照阿卡波糖的抑制作用(IC50=4.254 mg/mL),由此推测这些化合物是裂叶荨麻根发挥体外降糖活性的物质基础之一,但由于本研究中各化合物的收率较低,并未开展动物体内活性的验证以及作用机制的探讨,这些内容有待于进一步研究。
