Pt-Ir合金多孔立方体纳米颗粒的控制合成及其电催化性能
2020-05-08张明明苏嫚嫚赵燕熹
张明明,苏嫚嫚,赵燕熹,黄 涛
(中南民族大学 化学催化转化与能源材料化学教育部重点实验室暨催化材料科学湖北省重点实验室,湖北 武汉 430074)
铂族金属是许多化学反应和工业过程中常用的催化剂,但由于其储量少、成本高,极大限制了其大规模实际应用。因此,除了寻找替代品外,研究者探索了许多方法来提高其使用效率,减少其使用量。近年来,基于铂族金属的双金属合金纳米结构由于其比单一铂族金属具有更优越的催化性能而受到广泛关注[1-6]。铂族金属的合金化可能改变其电子结构和表面原子排列,从而改变其电子性质;此外,铂族金属与金属组分的协同作用有利于提高其催化性能。目前,许多铂族金属的双金属合金纳米材料已被成功合成并显示出增强的催化活性[7-13],但相对于Pd、Pt及其合金纳米颗粒的控制合成,基于Ir的双金属合金纳米颗粒的研究较少[14-19]。为此,作者采用微波法,以乙酰丙酮铱和氯铂酸为前驱体、三缩四乙二醇为溶剂和还原剂、抗坏血酸为共还原剂、聚乙烯吡咯烷酮为稳定剂、适量碘化钾为形貌控制剂,一步快速合成Pt-Ir合金多孔立方体纳米颗粒,并利用TEM、SEM、XRD、XPS、EDS等技术对其结构进行表征,初步考察其电催化性能。
1 实验
1.1 试剂与仪器
氯铂酸(H2PtCl6·6H2O,Pt≥37%,纯度≥99%)、乙酰丙酮铱[Ir(acac)3,Ir≥37.5%,纯度≥98%],昆明贵研新材料科技有限公司;抗坏血酸(AA,纯度≥99.0%),阿拉丁试剂;三缩四乙二醇(TEG),Acros公司;聚乙烯吡咯烷酮(PVP,Mw=30000)、碘化钾(KI)、丙酮、无水乙醇,国药集团化学试剂有限公司;所有试剂使用前未进一步纯化。
FEI Tecnai G20型透射电子显微镜;SU8010型扫描电子显微镜;FEI Talos F200X型扫描透射电子显微镜;Bruker D8型X-射线粉末衍射仪;VG Multilab 2000型X-射线光电子能谱仪;格兰仕微波炉;Xiangyi H-1650型台式离心机;CHI 760E型电化学工作站。
1.2 Pt-Ir双金属纳米颗粒的合成
分别取0.6 mL 0.05 mol·L-1H2PtCl6的TEG溶液、0.25 mL 0.04 mol·L-1Ir(acac)3的TEG溶液于50 mL烧瓶中,加入适量TEG搅拌均匀;然后加入0.7 mL 0.5 mol·L-1KI的TEG溶液和0.9 mL 0.5 mol·L-1PVP的TEG溶液,搅拌均匀;再加入0.06 mL 0.5 mol·L-1AA的TEG溶液,室温搅拌30 min;置于900 W微波炉中全功率加热120 s,得草绿色胶体溶液;取出,冷却至室温,加入等体积丙酮,超声混合后,离心沉降,分离出黑色沉淀。反应体系总体积为10 mL,反应物Ir(acac)3∶H2PtCl6∶AA∶KI∶PVP的物质的量比为1∶3∶3∶35∶45。
1.3 Pt-Ir双金属纳米颗粒的表征
将上述黑色沉淀用无水乙醇洗涤4次后重新分散到乙醇中,毛细管法制样,进行TEM测试(操作电压200 kV)。
将上述黑色沉淀用乙醇和水交替反复洗涤15~20次后用适量乙醇分散,毛细管法制样,进行SEM测试(操作电压20 kV);将该乙醇分散液缓慢滴涂在玻片上,红外灯烤干,进行XRD和XPS测试。
1.4 Pt-Ir合金多孔立方体纳米颗粒的电催化性能测试
采用三电极系统在电化学工作站上测试循环伏安曲线。分别将Pt-Ir合金多孔立方体纳米颗粒和Pt黑沉积到玻碳电极(3 mm×3 mm)上,制作修饰电极,用作工作电极;铂柱电极和饱和甘汞电极分别用作对电极和参比电极。测试前,工作电极在0.5 mol·L-1H2SO4溶液中以250 mV·s-1的扫描速率在-0.2~1.0 V之间循环扫描2次以清洁电极表面。然后,在0.5 mol·L-1H2SO4和0.5 mol·L-1CH3OH混合溶液中以50 mV·s-1的扫描速率在-0.2~1.0 V之间测试循环伏安曲线,分别考察Pt-Ir合金多孔立方体纳米颗粒和Pt黑对甲醇电氧化的催化性能。
2 结果与讨论
2.1 TEM分析
Pt-Ir双金属纳米颗粒的TEM照片如图1所示。

图1 Pt-Ir双金属纳米颗粒的TEM照片Fig.1 TEM images of Pt-Ir bimetallic nanoparticles
从图1可以看出,Pt-Ir双金属纳米颗粒形貌单一,呈立方体结构,大小均匀,分散性较好,平均粒径约80 nm,颗粒表面不平整,呈颗粒状孔隙特征。
2.2 SEM分析
Pt-Ir双金属纳米颗粒的SEM照片如图2所示。
从图2可以看出,Pt-Ir双金属纳米颗粒表面分布着较小颗粒及其所形成的孔隙结构。进一步证实了Pt-Ir双金属纳米颗粒的多孔立方体结构特征。
2.3 XRD分析
微波加热不同时间所合成的Pt-Ir合金多孔立方体纳米颗粒的XRD图谱如图3所示。
从图3可以看出,与面心立方(fcc)纯金属Pt(JCPDS No.04-0802)和纯金属Ir(JCPDS No.06-0598)相比,Pt-Ir合金多孔立方体纳米颗粒的晶面衍射峰均位于对应的两种纯金属之间,说明合成的Pt-Ir合金多孔立方体纳米颗粒是由Pt和Ir两种金属组成的合金,且从80 s开始就出现合金化特征。

图2 Pt-Ir双金属纳米颗粒的SEM照片Fig.2 SEM images of Pt-Ir bimetallic nanoparticles
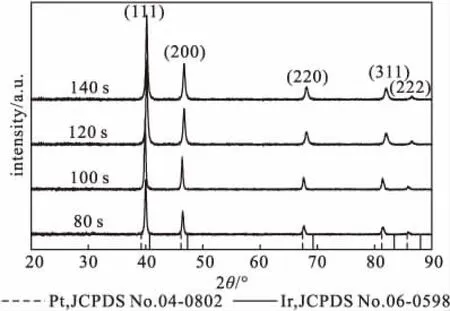
图3 Pt-Ir合金多孔立方体纳米颗粒的XRD图谱Fig.3 XRD patterns of Pt-Ir alloy porous cubic nanoparticles
微波加热不同时间所合成的Pt-Ir合金多孔立方体纳米颗粒的XRD衍射峰数据见表1。
表1微波加热不同时间所合成的Pt-Ir合金多孔立方体纳米颗粒的XRD衍射峰数据/°
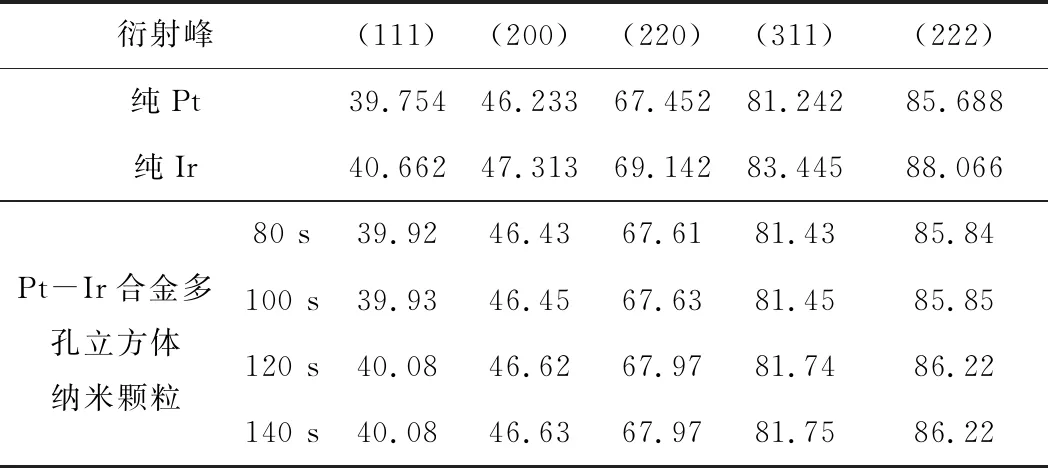
Tab.1 XRD peak data(2θ) of Pt-Ir alloy porous cubic nanoparticles synthesized by microwave heating for different time/°
从表1可知,反应进行到80 s时开始形成合金;随着反应时间的延长,衍射峰逐渐向Ir移动,说明合金中Ir的含量逐渐增加,且Pt先于Ir被还原;反应进行到120 s后,衍射峰不再随反应时间的延长而偏移,说明此时两种金属的相对含量不再发生变化。可见,120 s时反应基本完成。
2.4 XPS分析(图4)
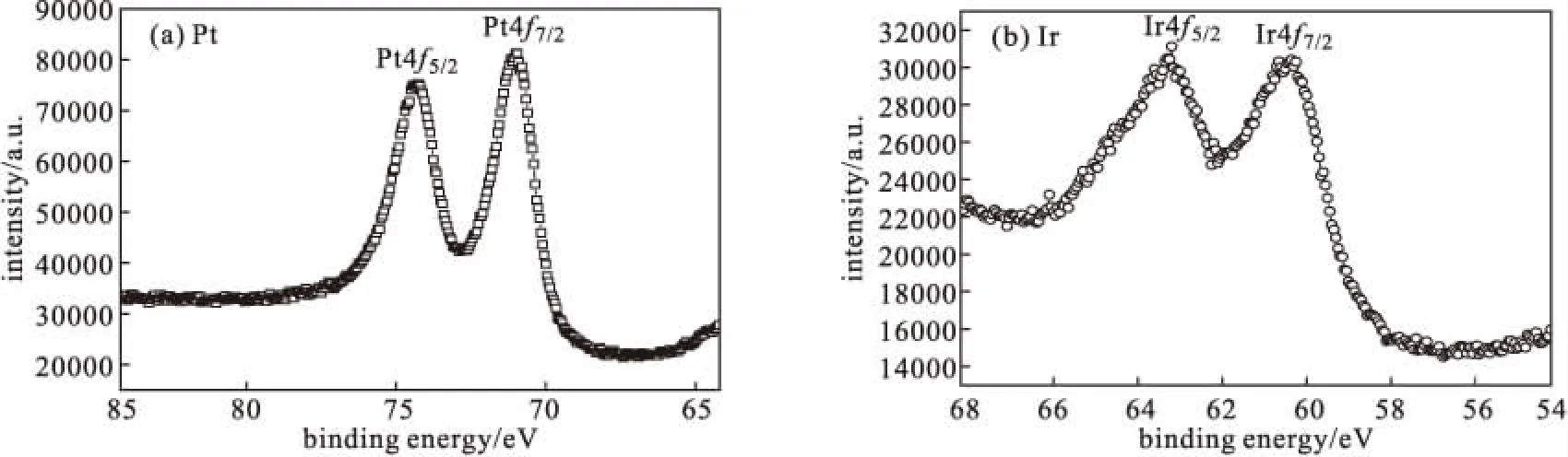
图4 Pt-Ir合金多孔立方体纳米颗粒的XPS图谱Fig.4 XPS spectra of Pt-Ir alloy porous cubic nanoparticles
从图4可以看出,Pt4f5/2、Pt4f7/2的电子结合能分别为74.25 eV和71.05 eV,峰间距为3.20 eV,电子结合能与Pt0的文献值(74.4 eV、71.0 eV)[20]吻合;Ir4f5/2、Ir4f7/2的电子结合能分别为63.75 eV和60.35 eV,峰间距为3.40 eV,电子结合能与Ir0的文献值吻合。表明,所合成的Pt-Ir合金多孔立方体纳米颗粒由Pt0和Ir0组成。
2.5 EDS分析
利用能量色散X-射线光谱仪(EDX)对所合成的Pt-Ir合金多孔立方体纳米颗粒的元素组成进行分析,结果如图5所示。
从图5可以看出,所合成的Pt-Ir合金多孔立方体纳米颗粒由9%(原子百分数)Ir和91%Pt组成。
2.6 Pt-Ir合金多孔立方体纳米颗粒的电催化性能
Pt-Ir合金多孔立方体纳米颗粒及Pt黑分别在0.5 mol·L-1H2SO4与0.5 mol·L-1CH3OH的混合溶液中催化甲醇电氧化的循环伏安曲线如图6所示。
从图6可以看出,Pt-Ir合金多孔立方体纳米颗粒上甲醇氧化峰电势为0.71 V,氧化峰电流密度为4.12mA·cm-2;Pt黑上甲醇氧化峰电势为0.65 V,氧化峰电流密度为1.88 mA·cm-2。根据峰电流的大小可知,Pt-Ir合金多孔立方体纳米颗粒催化甲醇电氧化的活性约为商业Pt黑的2.2倍,即所合成的Pt-Ir合金多孔立方体纳米颗粒的电催化活性明显高于商业Pt黑。
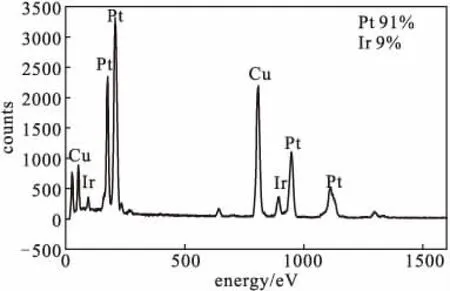
图5 Pt-Ir合金多孔立方体纳米颗粒的EDS图谱Fig.5 EDX spectrum of Pt-Ir alloy porous cubic nanoparticles
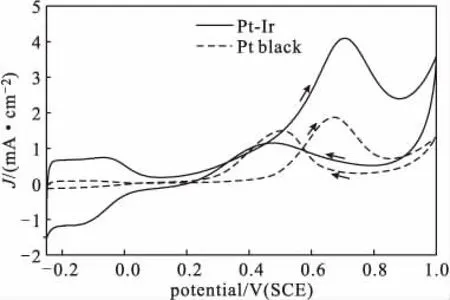
图6 Pt-Ir合金多孔立方体纳米颗粒和Pt黑催化甲醇电氧化的循环伏安曲线Fig.6 CV curves for electro-oxidation of methanol catalyzed by Pt-Ir alloy porous cubic nanoparticles and Pt black
3 结论
采用微波法,以Ir(acac)3和H2PtCl6为原料、TEG为溶剂和还原剂、AA为共还原剂、PVP为稳定剂、适量KI为形貌控制剂,微波加热120 s,成功合成了Pt-Ir合金多孔立方体纳米颗粒。反应物Ir(acac)3∶H2PtCl6∶AA∶KI∶PVP的最适物质的量比为1∶3∶3∶35∶45。Pt-Ir合金多孔立方体纳米颗粒催化甲醇电氧化的活性约为商业Pt黑的2.2倍,电催化活性明显增强。
