一种快速鉴别牛肉中大肠杆菌O157∶H7检测方法的建立及应用
2020-05-08赵亚男曾德新郭德华蒋鲁岩李鑫妮戴建君
赵亚男,曾德新,郭德华,蒋 原,蒋鲁岩,李鑫妮,陈 伟, 汤 芳,薛 峰,戴建君
肠出血性大肠杆菌O157∶H7是一种危害严重的人兽共患病原体,主要通过受污染的食物传播,如牛肉、奶制品、蔬菜和水果[1]。反刍动物,特别是牛,是大肠杆菌O157∶H7的主要宿主[2-3]。虽然大肠杆菌O157∶H7对成年牛没有致病性,但却可以导致人的出血性腹泻、溶血性尿毒症综合征(HUS)以及血栓性血小板减少性紫癜(TTP)。人的感染剂量一般很低,摄入10个活菌就足以引起感染[4-5],幼儿最容易感染这种微生物[6-7]。由它引起的溶血性尿毒综合征可导致红细胞的破坏和肾功能衰竭。据报道,全球平均每年有3 890例溶血性尿毒症病例,死亡人数达230人[8]。自1982年在美国首次被分离出来,并被认为是一种新型的肠道致病菌[9],美国又发生了多起该病的暴发流行[10-11]。此外,加拿大[12]、日本[13]等多个国家相继发生此病原菌引起的暴发感染。我国受此病原菌的威胁也越来越大,自1986年在江苏徐州首次发现以来,福建、甘肃、安徽等省先后自人畜以及其他动物中分离出O157大肠杆菌[14]。
因此,大肠杆菌O157∶H7的检测在食品安全、疾病控制、环境保护等领域受到广泛的关注。鉴于现在主流的检测方法,如国标法金标准,其检测灵敏度高,但工序复杂,检测时间长,并对检测人员要求高[15],使其无法及时预防疫情的暴发;如分子生物学方法,其时效快,成本低,但特异性易受引物、环境等因素影响而产生假阳性或假阴性结果[16]。而基于单克隆抗体的ELISA方法检测病原体具有简单、灵敏度高、特异性好等优点。因此本研究利用抗O157∶H7特异性单克隆抗体2G5及辣根过氧化物酶标记单克隆抗体2E3 (HRP-2E3),建立双抗体夹心ELISA方法,为大肠杆菌O157∶H7提供可靠的检测方法。
1 材料与方法
1.1菌株与抗体 38株O157∶H7和沙门氏菌、志贺杆菌等29株菌种由南京农业大学动物医学实验室保存(见表2),本次实验所用的2株大肠杆菌O157∶H7单克隆抗体(2G5、2E3)的杂交瘤细胞由南京农业大学动物医学实验室筛选获得。
1.2主要试剂与设备 脱脂奶、BSA、Tween 20购自南京鼎思生物技术有限公司,10×PBS购自北京索莱宝生物科技有限公司,TMB单组份显色液、辣根过氧化物酶购自Sigma公司,PCR Kit 购自Takara公司,DNA提取试剂盒购自 TIANGEN公司,新生霉素增菌肉汤购自北京陆桥公司,PCR仪为美国ABI公司,电泳仪、凝胶成像系统均为上海天能公司,酶标仪为西班牙基立福公司。
1.3PCR引物设计与合成 以大肠杆菌O157∶H7的菌体抗原基因rfbE[17-18]为目的基因,参考陈雅君等[19]报道的引物序列(表1),委托金斯瑞生物技术有限公司合成。
表1 rfbE基因引物序列及预计扩增长度
Tab.1 Primer sequence of rfbE and expected amplification length

引物序列(5'-3')扩增长度/bprfbE-FACTACAGGTGAAGGTGGAATG327rfbE-RTTCCTCTCTTTCCTCTGCGGT
1.4单克隆抗体的纯化与标记 冻融实验室存储的单克隆抗体腹水,根据Protein A预装重力柱(上海斯信生物技术有限公司)说明书进行纯化并进行SDS-PAGE分析,测定单抗纯度后冻存于-80 ℃备用。
取纯化后的单克隆抗体2E3,与辣根过氧化物酶(HRP)进行偶联,得到酶标记抗体(HRP-2E3)。采用过碘酸钠法进行标记[20],原理是过碘酸钠将HRP分子表面的多糖氧化为醛基,可与加入的IgG上的氨基形成Schiff氏碱而结合。
1.5双抗体夹心ELISA检测方法的建立 以2G5为捕获抗体,辣根过氧化物酶标记单克隆抗体2E3(HRP-2E3)为检测抗体建立双抗体夹心ELISA 检测方法。具体步骤如下:①抗体包被:将2G5用包被液稀释至一定浓度后包被酶标板,每孔100 μL,4 ℃包被过夜;②封闭:PBST洗涤3次后,每孔300 μL封闭液于37 ℃进行封闭;③加抗原:PBST洗涤3次,拍干,加入待测菌液,每孔100 μL,37 ℃孵育;④加酶标抗体:PBST洗3次,拍干,酶标抗体(HRP-2E3)稀释至适宜浓度后,每孔100 μL,37 ℃孵育;⑤加底物显色:洗板4次,拍干后每孔加入100 μL TMB单组份显色液,置于37 ℃避光显色;⑥终止:用2 mol/L H2SO4终止反应,每孔100 μL,于450 nm波长处测各孔OD值。
为了得到最优检测体系,分别对2G5包被浓度(1∶100、1∶200、1∶400、1∶800),HRP-2E3检测浓度(1∶100、1∶200、1∶400、1∶800)[21],封闭液(1%BSA、2%BSA、10%BSA、1%明胶、2%明胶、5%脱脂奶),最佳封闭时间(60 min、90 min、120 min),抗原作用时间(45 min、60 min、90 min、120 min),酶标抗体作用时间(45 min、60 min、90 min、120 min)以及显色液显色时间(5 min、10 min、15 min、20 min)进行优化。
1.6双抗体夹心ELISA灵敏度的检测 将大肠杆菌O157∶H7培养至对数期(OD600=0.6,平板计数确定浓度为1×108CFU/mL),0.4%甲醛灭活24 h后,用无菌PBS进行10倍比稀释得 10~108CFU/mL浓度菌液,按照已优化好的最佳条件进行双抗体夹心ELISA检测,每个浓度做3孔平行检测,确定灵敏度。
1.7双抗体夹心ELISA特异性的检测 受试菌株包括38株O157∶H7和29株其它菌种,菌浓度均为108CFU/mL,验证建立的双抗体夹心ELISA方法的特异性,同时使用国标方法及PCR方法进行对比验证。
1.8双抗体夹心ELISA重复性的检测 板内重复性检测,选取1×108、1×107、1×106、1×105CFU/mL这4个浓度进行分析,每个浓度做5个重复,计算其板内变异系数。板间重复性检测,选择同样的浓度在5块不同的酶标板上不同时间进行检测,计算其板间变异系数。
1.9 样品检测
1.9.1模拟样品检测 构建人工污染牛肉样品,使用建立的双抗体夹心ELISA检测方法,PCR检测方法和国标培养法对比检测,验证所建立的双抗体夹心ELISA检测方法的实用性。
牛肉样品(购自南京农业大学附近农贸市场),用超纯水冲洗干净后经组织捣碎机加工成肉馅,用国标培养法确定无O157∶H7自然污染后,置于高压灭菌锅内121 ℃灭菌20 min。冷却后,人工污染大肠杆菌O157∶H7,接种剂量分别为104、103、102、10、1 CFU/25 g,每个接种量设置3个平行,并以无菌生理盐水作空白对照,取各浓度剂量人工污染样品和空白无污染样品25 g于 225 mL 新生霉素增菌肉汤,使用拍击式均质器连续均质2 min,在37 ℃,100 r/min摇床增菌培养。
增菌至4、6、8、10 h,分别从各浓度增菌液和空白菌液取3份样品,每份1 mL,800 r/min离心3 min去除沉渣,吸上清,10 000 r/min离心5 min,PBS洗涤3次,重悬后煮沸10 min,用上述建立的双抗体夹心ELISA方法检测;同样取4、6、8、10 h增菌液,每份1 mL,设3个平行对照,PBS洗涤去除油脂和沉渣后,使用TINAGEN试剂盒说明书提取DNA,参考陈雅君等[19]报道的PCR扩增体系进行PCR检测;参照GB 4789.36-2016,增菌24 h后,对不同浓度人工污染样品和空白无污染样品进行国标法检测。
1.9.2实际样品检测 从南京农业大学附近的农贸市场、超市采集100份样品(牛肉40份、猪肉20份、鸡肉20份、鲜奶20份),用已建立的双抗体夹心ELISA方法进行检测,同时采用国标(GB 4789.36-2016)对比检测。
2 结 果
2.1SDS-PAGE检测纯化后2E3、2G5抗体纯度 结果见图1,在50 kDa和25 kDa处分别出现两条蛋白带,它们分别与鼠IgG重链和轻链的分子量相符合,说明纯化效果比较好。

注:M为蛋白Marker;1为纯化前2E3;2为纯化后2G5;3为纯化前2G5;4为纯化后2G5图1 纯化前后2E3、2G5单抗的SDS-PAGE分析Fig.1 SDS-PAGE analysis of monoclonal antibodies (2E3 and 2G5) before and after purification
2.22G5和HRP-2E3工作浓度的测定 方阵法测定结果见表2,基于检测效果和经济性考虑,选择2G5抗体1∶400稀释(4.48 μg/mL),HRP-2E3抗体1∶100稀释(19.9 μg/mL)为最终工作浓度,此时阳性值OD450≈1,P/N值为26.15。
表2 2G5和HRP-2E3工作浓度测定结果
Tab.2 Results of working concentrations of 2G5 and HRP-2E3

酶标抗体HRP-2E3稀释倍数单克隆抗体2G5稀释倍数P值N值1∶1001∶2001∶4001∶8001∶1001∶2001∶4001∶8001∶1001.5171.3421.0640.5090.0380.0650.0400.0581∶2000.3860.3360.3440.2260.0630.0370.0400.0351∶4000.2280.2180.1990.1300.0330.0290.0260.0201∶8000.1620.1890.1510.0900.0500.0320.0330.031
注:P值为阳性样品OD450nm值;N值为阴性样品OD450nm值
2.3最佳封闭液及封闭时间的优化 封闭对ELISA反应至关重要,可以减少非特异性吸附,提高反应的灵敏度及特异性。以阳性孔OD450值与阴性对照孔OD450值之比(P/N值)最大为最优条件,经测定5%脱脂奶为最适封闭液(图2A),1.5 h为最佳封闭时间(图2B)。

注:A最适封闭液的确定;B最佳封闭时间的确定图2 最适封闭液及封闭时间的确定Fig.2 Determination of optimal blocking solution and blocking time
2.4抗原、酶标抗体及显色液作用时间的优化 反应时间的长短会对OD450nm值产生影响,为提高反应的特异性和灵敏度,本次实验分别对抗原、酶标抗体及显色液作用时间进行优化,P/N值最大判定为最优条件。结果如图3所示,抗原、酶标抗体(HRP-2E3)、TMB单组份显色液最佳作用时间分别为90 min(图3A)、45 min(图3B)、10 min(图3C)。

图3 抗原、酶标抗体及显色液作用时间的优化Fig.3 Optimization of reaction time of antigen, enzyme-labeled antibody and chromogenic liquid
2.5双抗体夹心ELISA灵敏度检测 对10~108CFU/mL的8个浓度梯度的菌液进行检测,结果如图4所示,每个浓度做3个平行,随着抗原浓度的降低,检测OD450nm值也随之下降(见图4A),以测定孔与阴性孔OD值之比大于2.1为阳性的判断标准,本方法对大肠杆菌O157∶H7的检测限为 1×105CFU/mL,此时比值为2.21(见图4B)。
2.6双抗体夹心ELISA检测方法的特异性 同时使用建立的双抗夹心ELISA方法、PCR检测法和国标方法对38株大肠杆菌O157∶H7和29株其他菌株进行特异性检测,结果见表3。ELISA检测方法和国标法相同,38株大肠杆菌O157∶H7检测结果显示阳性,其他29株菌株检测结果为阴性,与预期结果一致,显示了高度的特异性。PCR检测法和其他两种方法的检出结果也基本一致,但是温和气单胞菌出现了假阳性结果,可见相比培养法和免疫学检测方法,PCR等分子生物学检测方法在特异性方面还存在一定的弊端。

注:A为每个稀释度的OD450nm值;B为每个稀释度的P/N值图4 双抗体夹心ELISA灵敏度检测Fig.4 Sensitivity test of established double-antibody sandwich ELISA
表3 特异性检测实验结果
Tab.3 Results of specific test

菌株编号数量ELISA检测结果PCR检测结果国标法检测结果大肠杆菌O157∶H7ATCC 438591+++EH1-EH3737+++大肠杆菌ATCC 259221---大肠杆菌O127∶H6AH1-11---大肠杆菌O8AH3-41---大肠杆菌O20AH3-521---大肠杆菌O25JS2-31---大肠杆菌O78JS2-51---大肠杆菌O128JS2-311---大肠杆菌K88JS3-71---沙门氏菌JS 5-31---单核细胞增多李斯特菌ATCC1---铜绿假单胞菌ATCC359231---表皮葡萄球菌ATCC122281---最小弧菌CICC104741---霍乱弧菌BNCC2320301---创伤弧菌CICC103831---
表3(续)

菌株编号数量ELISA检测结果PCR检测结果国标法检测结果奇异变形杆菌CMCC490051---普通变形杆菌CMCC490271---弗氏耶尔森菌ATCC237151---副溶血弧菌ATCC338471---枯草芽孢杆菌NJXW 18050281---志贺杆菌NJXW 18050331---金黄色葡萄球菌NJXW 18050011---嗜水气单胞菌NJXW 18030281---副猪嗜血杆菌NJXW 18011---腊样芽孢杆菌NJXW 17110011---禽分支杆菌NJXW 1305067 1---鸭疫里氏杆菌NJXW 18030011---温和气单胞菌NJXW 18030391-+-链球菌NJXW 17110201---
注:“+”代表阳性,“-”代表阴性
2.7双抗体夹心ELISA重复性检测 由检测结果可知,板内变异系数小于5%(见表4),板间变异系数小于7%(见表5),板间变异系数略大于板内变异系数,可能是由于每天环境条件不同,如温度和湿度变化有关,也可能与溶液的再制备有关,但均小于10%,说明建立的ELISA检测方法具有较好的重复性和精密度[22-23]。
表4 板内重复性检测结果
Tab.4 Results of intraplate repeatability test
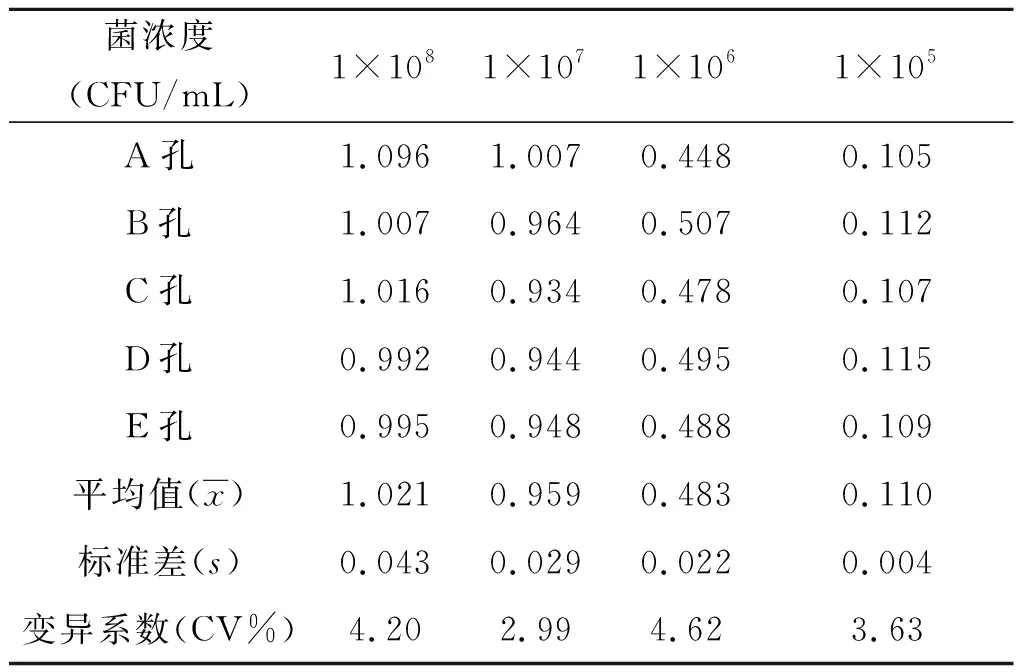
菌浓度(CFU/mL)1×1081×1071×1061×105A孔1.0961.0070.4480.105B孔1.0070.9640.5070.112C孔1.0160.9340.4780.107D孔0.9920.9440.4950.115E孔0.9950.9480.4880.109平均值(x)1.0210.9590.4830.110标准差(s)0.0430.0290.0220.004变异系数(CV%)4.202.994.623.63
表5 板间重复性检测结果
Tab.5 Results of interplate repeatability test
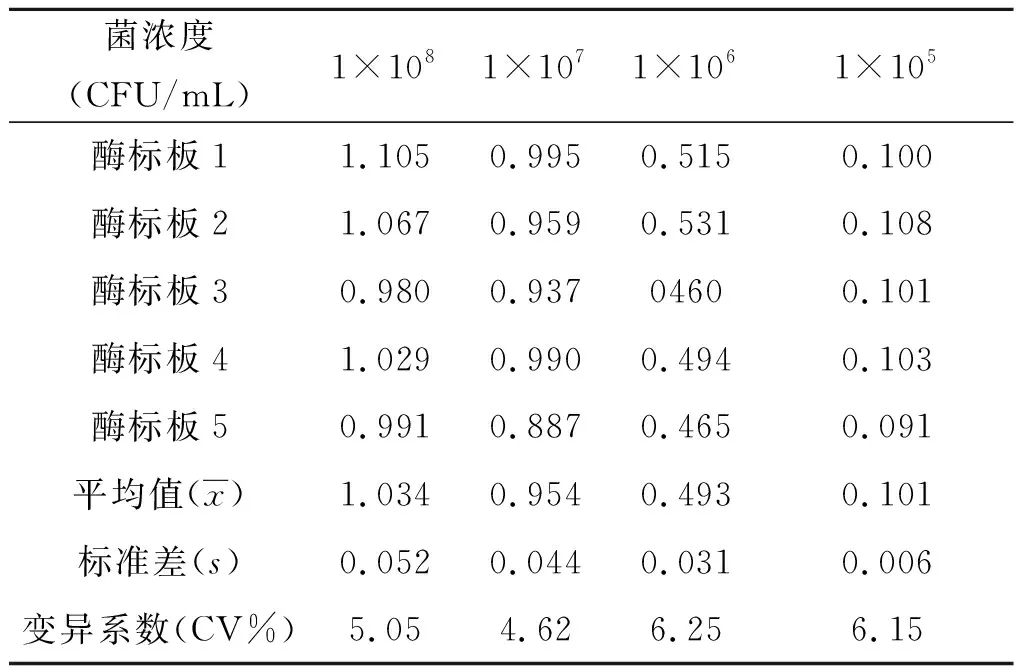
菌浓度(CFU/mL)1×1081×1071×1061×105酶标板11.1050.9950.5150.100酶标板21.0670.9590.5310.108酶标板30.9800.93704600.101酶标板41.0290.9900.4940.103酶标板50.9910.8870.4650.091平均值(x)1.0340.9540.4930.101标准差(s)0.0520.0440.0310.006变异系数(CV%)5.054.626.256.15
2.8 样品检测
2.8.1牛肉模拟样品检测 双抗体夹心ELISA检测结果见表6,以测定孔与阴性孔OD值之比大于2.1为阳性的判断标准,增菌4 h、6 h、8 h、10 h后,检测灵敏度分别为102CFU/25 g、10 CFU/25 g、1 CFU/25 g、1 CFU/25 g。可见经8 h增菌培养后,建立的ELISA检测方法对牛肉中大肠杆菌O157∶H7的检测限可达1 CFU/25 g。
普通PCR检测结果见图5,每个稀释度设3个平行,增菌4 h、6 h、8 h后,检测灵敏度分别为104CFU/25 g、102CFU/25 g、10 CFU/25 g,增菌10 h后,才可检测到1CFU/25 g,且阳性条带较浅。阴性样品均无条带,说明检测过程无污染。该方法增菌8 h后对牛肉样品检测灵敏度只能达到10 CFU/25 g,比ELISA检测降低一个数量级。
按照国标法操作规范对不同浓度污染样品和无污染样品进行检测,经可疑菌落挑选和大肠杆菌O157∶H7干制生化鉴定试剂盒鉴定,各浓度污染样均为检测阳性,且空白样为检测阴性,说明国标培养法检测灵敏度很高,达1 CFU/mL,但是其检测周期较长,需7 d左右,对于有些H鞭毛不易凝集的菌株,其检测周期更长。
表6 牛肉模拟样品检测结果
Tab.6 Results of beef simulation sample test
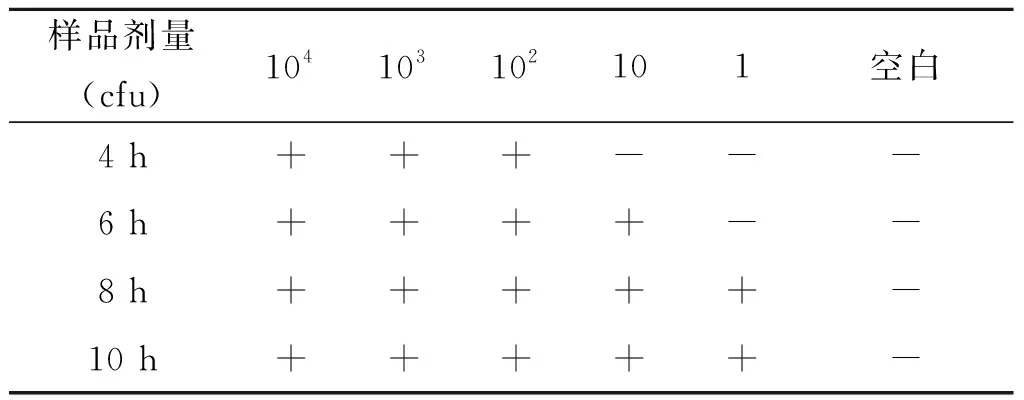
样品剂量(cfu)104103102101空白4 h+++---6 h++++--8 h+++++-10 h+++++-

注:A为增菌4 h;B为增菌6 h;C为增菌8 h;D为增菌10 h;1-3为104 CFU/25 g;4-6为103 CFU/25 g;7-9为102 CFU/25 g;10-12为10 CFU/25 g;13-15为1 CFU/25 g;16-18为阴性样品;19为阳性对照;20为阴性对照图5 样品增菌4、6、8、10 h rfbE基因扩增结果Fig.5 Results of rfbE gene amplification after sample enrichment for 4, 6, 8 and 10 h
2.8.2实际样品检测 用已建立的夹心ELISA检测方法和国家标准方法(GB 4789.36-2016)分别对100份样品进行检测,两种方法结果一致,均为阴性,进一步证明了所建立方法的准确性和实用性。
3 讨 论
大肠杆菌O157∶H7是一种严重的食源性致病微生物,常常引起食品安全事故,威胁着我们的生命安全[24-25]。因此,建立高效、快速的检测方法是预防和及时发现该暴发的关键因素。单克隆抗体因其具有专一的特异性,性质稳定,一经制备可长时间获得等优势而广泛应用于疾病的诊断。因此,本实验利用前期制备的2株抗大肠杆菌O157∶H7单克隆抗体建立夹心ELISA检测方法。该免疫学方法具有灵敏度高、特异性强和检测周期短等优点。
包被是双抗体夹心ELISA实验非常重要的一步,若抗体包被浓度过低,不能完全覆盖固相载体表面,使捕获抗体吸附的抗原量不够,则可能出现假阴性;若包被浓度过高,抗体分子间的相互作用就会造成蛋白分子层叠,在随后的洗涤过程中,这些抗体容易被洗去,影响实验的灵敏度。制得的酶标记抗体需要确定其最适工作浓度,浓度过高,则可使非特异性反应增加,阴性结果偏高;而浓度过低又可影响测定的敏感性。所以本实验通过方阵法,确定了最佳的抗体包被浓度(4.48 μg/mL)和酶标抗体反应浓度(19.9 μg/mL)。
为了验证建立的双抗体夹心ELISA检测方法的实用性,设计人工污染牛肉样品,用ELISA检测法同PCR和国标培养法进行对比检测,从灵敏度、检测时长等因素综合分析,展现其在实际样品检测中的优越性。结果显示,选择性前增菌8 h后,ELISA检测灵敏度可达1 CFU/25 g,比PCR检测高一个数量级。国标法需增菌18~24 h,才可达到1 CFU/25 g的检测灵敏度;而完成整个检测过程,ELISA只需5~6 h,而国标培养法则需要7 d乃至更长时间。由此可见,建立的ELISA检测法集合了国标培养法检测灵敏度高、特异性强和PCR法检测周期短的优点,更能满足实际应用的需求。
本实验建立的双抗体夹心ELISA检测方法对污染样品的检测灵敏度高于吴大成等[14]采用双抗体夹心ELISA的检测方法,增菌培养12 h后,最低检测限为0.4~4 CFU/g;黄海燕等[26]40 ℃增菌8 h检测限为2 CFU,即 0.08 CFU/g;以及宋宏新等[27]增菌14 h,检测线为0.1~0.2 CFU/g。因此,本检测方法具有较好的特异性及灵敏度,可用于实际样品中大肠杆菌O157∶H7检测。
综上所述,本次实验建立的双抗夹心ELISA检测方法特异性、灵敏度、精密度良好,优于国标法及普通PCR检测。但是最近有学者[28]用一种新的方法(纸基夹心ELISA)检测大肠杆菌,该方法检测快速,不需依赖酶标仪等昂贵仪器,整个操作过程不到1 h,并且其最低检测限为1×105CFU/mL,灵敏度较高,可以用于现场即时检测。可以预见如将所建立的ELISA体系应用于纸基微流控芯片,建立纸基夹心ELISA检测方法,将会大大缩短检测的时间及成本,取得更为可观的效果。
利益冲突:无
