脑血管疾病后Holmes震颤的临床、影像和电生理特点
2020-05-08杨硕陈娜潘华翦凡张磊王颖陈琳王恒恒
杨硕,陈娜,潘华,翦凡,张磊,王颖,陈琳,王恒恒
Holmes震颤(Holmes tremor,HT)是一种以低频(通常<4.5 Hz)静止性和意向性震颤为特征,且多伴有姿势性震颤的少见类型震颤。HT的常见病因包括卒中(缺血性或出血性)、肿瘤、脑血管畸形、颅脑外伤等,其中以卒中最常见,约占50%[1]。目前,HT的发病机制尚未完全清晰,但普遍认为由黑质-纹状体通路和小脑-丘脑-皮层/齿状核-红核-橄榄体通路共同作用产生[1-2]。有关HT的研究以个案报道为主,近年来国外有部分回顾性小样本分析,但国内尚缺乏相关研究。本研究对4例HT患者的临床、影像及电生理特点进行回顾性总结,希望有助于临床对此类震颤的认识。
1 研究对象与方法
1.1 研究对象 回顾性分析2015年8月-2019年8月连续就诊于首都医科大学附属北京天坛医院的4例HT患者,对其临床、影像及电生理特点进行总结。HT诊断标准参照1998年国际运动障碍协会制定的震颤共识[3]:①静止性和意向性震颤,多伴有姿势性震颤;②通常低于4.5 Hz;③多于原发病后1~24个月发生。
1.2 研究方法 收集患者的临床信息,包括性别,发病年龄,病因,原发病后HT延迟出现的时间,震颤的侧别(左/右),受累肢体(上肢/下肢),有无偏瘫、失语或感觉异常,有无颅神经受累,治疗方法与转归。
收集患者的头颅MRI信息,包括T1WI、T2WI、FLAIR及DWI序列。
肌电图震颤分析:应用美国Nicolet EDX 6导肌电图仪,包括4对肌电图表面电极和2个压阻加速器(灵敏度:100 μV/D,扫描速度:100 ms/D,肌电低频滤波:10.0 Hz,高频率波:10.0 kHz;加速器低频滤波:0.5 Hz,高频率波:30 Hz)。记录电极分别置于双侧前臂尺侧腕屈肌和尺侧腕伸肌肌腹处,参考电极分别置于相应远端肌腱处,2个加速器分别置于双手背侧第三掌指关节近端2 cm。对静止、姿势、意向及持物1000 g几种状态进行检测:①静止:患者坐于带有扶手的椅子上,前臂置于双侧扶手上,手腕自然下垂,完全放松;②姿势:患者双手向前平伸,手腕伸直;③意向:患者双上肢缓慢重复伸直-指鼻动作;④持物1000 g:患者双手向前平伸,手持1000 g沙袋,手腕伸直。收集震颤峰频率、屈肌及伸肌震颤半宽功率、主动肌与拮抗肌收缩形式。
2 结果
2.1 临床表现与转归 4例HT患者中男性和女性各2例,其中2例由高血压性脑出血引起,另2例分别由脑动静脉畸形和脑海绵状血管瘤破裂出血引起。HT分别于原发病后2个月、1个月、1个月和24个月起病,均表现为病灶对侧肢体抖动,以上肢为主,仅有1例患者同时出现上、下肢抖动。3例患者具有轻偏瘫症状,患侧上肢肌力5-级,健侧上肢肌力5级,下肢肌力4级至5-级。1例患者累及中脑动眼神经核团,表现为左上睑下垂,遮蔽全眼。所有患者均无失语及明显感觉症状,无嗅觉减退、肢体僵硬及运动迟缓。4例中1例未接受任何治疗,3例曾接受普拉克索治疗,均有不同程度缓解,其中1例效果较为明显,自述缓解60%,疗效持续1年,另外2例缓解程度分别为20%和30%,疗效持续时间分别为1和3个月(表1)。
2.2 头颅影像 2例患者病灶仅累及丘脑,MRI提示陈旧性出血软化灶,均表现为右侧丘脑斑片状长T1、长T2信号影(图1A、D);另外2例同时累及丘脑和中脑,MRI表现为混杂T1、T2信号影(图1B、C、E、F)。
2.3 肌电图震颤分析 4例HT患者均进行双上肢震颤分析检测,其中2例完成了意向性震颤检测。震颤峰频率在静止状态为2.6~3.2 Hz;姿势状态为2.8~3.7 Hz;意向状态为3.0~3.7 Hz;持物1000 g状态为2.9~3.8 Hz(表2)。
震颤半宽功率在静止状态为3.53~194.84 mg2/μV2,姿势状态为20.09~443.77 mg2/μV2,意向状态为32.14~152.87 mg2/μV2,持物1000 g状态为20.09~480.46 mg2/μV2。4例患者在静止状态表现为屈肌和伸肌同步收缩,余状态均表现为交替收缩(表3)。
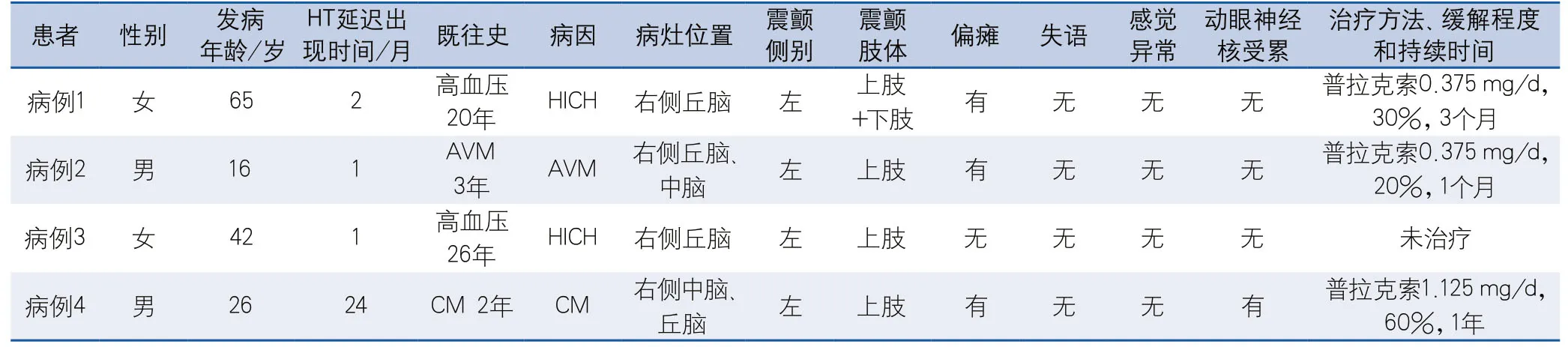
表1 4例Holmes震颤患者临床特点
3 讨论
HT临床相对罕见,1889年Benedikt[4]首次报道一例中脑梗死后此类震颤,此后在红核、丘脑病变患者中也有发现,故HT又称中脑震颤、红核震颤或丘脑震颤,但这些命名均受起病部位限制,不能涵盖疾病的全部可能情况。1904年Gordon Holmes[5]详细描述了此病,此后正式命名为Holmes震颤。本研究通过系统地回顾4例HT患者的临床、影像和电生理资料,并进行相关文献复习,总结如下特点。
临床方面,本研究中4例HT患者2例女性,由高血压性脑出血引起,2例男性分别由脑动静脉畸形和脑海绵状血管瘤破裂出血引起。既往Kilbane等[6]及Alqwaifly等[7]报道中以男性患者多见,主要由脑血管疾病引起,Raina等[1]研究发现女性HT多于男性,48.3%由脑血管疾病引起。可见,脑血管疾病是此病的主要病因,但是关于此病的性别差异目前尚无定论。由于HT多继发于卒中、颅脑肿瘤、脑血管畸形、颅脑外伤等,因此其性别差异应与原发病密切相关。
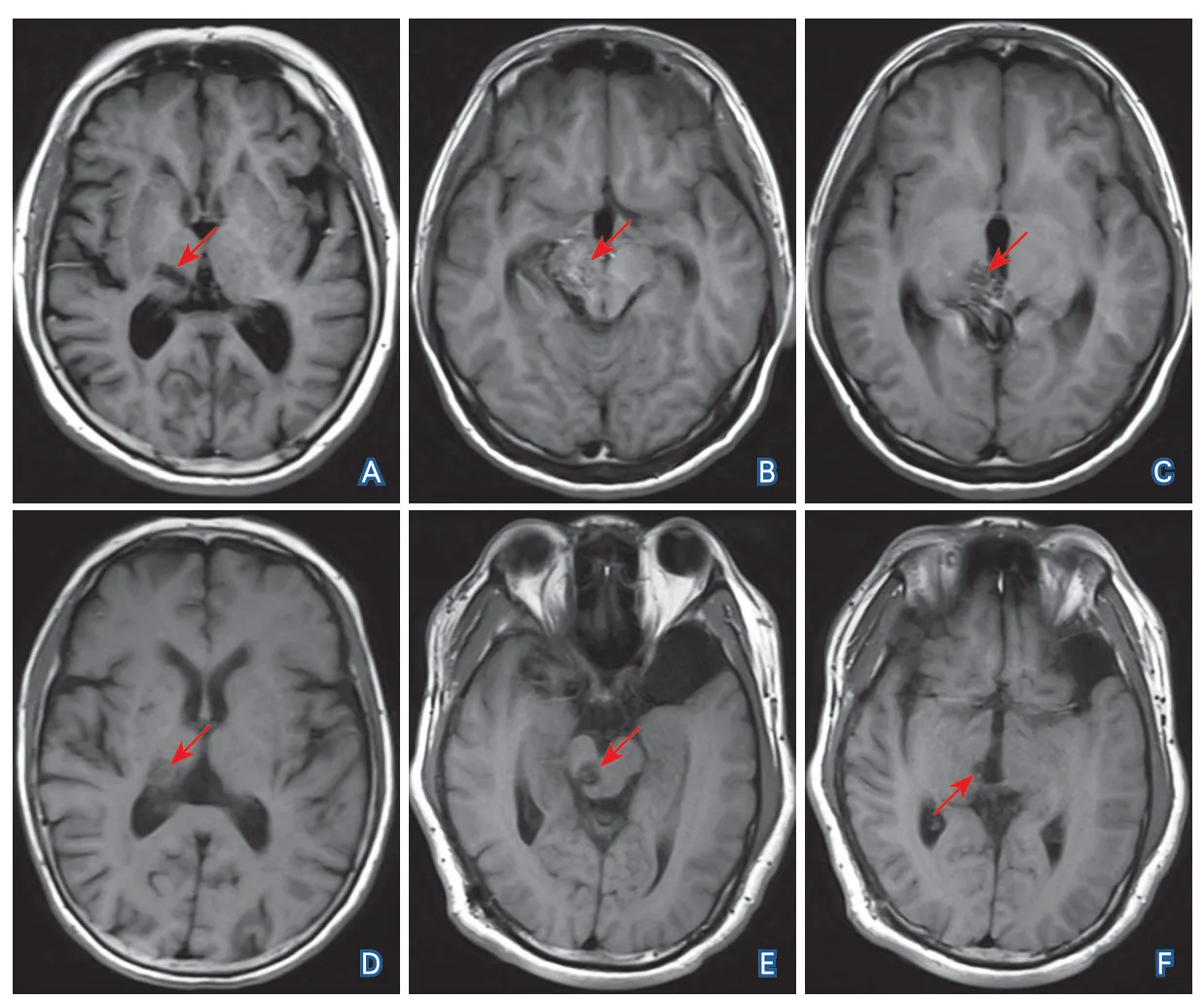
图1 4例Holmes震颤患者头颅T1WI影像学特点
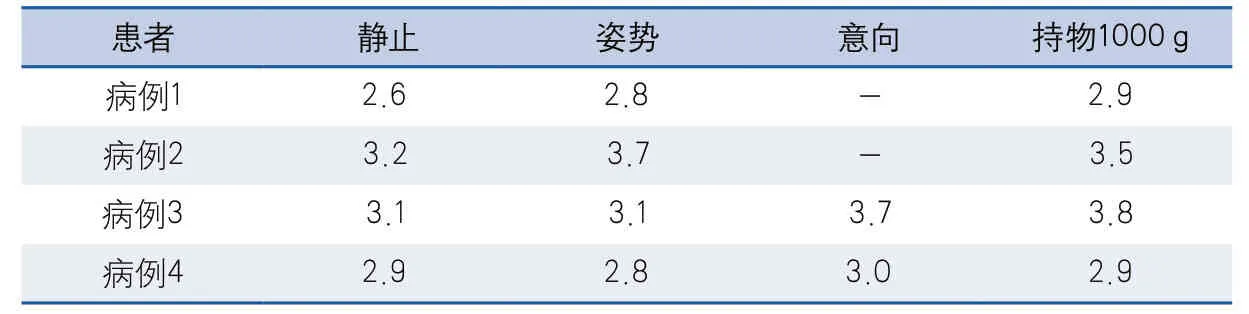
表2 4例Holmes震颤患者上肢震颤峰频率(单位:Hz)
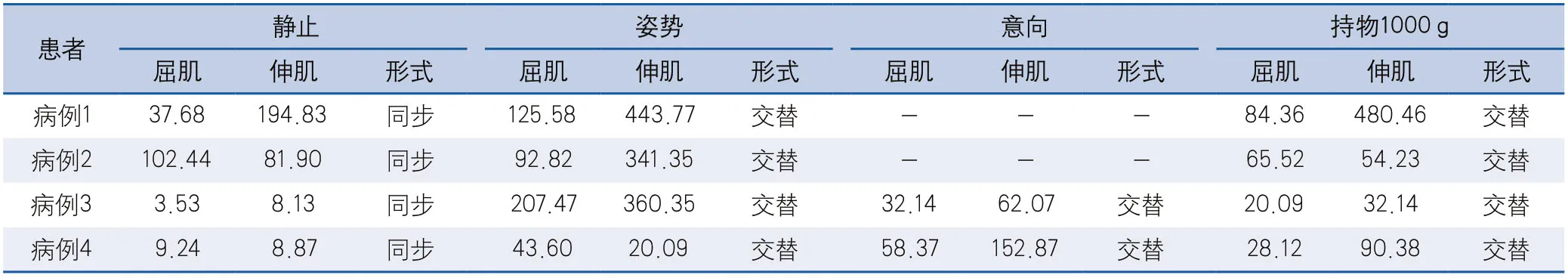
表3 4例Holmes震颤患者屈肌和伸肌震颤半宽功率(单位:mg2/μV2)及肌肉收缩形式
本研究中4例HT患者均于原发病后1~24个月起病,与既往研究平均延迟时间一致[3],但文献报道有部分患者起病时间大于24个月[1,8]。关于HT延迟出现的原因,目前推测可能与中枢通路重塑有关[7,9]。4例患者均表现为原发病灶对侧肢体震颤,其中3例仅出现于上肢,1例同时出现于上、下肢。偏瘫是此病的常见伴随症状,部分患者会伴有颅神经受累,在本研究中上述两种表现的发生比例分别为3/4(75%)和1/4(25%),既往Raina等[1]研究中二者分别为62%和24.1%。治疗上,有3例患者接受普拉克索治疗均有不同程度缓解。目前已有多项报道提出左旋多巴对HT治疗有效,Raina等[1]研究发现13/24(54%)的患者经左旋多巴治疗有效,Boelmans等[10]曾报道1例中脑发育不良所致HT患者,给予低剂量左旋多巴100 mg每天3次治疗,有效性维持长达4年。然而部分病例即使大剂量左旋多巴治疗依旧无效,需要更换治疗方案。Strecker等[11]曾报道1例患者对左旋多巴治疗无效,但是对2.8 mg普拉克索治疗有效,Akkus等[12]也报道过1例左旋多巴无效的患者,经2 mg卡麦角林治疗效果显著。此类药物治疗的有效性间接提示黑质-纹状体通路可能参与HT的发生。对于药物治疗无效的患者,可考虑立体定向丘脑毁损术或脑深部电刺激[13-15]。
影像学方面,本研究中4例患者均进行了MRI检查,2例仅表现为丘脑受累,2例表现为丘脑和中脑同时受累。可见,丘脑和中脑病变是导致HT的主要原因[1,16]。此外,HT还可能由小脑病变引起[17]。随着功能影像的发展,有研究通过PET发现HT患者病灶侧18F-左旋多巴摄取率低于对侧[18],这一结果提示黑质-纹状体通路参与HT的发生。但是Gajos等[19-20]应用SPECT发现病灶侧和对侧显影剂DaTSCAN摄取率在肉眼观时无显著差异,仅在定量评估时存在轻微差异,Joutsa等[21]研究提示HT的发生与小脑-红核-丘脑和苍白球-丘脑环路有关,但也未找到黑质-纹状体通路受损证据。故其发生机制尚未完全明确,有待进一步研究。
电生理方面,本研究中4例患者静止、姿势、意向及持物1000 g状态震颤峰频率在2.6~3.8 Hz,各状态间无明显差异。Bocci等[22]报道的一例患者表现为持物后震颤频率增加,在本研究中尚未观察到此特征。主动肌与拮抗肌在静息时以同步收缩为主,姿势、意向和持物时以交替收缩为主。此外,本研究还对4例患者的震颤半宽功率进行分析,发现各状态下患者的半宽功率差异较大,反映患者震颤幅度高低不一。典型HT多表现为<4.5 Hz的低频震颤,震颤频率的上限与帕金森病震颤频率有部分重叠,以静止性和意向性震颤为主,在2例完善意向性震颤分析的患者中,发现意向状态半宽功率高于静止状态,提示HT患者意向时震颤明显。这是鉴别HT与帕金森病的重要特点之一。
HT多由中脑及丘脑病变引起,以缺血性或出血性卒中为主要病因,常发生于原发病后1~24个月,因此对于中脑及丘脑区脑血管疾病患者应警惕出现HT的可能。如果诊断为HT,可以考虑给予左旋多巴、多巴胺受体激动剂等治疗,疗效不佳者可考虑立体定向丘脑毁损术或脑深部电刺激。