萘醌衍生物的构效关系研究进展
2020-05-07
1.广西中医药研究院,广西 南宁 530022;2.广西中药质量标准研究重点实验室,广西 南宁 530022
萘醌类化合物(Naphthoquinone)是天然醌类化合物中重要的一类化合物,具有多种生物活性,许多萘醌化合物显示出良好的抗肿瘤活性如紫草素、胡桃醌、兰雪醌、维生素K3、沙尔威辛(salvicine)等,萘醌类化合物通常可分为萘茜类(5,8-二羟基-1,4-萘醌)、1,4-萘醌类和1,2-萘醌类等,萘茜及1,4-萘醌分布比较广泛,在夹竹桃属Rauwolfia,凤仙花科Impatiens属,大戟科Jatropha属,胡桃科Carya、Juglans、Platycarya属,百合科Dianella、Stypandra属中都有分布。部分结构如图1所示。萘醌衍生物通过形成醌甲基化衍生物的过程对细胞产生毒性,其机制包括氧化还原循环、芳基化、诱导的DNA链破坏和产生自由基等。目前对萘醌类化合物的结构修饰的目的主要集中在增强萘醌母核的生物活性和降低萘醌母核的细胞毒性。
1 萘茜类
范文海等[1]采用量子化学方法对目前发现两类1,4-萘醌类化合物——紫草素类(shikonin)(1)、阿卡宁类(alkannin)(2)的39个衍生物进行电离能(IP)、电子亲和势(EA)及羟基氢原子解离能(BDE)方面的理论研究,分析各物理量与羟基自由基清除活性之间的关系。并研究了5,7及9位C及14,16位氧的自旋密度及化合物电子亲和势(EA)对其活性的影响。结果表明,化合物侧链的增长及不饱和键的存在均可导致其BDE和IP值的减小,EA值的减小,说明苯氧基自由基自旋密度的增大,有助于其自由基清除活性的增大,表明其抗肿瘤作用的增强。同时,在支链上引入体积较大的官能团以及羟基和乙酰基,会导致化合物的BDE和IP值的增大。SONG 等[2]在5,8-二羟基-1,4-萘醌(3)的基础上合成了6-(1-羟烷基)-5,8-二甲氧基-1,4-萘醌(4)及2-(1-羟烷基)-二甲氧基-1,4-萘醌(5),前者表现出比后者具有更强的与谷胱甘肽反应的活性以及对L1210细胞的细胞毒性,随着进一步的研究表明6-(1-羟烷基)-5,8-二甲氧基-1,4-萘醌引入短链烷基(C2-C6)比引入长链(>C6)时表现出更强的生物活性。并分析出烷基化可以提高萘醌母核的亲电性能,从而增强了与谷胱甘肽反应的活性。
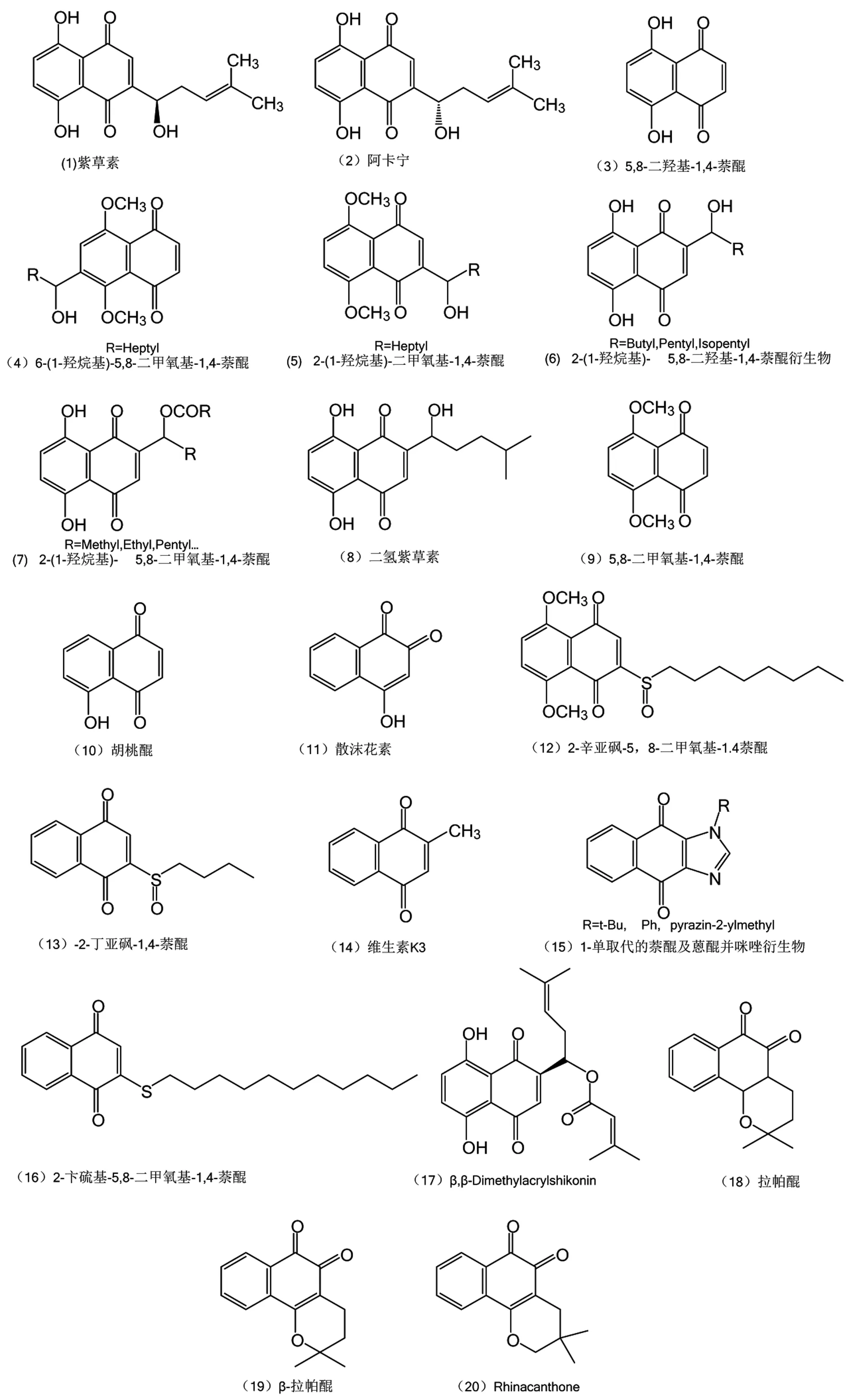
图1 萘醌衍生物的结构式
KYONG-UP等[3]合成了2位取代萘醌衍生物,5,8-二羟基-1,4-萘醌衍生物(DHNQ)以及5,8-二甲氧基-1,4-萘醌衍生物(DMNQ)(如图2所示),并分析了这些衍生物的细胞毒性以及抗S-180癌细胞的活性。一般来说,2-(1-羟烷基)- 5,8-二羟基-1,4-萘醌衍生物(6)比2-(1-羟烷基)- 5,8-二甲氧基-1,4-萘醌衍生物(7)的细胞毒性要强,这表明对细胞的毒性作用主要是氧化还原作用,而不是亲电性造成的。在前述的两类衍生物中的C-1′位置引入烷基和酰基生成2-(1-烷氧基-4-甲基戊基)或2-(1-酰氧基-4-甲基戊基)的衍生物,在引入C-1′引入烷基或酰基时细胞毒性并未得到改善。另一方面,在体内测试中表明,和细胞毒性相比,2-(1-酰氧基烷基)-DHNQ衍生物或者2-(1-烷氧基烷基)-DHNQ衍生物表现出比2-(1-羟基烷基)-DMNQ 或者2-(1-羟基烷基)-DHNQ衍生物具有高的抗肿瘤活性。C-1′的侧链长度决定了其抗肿瘤活性的强度,9到11个碳原子为最佳长度。

图2 5,8-二羟基-1,4-萘醌衍生物(DHNQ)以及5,8-二甲氧基-1,4-萘醌衍生物(DMNQ)的合成
SANKAWA[4]研究证实两个典型的萘茜化合物——二氢紫草素(8)和紫草素在相似的剂量水平上产生较强的抗肿瘤活性,但是二氢紫草素的毒性却增强明显,动物致死率在75%。Youngjae Y等[5]的研究得出:萘醌类对GSH结合物的形成速率、DNA拓扑异构酶-I的抑制作用和对L1210细胞的细胞毒性作用的强弱均遵从如下顺序:5,8-二甲氧基-1,4-萘醌(DMNQ)(9)>6-(1-羟乙基)-DMNQ>2-(1-羟乙基)-DMNQ;分析出了取代基的立体结构是降低其生物活性的主要原因,特别是2-取代物上的取代基的立体结构尤为明显;2-(1-羟乙基)-DMNQ不与GSH和酶反应,而2-(1-羟乙基)-DMNQ通过乙酰化生成的2-(乙酰氧乙基)-DMNQ,其生物活性得到了增强,与GSH和酶形成共轭反应。
SONG等[6]合成了2位和6位酰基化的5,8-二甲氧基-1,4-萘醌(DMNQ)衍生物,研究了各个衍生物对DNA拓扑异构酶-I的抑制作用和对L1210细胞的细胞毒性作用,与2-酰基-DMNQ衍生物相比,6-酰基-DMNQ化合物具有更高的亲电的醌部分结构,在抑制DNA拓扑异构酶I和细胞毒性方面表现出更高的效能,暗示亲电芳基化可能参与其生物活性。在6-酰基-DMNQ衍生物中,具有中等大小的酰基(C5-C9)的衍生物在生物活性方面表现出比其他衍生物更高的效能。此外,为了有效抑制DNA拓扑异构酶I,6-酰化衍生物的酰基部分的大小似乎限制在小于12个碳原子。
2 1,4-萘醌类
KAMEI等[7]在两类1,4-萘醌类化合物——胡桃醌(10)和散沫花素(11)抑制细胞生长的研究发现化合物中酚羟基的个数越多细胞毒性越大。OLIVEIRA等[8]同样在几个1,4-萘醌类化合物——胡桃醌、拉帕醇和散沫花素的基础上合成了4种它们的糖链衍生物,发现糖链的引入有效地避开了细胞对此类细胞毒化合物的排斥,增加了肿瘤细胞的吸收度,从而提高了这些衍生物的活性。PLYTA等[9]通过实验证实萘醌母核2位取代基为供电基团时将会降低对拓扑酶(TOPO-I)的抑止活性,甚至消失,其推测为供电基团使醌母核的亲电性能下降。
SONG等[2]的报道中指出中等长度的碳链(C5-C8)在2或3位引入时,萘醌具有最高活性。邱美玉等[10]利用亲核试剂对α,β-不饱和羰基进行攻击,通过迈克尔加成反应添加硫醇或氨基化合物给萘环的提供电子,并且通过2位的加成反应,将原来结构中的1-羟基-4-甲基戊-3-烯基改变为辛亚砜或辛胺基,精确比较了不同的亲核基团对萘醌类化合物生物活性的影响,结果发现2-辛亚砜-5,8-二甲基-1,4-萘醌(12)可以促进早期ROS水平升高,抑制Akt磷酸化水平,并选择性的激活p38,ERK信号通路,从而抑制肝癌细胞株HepG2细胞增殖,并诱导其发生凋亡。徐宛婷等[11-12]合成了5,8位不含有羟基且2号位的氢被取代基替换的一种新型1,4-萘醌类衍生物-2-丁亚砜-1,4-萘醌(13)(如图3所示),不仅降低了其毒性还提高了抗肿瘤活性,经2-丁亚砜-1,4-萘醌处理过的人恶性黑色素瘤A375细胞,存活率逐渐降低,促凋亡Bad和cleaved-caspase-3表达量逐渐升高,显著增加细胞内ROS水平。

图3 2-丁亚砜-1,4-萘醌的合成
维生素K3(VK3)是是一种1,4-萘醌衍生物(1,Menadione,2-methy[1,4]naphthoquinoline)(14),VK1-3都有抗肿瘤活性,Chen等[13]研究表明肿瘤细胞抑制活性随着VK3衍生物的修饰侧链长度增加而降低,当较短的脂肪侧链的起始位置引入O原子或S原子可以增强化合物的抗肿瘤作用,侧链起始端引入S/O原子,因O原子电负性法,削弱了2,3-双键亲核性的程度高于S原子,保留2-烃硫基团,将碳链从2个碳原子一直延长到11个碳原子,发现碳链超过6个亚甲基的长度没有抑制活性,侧链区域的立体位阻有可能成为与酶亲和力的影响因素。
刘站雄等[14]设计合成了一系列1-单取代的萘醌及蒽醌并咪唑衍生物(15),经细胞毒性实验发现,其中具有大共轭体系和小位阻取代基的1,-甲基蒽醌并咪唑显示出优于此前报道的1,2-二取代萘醌并咪唑衍生物的抗肿瘤活性和选择性,其对乳腺癌细胞和非小细胞肺癌细胞具有很好的抗恶性增殖活性。王昊乾等[15]紫草萘醌的5,8位经过甲基化由紫草素的羟基改为甲氧基,来降低其细胞毒性,并通过2位的加成反应,将原来结构中的1-羟基-4-甲基戊-3-烯基改变为含有不同长度的烷烃或芳香烃的巯基、氨基化合物,其中2-卞硫基-5,8-二甲氧基-1,4-萘醌(16)为表现出细胞毒性,而且可以通过清除自由基,提高机体自由基防御酶系来降低细胞内活性氧水平。
KIM等[16]对化合物2-(1-肟基庚基)-5,8-二甲氧基-1,4-萘醌的药理学性质进行了深入的研究,在对小鼠肉瘤180处理4h后,可以抑制细胞外信号调节蛋白激酶(pERK)的磷酸化,活化细胞应激C-Jun-N间隙激酶(JNK)的蛋白激酶C-α(PKC-α)。Katti等[17]用肉瘤Walker256和白血病P388细胞系对异戊烯酰紫草素(β,β-Dimethylacrylshikonin)(17)及其衍生物进行了筛选。认为这类化合物的作用方式主要是它们的生物烷基化做,侧链α-位的离去基团(-OH)的存在可以使其在生物体内被还原成相应的还原态醌,这个还原态醌通过Michael加成反应发挥烷基化作用[18]。
1,4-萘醌类化合物具有良好的抗炎活性,WURM等[19]经过研究得出结论,邻羟基结构与1,4-萘醌羰基的存在以及指甲花醌的整体平面结构式决定其抗炎活性的关键因素,比如化合物:2-乙基-5-羟基-1,4-萘醌和2-甲基-3-羟基-1,4-萘醌确实具有有效的抗炎活性。Buckle等[20]人设计合成了硝基指甲花醌,通过测试其是一种大鼠被动皮肤过敏反应的有效抑制剂(PCA),其结构可以在C-6和C-7位置进行结构修饰来提高其抑制活性,并且即使通过口服给药之后还能表现出较强的抑制活性。
3 1,2-萘醌类
AHN等[21]研究发现了一种1,2-萘醌类化合物为一类非酸类PTP1B抑制剂,小鼠体内实验证明具有很高的抗高血糖活性。潘咏梅等[22]研究了1,2-萘醌类抑制剂与络氨酸蛋白磷酸酯酶PTP1B之间的相互作用模式发现,在以后的分子设计中,可以适当引入疏水基团,增加抑制剂与PTP1B的结合能力,从而提高活性。于倩[23]对抑制PTP1B的蛋白活性的1,2-萘醌类小分子化合物进行了3D-QSAR研究,得到具有较好预测能力的CoMFA和CoMSIA模型,通过分析模型发现,在R3位引入强的拉电子基团且较小体积的亲水性取代基团,在R6位上引入较大体积的取代基以及R4位的芳基,R7位引入较小体积的取代基,有利于化合物活性的提高。

图4 紫草萘醌衍生物的合成过程
拉帕醌(18)是一类重要的天然1,2-萘醌类化合物,微量提高拉帕醌的抗肿瘤活性,很多研究者对拉帕醌进行了结构修饰,目前对拉帕醌的结构修饰主要集中在三个位点:异戊二烯侧链,羟基和羰基。EYONG等[24]通过2,3-二氯-5,6-二氰基-1,4-苯醌、臭氧和CAN(硝酸铈铵)的氧化反应合成了拉帕醌的衍生物。反应获得的化合物2-(1-甲基乙烯基)-2,3-二氢萘并[2-3]呋喃-4,9-二酮在人前列腺癌细胞(DU-145)中的IC50 = 2.80 μM。
β-拉帕醌(19)是一种生长在阿根廷的紫薇科植物中的天然化合物,有广谱抗癌活性,其发挥抗肿瘤效应主要与胞质黄素酶(NAO1)的特异性激活有关,通过NQO1依赖性的活性氧的形成,诱导NQO1过表达的癌细胞发生死亡[25]。Rhinacanthone(20)则是首次从灌木植物(Rhinacanthus nasutus)中分离得到,泰国民间常用这种植物来治疗癌症、肝炎、皮肤病等[26],β-拉帕醌和Rhinacanthone在结构上的差别仅在于二甲基位置的不同。
丹参酮中也含有1,2-萘醌结构,通常由四个环组成,包括萘或四氢化萘环A和B,一个邻位的或对位醌或内酯环C和一个呋喃或二氢呋喃环D。丹参酮ⅡA对缺血再灌注损伤具有保护作用,沈婉丽等[27]评价丹参酮ⅡA与N-甲基-D-葡萄糖胺反应得到的一种新的水溶性的丹参酮ⅡA衍生物对心肌缺血再灌注损伤的保护作用与机制,结果表明采用丹参酮ⅡA衍生物预处理能显著减少大鼠心肌缺血再灌注损伤引起的心肌炎症浸润及氧化损伤。WU等[28]以丹参酮IIA为母体结构,引入咪唑环,设计合成了一系列丹参酮IIA-咪唑衍生物,并获得了这类分子的晶体结构。进一步的构效关系分析发现,共轭芳香环数量的增加有效提高了丹参酮IIA分子的抗肿瘤活性,其中末端苯环对位给电子取代基的化合物TA12表现出最好的抑制三阴性乳腺癌细胞侵袭转移的活性。并发现TA12能激活ROS的释放并调控PTEN/AKT信号通路,抑制侵袭性伪足的形成,从而有效抑制在斑马鱼移植瘤模型中的乳腺癌细胞的增殖与转移。
4 小结
以上研究结果提示,对属于醌类化合物的萘醌化合物的2、3、8等位点进行结构修饰,引进含N、O、S等杂原子的侧链,有望提高其生物活性、降低毒性、增加选择性,获得良好的抗肿瘤药物候选化合物。另外,对1,2萘醌的研究较少,但从已报道的文献来看,1,2-萘醌为一种潜在的非酸类PTP1B抑制剂,且具有良好的抗肿瘤作用,因此需要更一步的研究,为从天然产物及其衍生物中开发新药的思路提供有力依据。
