三疣梭子蟹C-型凝集素CTL5基因的克隆及在病原刺激下的免疫应答
2020-05-07阎德平吕建建题兴斌张文张云滨宋柳刘萍
阎德平,吕建建,题兴斌,张文,张云滨,宋柳,刘萍*
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023;2.青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071;3.中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室,山东 青岛 266071)
凝集素是一类重要的免疫家族基因,广泛分布于动植物和微生物中,能参与蛋白和核酸、蛋白和脂质、蛋白和蛋白间的反应[1]。动物凝集素最初被划分为C-型凝集素和S-型凝集素两类,其中C-型凝集素是最早发现的种类最多的动物凝集素,可以专一性地识别病原相关分子模式(PAMP),在免疫应答反应中发挥着多种功能,例如微生物凝集、细胞黏附、结节形成和吞噬作用等[2]。近年来,有关海洋无脊椎动物C-型凝集素的相关报道逐渐增多,包括中国对虾Fenneropenaeuschinensis、中华绒螯蟹Eriocheirsinensis、日本对虾Marsupenaeujaponicus等[3-5]。此外,C-型凝集素在甲壳动物中可以参与免疫识别,如凡纳滨对虾Litopenaeusvannamei的CTL4可以参与亚硝酸盐的免疫反应[6];中华绒螯蟹的CTL4可以参与革兰氏阳性菌、革兰氏阴性菌和真菌等微生物刺激下的免疫应答[4]。
三疣梭子蟹Portunustrituberculatus是中国重要的海水养殖经济蟹类,近年来,随着集约化养殖程度的提高和养殖环境的污染,细菌和病毒引起的各种疾病给三疣梭子蟹养殖业带来了严重的经济损失[7-8]。而对虾白斑综合征病毒(White spot syndrome virus,WSSV)和副溶血弧菌是造成梭子蟹发病的主要病原之一,可作为一种免疫刺激剂来刺激梭子蟹,并通过观察梭子蟹组织中基因的表达情况验证基因的免疫功能。到目前为止,三疣梭子蟹中已发现4种不同的C-型凝集素可以参与免疫应答反应,包括CTL1、CTL2、CTL3和CTL4[9-12],并证明该基因家族在三疣梭子蟹免疫中具有重要功能[1]。所在课题组前期通过转录组测序筛选到病原胁迫前后差异表达的C-型凝集素基因,该基因与已公开的梭子蟹凝集素基因序列差异较大,通过序列分析和功能结构域预测,明确其为三疣梭子蟹C-型凝集素家族的新成员。
本试验中基于转录组中的序列,通过RACE技术成功克隆了三疣梭子蟹C-型凝集素CTL5基因(PtCTL5)cDNA全长,并分析了其在不同发育时期、不同组织,以及在副溶血弧菌Vibrioparahemolyticus和WSSV感染后主要免疫组织中的表达模式,旨在为进一步解析C-型凝集素家族基因在三疣梭子蟹免疫中的分子机制提供参考。
1 材料与方法
1.1 材料
试验用三疣梭子蟹来自中国水产科学研究院黄海水产研究所试验基地山东省潍坊市昌邑海丰水产有限公司。2018年8月试验用个体为体质量(30±2)g的80日龄三疣梭子蟹,试验前先将试验蟹放于若干个养殖池(5 m×3 m×1.5 m)中暂养7 d。暂养时水温为(22±0.5)℃,持续供氧,盐度为33,pH为 8.3,每天8:00更换自然海水,换水量为原来水体体积的1/3,定时投放新鲜杂鱼,然后挑选活力、形态均较好的个体进行试验。
分别根据孙颖民等[13]和薛俊增等[14]关于三疣梭子幼体发育不同时期的鉴定方法,在三疣梭子蟹苗种繁育期间采集其幼体发育各期的样品(取3组平行样品),包括卵裂期(N1)、囊胚期(N2)、原肠期(N3)、眼点期(N4)、心跳期(N5)、溞状幼体Ⅰ期(Z1)、溞状幼体Ⅱ期(Z2)、溞状幼体Ⅲ期(Z3)、溞状幼体Ⅳ期(Z4)、大眼幼体期(M)、幼蟹Ⅰ期(C1),并将样品置于液氮中保存备用。
1.2 方法
1.2.1PtCTL5基因全长cDNA的克隆
(1)总RNA提取和cDNA的合成。使用RNAiso Plus试剂,根据说明书步骤分别提取三疣梭子蟹不同发育时期总RNA,采用紫外分光光度计(NanoDrop 2000,Thermo)与10 g/L琼脂糖凝胶电泳等方法,将提取得到的总RNA进行质量和完整性检测。挑选质量好的RNA,将其混合用于制作RACE模板。
5′RACE和3′RACE模板的制备参照SMARTer©RACE 5′/3′Kit(TaKaRa)说明书进行。
(2)引物合成。通过 Primer Premier 6.0软件设计中间片段扩增引物,以及5′和3′所需要的特异性RACE引物,如表1所示,由北京睿博兴科生物技术有限公司进行合成。
(3)PtCTL5 基因片段的克隆。利用引物CTLF/CTLR进行基因中间片段扩增,反应程序为:94 ℃下预变性5 min;94 ℃下循环变性30 s,60 ℃下退火30 s,72 ℃下延伸1 min,共进行35个循环;最后在72 ℃下再延伸10 min,于4 ℃下恒温保存。将扩增得到的PCR产物送交青岛擎科梓熙生物技术有限公司进行测序,然后与转录组测序获得的unigene片段进行比对,确定保守区域的正确性。
使用TaKaRa LA Taq®试剂盒进行PtCTL5基因的3′和5′扩增,先进行第一次PCR扩增,分别使用CTL3 F/CTL5 F和UPM引物进行扩增;然后以第一次PCR扩增的反应产物为模板,分别使用CLT3 S/CTL5 S和NUP引物混合进行第二次PCR扩增。反应程序同上。
将第二次扩增后的PCR产物经DNA切胶回收、pMD 18-T载体连接、转化进入DH5α感受态细胞中,挑取单一菌落利用通用引物M13 F/M13 R(表1)进行菌落PCR初步鉴定,筛选目的菌液送往青岛擎科梓熙生物技术有限公司完成测序。
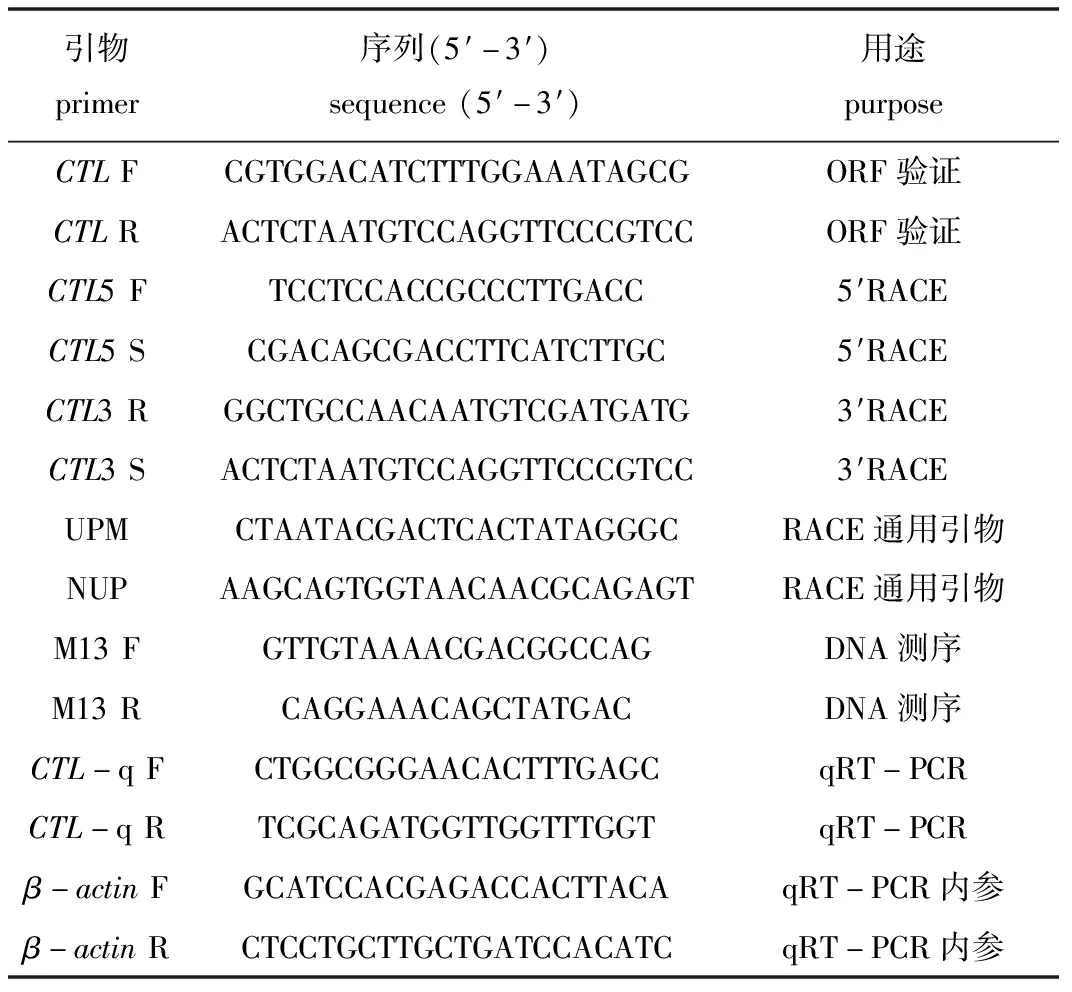
表1 试验用引物及序列
1.2.2 序列分析 使用Vecror NTI 11.0软件去除多余的载体序列,然后将序列正确拼接,将拼接好的目的片段使用国家生物技术信息中心NCBI-BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析。使用Bioedit和Gene Tool预测开放阅读框(ORF),并对编码的氨基酸进行翻译。通过Pfam数据库(http://pfam.xfam.org/search)预测蛋白的功能结构域。通过ExPASy-ProtParam tool(https://web.expasy.org/protparam/)预测蛋白分子量、不稳定性指数、消光系数、脂肪族指数、理论等电点和信号肽。使用MEGA 6.0软件以Neighbor-Joining法构建系统进化树,对PtCTL5氨基酸序列的亲缘关系进行分析。
1.2.3PtCTL5基因在不同发育时期的表达分析 提取三疣梭子蟹幼体不同发育时期的RNA,从中选取高质量的RNA通过Reverse Transcriptase M-MLV(RnaseH)试剂盒合成cDNA,合成的cDNA模板用于后续实时荧光定量PCR。利用Primer 6.0软件设计用于PtCTL5幼体发育不同时期表达分析的荧光定量引物CTL-q F/R,内参基因使用β-actin(表1)。以三疣梭子蟹幼体发育不同时期的cDNA为模板,进行实时荧光定量qPCR扩增。反应体系(10 μL)包括:2×ChamQ Universal SYBR qPCR Master Mix 5 μL,Template cDNA 1 μL,Primer F(10 μmol/L)0.4 μL、Primer R(10 μmol/L)0.4 μL,用ddH2O补足至10 μL。每个样品设3个平行和1个对照,反应程序为:95 ℃ 下预变性30 s;95 ℃ 循环变性5 s,60 ℃ 退火复性34 s,共进行40个循环。
1.2.4 不同病原刺激下的组织及健康组织中PtCTL5 mRNA的表达分析 将暂养7 d后体表完整活力旺的三疣梭子蟹分成生理盐水对照组、WSSV注射组和副溶血弧菌注射组,每组各30只。然后分别于梭子蟹的游泳足第一关节基膜处注射100 μL的生理盐水(0.1 moL/L)、WSSV(浓度为7.6×107CFU/mL)和副溶血弧菌(浓度为3.8×108CFU/mL)[15]。在人工感染后的0、3、6、12、24、48、72 h,从每组分别随机取3只存活三疣梭子蟹的血细胞和肝胰腺样品;另外,随机取暂养7 d后健康的3只三疣梭子蟹,分别取其肝胰腺、心脏、血细胞、眼柄、肌肉、鳃、胸腺、肠、脑等组织样品。来自3只三疣梭子蟹同组织的样品混合成一管,试验同时设3个平行,所有样品于液氮中保存待测。
按照前述的方法分别提取健康三疣梭子蟹9个组织和病原胁迫后各时间点样品的总RNA,逆转录合成cDNA。以稀释后的cDNA为模板,进行实时荧光定量PCR。扩增体系和反应程序同“1.2.3”节不同发育时期的基因表达分析。
1.3 数据处理
对实时荧光定量PCR试验结果数据采用相对标准曲线法2-ΔΔCt法进行相对表达量的计算,计算出平均表达量和标准差,借助SPSS 19.0软件使用独立样本T检验和单因素方差分析对试验数据进行显著性分析,显著性水平设为0.05。
2 结果与分析
2.1 PtCTL5基因序列分析
PtCTL5基因全长1026 bp,包含1个732 bp的开放阅读框,编码243个氨基酸(图1)。预测其带有负性电荷的氨基酸残基为20个(Asp+Glu),带有正电荷的氨基酸残基为15个(Lys+Arg)。
用ExPASy-ProtParam tool 预测其编码的蛋白相对分子质量为26 000,等电点为6.09,不稳定系数为44.42,为不稳定蛋白,蛋白浓度为1 mg/mL时消光系数为2.352,脂肪族系数为67.74。借助Pfam数据库预测分析PtCTL5氨基酸结构特征,结果显示,该氨基酸序列具有C-型凝集素家族典型特征(图2),包括在N末端有1个16个氨基酸的信号肽,第81~229个氨基酸为C-型凝集素特有的碳水化合物识别结构域(CRD),第103~133个氨基酸为FNI结构域,且CRD内含有6个半胱氨酸参与反应,分别为Cys81、Cys104、Cys119、Cys200、Cys220、Cys228。PtCTL5的CRD结构域中决定糖结合特异性的基序是“QPD”(Gln-Pro-Asp),能够与半乳糖和半乳糖的衍生物结合。
2.2 PtCTL5氨基酸序列的相似性及进化树分析
Blast比对结果显示,三疣梭子蟹CTL5氨基酸序列与克氏原螯虾ProcambarusclarkiiCTL的一致性最高,为41.84%。
利用MEGA6.0软件对三疣梭子蟹C-型凝集素CTL5和其他甲壳动物CTL的氨基酸序列进行系统进化树分析,由图3可知,三疣梭子蟹CTL5先单独聚为一支,随后与日本对虾CTL1和凡纳滨对虾CTL6聚为一支,表明其亲缘关系较近,而与三疣梭子蟹的另外4种C-型凝集素CTL1、CTL2、CTL3、CTL4距离较远,即亲缘关系较远。
2.3 PtCTL5基因在发育各时期的表达
三疣梭子蟹幼体不同发育阶段CTL5的表达情况如图4所示。从图4可见:PtCTL5在溞状幼体Ⅲ期的相对表达量最高,大眼幼体期次之,溞状幼体Ⅱ期再次之,且均显著高于卵裂期(P<0.05),PtCTL5基因在溞状幼体Ⅲ期的相对表达量是卵裂期的28.4倍;从卵裂期到幼蟹Ⅰ期,PtCTL5基因的相对表达量显著上调,虽然在眼点期、心跳期和溞状幼体Ⅳ期时的表达量较前一时期有明显的下降,但随着三疣梭子蟹幼体的发育,PtCTL5基因的相对表达量总体呈上升的趋势。
2.4 PtCTL5基因在不同组织中的表达
以β-actin为内参基因,利用q-PCR技术对PtCTL5基因在三疣梭子蟹不同组织中的表达分布进行检测。从图5可见,PtCTL5在三疣梭子蟹9个组织中均有表达,其中,PtCTL5在血细胞中的相对表达量最高,肝胰腺次之,在胸腺中相对表达量最少。
2.5 PtCTL5基因在副溶血弧菌和WSSV感染后的表达响应
利用qPCR技术对病原感染后PtCTL5基因在血细胞和肝胰腺中的表达情况进行检测。从图6可见:注射副溶血弧菌感染后,PtCTL5在肝胰腺和血细胞中的相对表达量均呈一定程度的下调,分别于12、24 h达到最低值,均于48 h后开始上调,72 h时达到峰值且均极显著高于生理盐水对照组(P<0.01),分别为对照组的20.9、5.6倍;注射WSSV感染后,PtCTL5在肝胰腺中的相对表达量在12 h达到峰值,为对照组的9.1倍,12 h后逐渐下降,72 h后达到最低值且与对照组相比无显著性差异(P>0.05),而在血细胞中0~72 h的表达量总体呈上升趋势,72 h时达到峰值且极显著高于对照组(P<0.01),为对照组的48.9倍。
3 讨论
3.1 PtCTL5的序列特征
C-型凝集素在甲壳动物的先天免疫中发挥着重要作用[16]。C-型凝集素一般通过EPD和QPD基序参与糖基分子的结合,EPD可以识别甘露糖,而QPD可以识别半乳糖。三疣梭子蟹CTL5与许多甲壳动物C-型凝集素的结构相似,含有1个CRD结构域、1个QPD基序和6个保守的半胱氨酸残基,表明其应为半乳糖结合型凝集素[17-19]。本研究中,对三疣梭子蟹CTL5和其他甲壳动物C-型凝集素的糖识别结构域(CRD)进行了系统进化树分析,结果发现,三疣梭子蟹CTL5与日本对虾CTL1、凡纳滨对虾CTL6氨基酸序列在进化上距离最近,而与三疣梭子蟹中另外4种C-型凝集素氨基酸序列在进化上距离较远,这表明,CTL5是三疣梭子蟹C-型凝集素家族的新成员。
3.2 PtCTL5 基因的免疫防御机制
本研究中实时荧光定量结果显示,PtCTL5在胚胎及幼体发育过程中均可检测到,推测其在三疣梭子蟹的胚胎和幼体发育中发挥一定的功能。在胚胎发育阶段,PtCTL5的表达量呈先上升后下降的趋势,原肠期达到峰值且显著高于卵裂期(P<0.05)。在溞状幼体发育阶段,PtCTL5的表达量在溞状幼体Ⅲ期达到峰值。特别指出,该基因在幼体发育不同时期的相对表达量与三疣梭子蟹人工育苗过程中幼体的死亡规律相关。如心跳期、溞状幼体Ⅳ期死亡率较高,而该时期PtCTL5基因的表达量也相应较低[19]。推测该基因在胚胎及幼体不同发育期,可能发挥了一定的维持正常发育或抵御外界病原感染的功能。
本研究中,组织表达分布结果显示,CTL5基因在三疣梭子蟹9个组织中均具有分布,其中,在血细胞中表达量最高,肝胰腺中次之,这与对其他甲壳动物C-型凝集素基因的研究结果相似。如三疣梭子蟹CTL1和CTL4基因也在肝胰腺中表达量最高[9,12]。血细胞和肝胰腺是三疣梭子蟹重要的免疫组织,CTL5基因在这两个免疫组织中高表达,暗示其可能发挥重要的免疫功能[8,20]。
为进一步研究PtCTL5在先天免疫中的作用,本试验中利用副溶血弧菌和WSSV两种病原对三疣梭子蟹进行了人工感染试验。结果发现,两种病原感染后PtCTL5基因的表达模式相比对照组均呈现显著的变化,其中副溶血弧菌感染组整体呈先下调后上调的表达趋势,而WSSV感染组整体呈现上调的表达趋势。之前的研究结果表明,甲壳类动物C-型凝集素在受到不同病原感染刺激后会产生不同的免疫应答。例如,日本沼虾MacrobrachiumnipponenseCTL可以加速金黄色葡萄球菌Staphylococcusaureus和副溶血弧菌的清除;中国对虾重组CTL对部分革兰氏阳性菌和革兰氏阴性菌有钙依赖性凝集活性[3,21]。本试验中,根据病原感染后PtCTL5基因的应答情况,推断该基因在三疣梭子蟹对细菌和病毒的免疫防御过程中也发挥了重要的作用。另外,本研究中观察到病原感染后该基因在两个不同的免疫组织中的表达规律不同,表明其在不同免疫组织中发挥功能的通路可能也不同,需要后续进一步解析其潜在的分子机制。
综上所述,本研究中成功克隆了三疣梭子蟹CTL5 cDNA序列全长,发现该基因在三疣梭子蟹各组织和幼体发育不同阶段均有表达,且初步探究了该基因在三疣梭子蟹受到WSSV和副溶血弧菌感染后血细胞和肝胰腺中的表达模式,进一步证实了该基因在三疣梭子蟹免疫应答中发挥了一定的作用,本研究结果可为深入探究C-型凝集素在三疣梭子蟹中的免疫防御机制提供数据支持。
