从2019年版国家基本医保目录的调整浅议医疗机构抗菌药物的分类遴选与使用管理
2020-05-06陈勇川
陈勇川

摘 要 目的:為医疗机构抗菌药物的分类遴选与应用管理提供参考。方法:介绍2019年版《国家基本医疗保险、工伤保险和生育保险药品目录》(以下简称“《新版目录》”)中有关抗菌药物目录的调整情况,对医疗机构抗菌药物遴选调整政策依据和分类遴选原则进行梳理,并对其可能为医疗机构药事管理和临床应用所带来的挑战进行探讨。结果与结论:《新版目录》中抗菌药物新增了3个品种,包括多西环素注射剂、法罗培南颗粒剂和甲硝唑口服常释制剂;调出了9个品规,如四环素口服常释制剂、地红霉素口服常释制剂等;修改了19个品规的适应证和/或适应证的限制范围,如部分抗菌药物要求限用于有明确药敏试验证据或重症感染的患者等。医疗机构对抗菌药物进行分类遴选时应以现有政策文件为依据,严格执行抗菌药物管理有关规定,优先满足国家各种处方集和药品目录品种的要求,遴选循证治疗依据充足且质量和安全保障充分的药品,同时还需兼顾药品使用的方便性、经济性,药品生产、流通企业的供应保障服务能力,以及本地病原菌耐药情况。《新版目录》调整也对医疗机构的抗菌药物应用和管理带来了挑战,例如《新版目录》针对许多抗菌药物品规都强调了“限有药敏证据”,但若临床机械地按照药敏试验结果选药而忽略了抗感染治疗中的经验治疗,也可能会造成另一种“滥用”;此外,有关多粘菌素B和抗敌素(硫酸黏菌素)的适应证限制完全不同的规定也值得进一步考证。
关键词 抗菌药物;国家基本医保目录;医疗机构;分类遴选;管理;合理使用
ABSTRACT OBJECTIVE: To provide reference for classification, selection and management of antibacterial drugs in medical institutions. METHODS: The adjustment of antibacterial drug list in 2019 edition of National Basic Medical Insurance, Work Injury Insurance and Maternity Insurance (called “New List” for short) was introduced. The politic reference of selection and adjustment of antibacterial drugs and the principle of classification selection in medical institutions were sort out. The challenges which may bring to pharmaceutical administration and clinical use in medical institutions were investigated. RESULTS & CONCLUSIONS: Three new varieties of the antibacterial drugs in the New List have been added, including Doxycycline injection, Faropenem granules and Metronidazole oral regular-release preparations. Nine product specifications were excluded, such as Tetracycline oral regular-release preparations, Dirithromycin oral regular-release preparations, etc. The limitation of indications and/or indications of 19 regulations was modified, and some antibacterial requirements were limited to patients with clear evidence of drug sensitivity test or severe infection. When classifying and selecting antibacterial drugs, medical institutions should take the existing policy documents as the basis, strictly implement the relevant provisions of antibacterial drug management, give priority to meeting various national prescription sets and drug list varieties, select drugs with sufficient evidence-based treatment basis, drug quality and safety, and take into account the convenience and economy of drug use, supply guarantee service capacity of drug production and circulation enterprises and local situation of pathogenic bacteria resistance. The adjustment of New List also brings challenges to use and management of antibacterial drugs in medical institutions. For example, New List emphasizes “limited drug sensitivity evidence” for many antibacterial specifications. But if the clinicians choose drugs mechanically according to the drug sensitivity results and ignores the experience treatment in anti-infection treatment, another type of “abuse” may be abused; in addition, the indications of myxomycetin B and colistin (sulfate myxomycetin) are completely different, which also deserves further study.
2019年8月20日,国家医疗保障局与人力资源和社会保障部正式印发了新版《国家基本医疗保险、工伤保险和生育保险药品目录》(以下简称“《新版目录》”),并自2020年1月1日起正式实施[1],原《国家基本医疗保险、工伤保险和生育保险药品目录(2017年版)》(以下简称“《2017年版医保目录》”)同时废止。基于抗菌药物在临床治疗中应用的广泛性和病原菌耐药压力的日益增大,我国历来非常重视医保目录在抗菌药物临床合理应用和管理中的指导作用,因此梳理和了解《新版目录》中抗菌药物的调整和变化将有助于了解和掌握国家对抗菌藥物临床应用的导向,帮助各级医疗机构更好地对抗菌药物进行有效管理。《新版目录》所收录的抗菌药物较《2017年版医保目录》有了较大变化,各级医疗机构也会受此影响在其抗菌药物的临床应用和管理中作出一些相应的调整,同时也可能会面临一些新的问题。为此,笔者在分析《新版目录》中抗菌药物变化的基础上,梳理了医疗机构抗菌药物遴选调整依据和分类遴选原则,并对其可能带给医疗机构抗菌药物管理和临床应用的挑战进行探讨,旨在为医疗机构抗菌药物的分类遴选和应用管理提供参考。
1 《新版目录》中抗菌药物的变化
1.1 新增品规
《新版目录》共新增3个品种,包括多西环素注射剂(限无法使用多西环素口服制剂的患者)、法罗培南颗粒剂(限重症感染的儿童住院患者)和甲硝唑口服常释制剂。但其中法罗培南为目前临床使用的唯一一种青霉烯类抗生素,主要用于产超广谱β-内酰胺酶(ESBL)或产AmpC β-内酰胺酶(AmpC)耐药肠杆菌引起的轻、中度感染。就法罗培南本次增补进《新版目录》且限重症感染的儿童住院患者,笔者认为值得商榷,其原因有:(1)从近年来我国临床细菌耐药数据上并未发现儿童重症感染患者有必须使用法罗培南的特殊情况[2-3];(2)从该药的药品说明书中也可看出,该药的药理学特点也没有针对儿童患者的优势;(3)目前临床现有的品种完全能够满足儿童重症感染患者的治疗需要;(4)国际主流抗菌药物治疗指南也未对此药有该适应证的推荐。
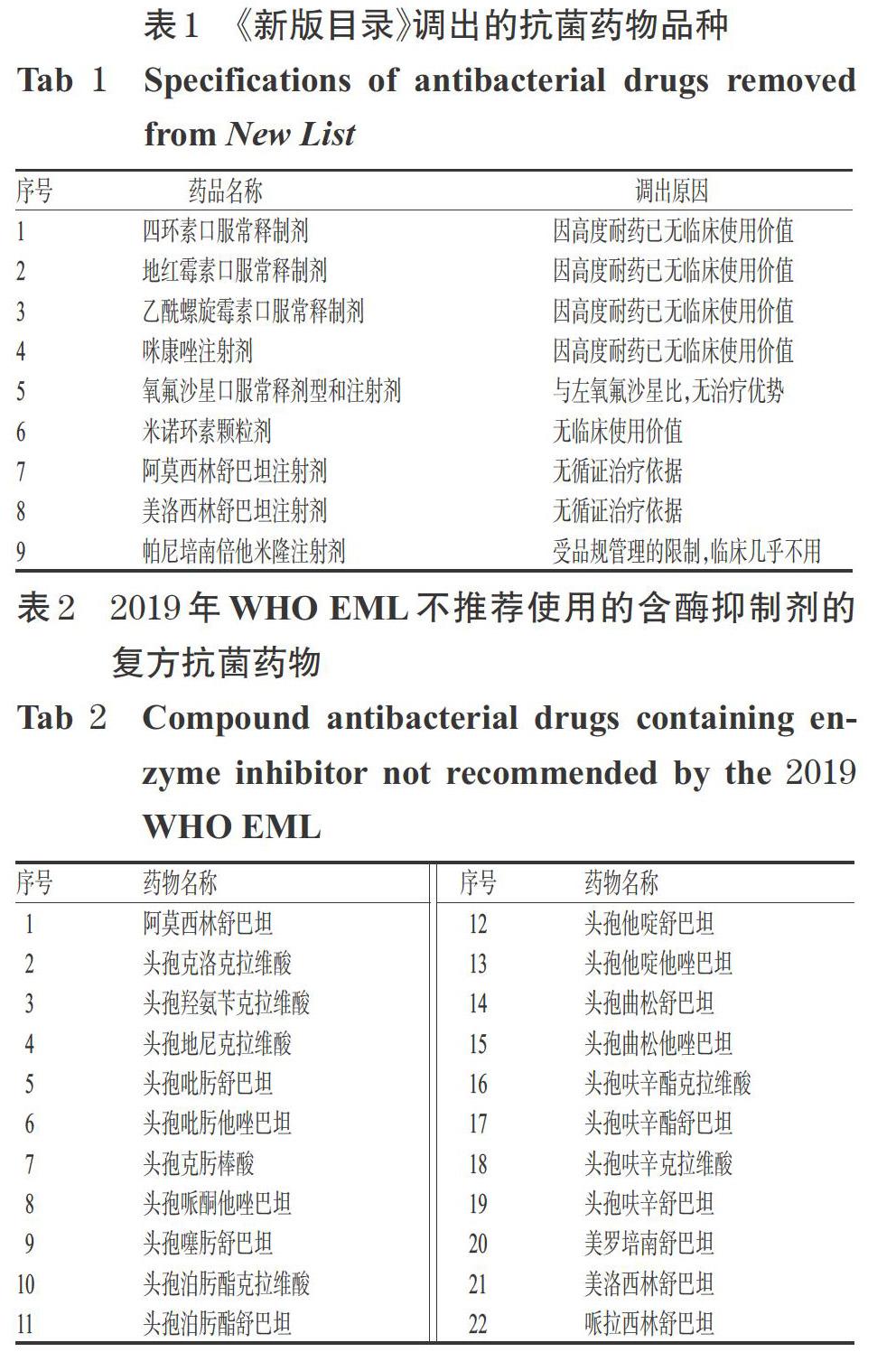
1.2 调出品规
《新版目录》共调出9个品规,具体品规及调出的主要原因详见表1。其中,阿莫西林舒巴坦注射剂和美洛西林舒巴坦注射剂的调出值得一提。众所周知,限于早年我国新药评审制度的缺陷,一些药品研发企业研发上市了不少组方不合理的含酶抑制剂的复方抗菌药物。含酶抑制剂的复方抗菌药物组合的目的主要在于恢复β-内酰胺类抗菌药物对产ESBLs细菌的抗菌活性,而这类细菌主要为肠杆菌科细菌,如大肠埃希菌、肺炎克雷伯菌等,即与β-内酰胺酶抑制剂组成复方制剂的β-内酰胺类抗生素其本身抗菌谱应涵盖肠杆菌科细菌,并且这类细菌的产酶率较高,影响单一β-内酰胺类抗菌药物的临床使用;其次,两种药物的药动学特性应相似、没有药物相互作用等也是组合的重要前提。而不科学的组方导致大量无确切治疗证据支持的复方抗菌药物用于临床治疗,不仅浪费了大量的医疗资源,也加剧了细菌耐药的产生[4]。从国际上临床抗菌药物应用与管理的经验来看,无确切治疗证据支持的含酶抑制剂的复方抗菌药物也是管理的重点。如,被称为全球抗菌药物管理工具的世界卫生组织(WHO)《2019年版基本药物清单》(EML)明确指出,多种广谱抗菌药物固定剂量组合无证据支持,不建议在临床实践中使用(具体药物名称详见表2),这其中就包括在我国临床长期大量应用的阿莫西林舒巴坦、美洛西林舒巴坦及哌拉西林舒巴坦。本次《新版目录》也据此调出了阿莫西林舒巴坦注射剂和美洛西林舒巴坦注射剂,体现了我国相关部门对抗菌药物管理水平的提升。
1.3 适应证的限制和修改
针对具体品种适应证的限制和修改也是《新版目录》调整的重点和难点。例如,《新版目录》将包括哌拉西林舒巴坦、头孢替安、头孢美唑、头孢西丁和头孢米诺注射剂限用于有明确药敏试验证据或重症感染的患者,而这几个品种在某些地区是临床用量极大的“神药”。《新版目录》通过对适应证的限制将有助于减少临床应用循证医学证据不充分的品种,促使临床用药更趋理性。
除此以外,与《2017年版医保目录》相比,《新版目录》没有放宽任何品种的适应证限制,而重点对已有限制条款的19个品种的适应证进行了更严格的限制。整体上凸显了针对各类抗菌药物(特别是限制级别较高的抗菌药物)从严控制应用的管理思路,其目的也是为了应对日益增长的临床耐药现状,减少不必要和不合理抗菌药物的应用频率,尽量避免因“选择性压力”导致的病原菌耐药。《新版目录》中修改了适应证的抗菌药物品种见表3。
2 医疗机构抗菌药物遴选调整的政策依据
按照卫生部《抗菌药物临床应用管理办法》[5]第十九条的规定:“医疗机构应当定期调整抗菌药物供应目录品种结构,调整周期原则上为2年,最短不得少于1年”。该办法明确表明了医疗机构抗菌药物的调整是一个动态过程,需要根据临床药物的实际应用情况和耐药情况适时调整品种,从而更好地满足临床治疗需求并尽可能降低因长期“固化”使用某些品种而导致的“适应性”耐药。该项规定也持续体现在2012年以后国家针对抗菌药物临床应用专项整治活动的若干次通知要求中,如2012年《卫生部办公厅关于继续深入开展全国抗菌药物临床应用专项整治活动的通知》[6]和2013年《卫生部办公厅关于进一步开展全国抗菌药物临床应用专项整治活动的通知》[7]中均明确要求:“建立抗菌药物遴选和定期评估制度……对抗菌药物供应目录进行动态管理”;在2018年《关于持续做好抗菌药物临床应用管理有关工作的通知》[8]中进一步强调落实抗菌药物供应目录调整和备案管理要求,“优化抗菌药物品种品规结构,及时将临床效果确切、经济性好、安全风险低的药品纳入供应目录,逐步淘汰药效动力学特性差、不良反应多和循证医学证据不足的药品”;在2019年《国家卫生健康委办公厅关于持续做好抗菌药物临床应用管理工作的通知》[9]中则再次明确要求:“医疗机构要落实抗菌药物供应目录遴选和评估制度,综合考量新药和新技术应用情况,对抗菌药物供应目录进行科学合理的动态调整。目录调整周期原则上为2年,最短不少于1年,避免无理由地频繁调整供应目录品种。供应目录应当满足临床感染性疾病诊疗需要,杜绝违规应用目录外用药或外购用药情况发生。同时,应当根据临床实际,及时启动供应目录调整,将耐药率高、不良反应多、循证医学证据不足、违规应用突出的药品,清退出供应目录,避免长时间不调整供应目录”。从上述文件中可以看出,国家监管部门反复强调医疗机构抗菌药物目录的动态调整,充分说明医疗机构抗菌药物目录的合理性既是管理的刚性要求,更是临床合理应用抗菌药物的技术要求,应引起医疗机构的高度重视。
3 医疗机构抗菌药物分类遴选原则
尽管卫生部《抗菌药物临床应用管理办法》[5]第二十三条明确规定:“医疗机构应当建立抗菌药物遴选和定期评估制度”,但并未对遴选制度本身提出具体的要求,还需要各医疗机构结合自身工作实际情况进行制订。笔者结合多年从事抗菌药物临床应用与管理的实践经验,现对医疗机构抗菌药物分类遴选的基本原则作一简单梳理。
3.1 严格执行抗菌药物管理有关规定
抗菌药物分类遴选首先须保证品种总体数量和各类别数量符合相關管理规定的要求。例如,要严格控制抗菌药物购用品种和品规数量,保障抗菌药物购用品种、品规结构合理:三级综合医院和儿童专科医院抗菌药物品种原则上不超过50种,二级综合医院、口腔和肿瘤专科医院抗菌药物品种原则上不超过35种,精神病专科医院抗菌药物品种原则上不超过10种,妇产医院(含妇幼保健院)抗菌药物品种原则上不超过40种。同一通用名称注射剂型和口服剂型各不超过2种,具有相似或者相同药理学特征的抗菌药物不得重复采购。头霉素类抗菌药物不超过2个品规;三代及四代头孢菌素(含复方制剂)类抗菌药物口服剂型不超过5个品规,注射剂型不超过8个品规;碳青霉烯类抗菌药物注射剂型不超过3个品规;氟喹诺酮类抗菌药物口服剂型和注射剂型各不超过4个品规;深部抗真菌药物不超过5个品规[7]。
3.2 优先满足国家各种处方集和药品目录品种
《中国国家处方集》《国家基本药物目录》《国家基本医疗保险、工伤保险和生育保险药品目录》是国家层面组织各领域专业人士制定的、最具权威性的、最重要的药品使用参考目录,这些目录的制定充分考虑了患者需求,并兼顾了治疗效果和药物经济学等多方面因素。因此,各级医疗机构抗菌药物的遴选工作均应该以此为参考依据,特别是对于公立医院而言,坚持办院建院的公益性是公立医院服务于广大民众的基本要求,故更应优先选用上述目录中收录的抗菌药物品种。
3.3 药物遴选和推荐应有充分的循证治疗依据
基于证据的治疗是合理用药的基本要求,也是品种遴选的技术核心点。因此,医疗机构在抗菌药物品种的选择上应充分考虑:(1)优先选用各类感染性疾病临床治疗指南推荐的药物;(2)优先选用《抗菌药物临床应用指导原则》推荐的常见手术预防用抗菌药物;(3)尽量选用医疗机构所在地区颁布的抗菌药物分级管理目录之内的药物;(4)在品种分配上尽可能覆盖现有抗菌药物解剖-治疗-化学结构(ATC)分类,兼顾窄谱及广谱的抗菌药[10-11]。
3.4 抗菌药物质量和安全要充分保障
品种选择上优先选择疗效和安全性资料较为充分的药物,尽量不选或少选具有严重药品不良反应(ADR)的药物以及《药品不良反应信息通报》或专业学术期刊上有多次ADR报道的药物。
3.5 兼顾药品使用的方便性、经济性及药品生产、流通企业的供应保障服务能力
在剂型品规的选择上,尽量选择同一通用名下现有剂型、品规较全的药物,以便兼顾特殊人群用药;兼顾品牌、价格以及药品生产、流通企业的保障服务能力,优先选择质量可靠、品牌认可度高且价格有优势的药物;淘汰用量巨大且不合理应用情况多见,药品生产、流通企业供货不及时,售后服务不佳等不良记录较多且整改不到位的品种;兼顾考虑本院临床用药习惯等。
3.6 遴选和调整抗菌药物须参考病原菌耐药情况
按照医疗机构抗菌药物目录调整周期,应参考本院临床近1~2年常见病原菌对抗菌药物的耐药情况,淘汰或替换易引起病原菌快速耐药的抗菌药物,避免选择耐药率高的抗菌药物。对于因自身条件不具备而无法获得本院病原菌耐药流行病学数据的基层医院,可以参考当地可获得的病原菌耐药流行病学数据。特别需要强调的是,针对病原菌治疗的精准选药需依靠准确的病原菌药敏检测报告,因此优先选择美国临床和实验室标准协会(CLSI)有药敏标准的品种也是非常重要的一条原则[12]。
4 讨论
4.1 关于《新版目录》适应证的限制与修改
《新版目录》调整中针对许多抗菌药物品规都强调了“限有明确药敏试验证据”,这对严格控制抗菌药物应用的“随意性”固然是较好的一种管控手段,但如果在临床抗感染治疗工作中过于机械地理解和执行该限制条款,有可能又会造成另一种不合理用药:首先,有些药物无CLSI标准,无法获得药敏数据或部分医疗机构没有条件开展药敏试验;其次,药敏试验结果仅是帮助解答该药能不能用的问题,并不能提示该药是否为最合适的药物,盲目按照药敏试验结果选药反而可能导致另一种“滥用”。机械地按照药敏试验结果选药其本质是忽略了抗感染治疗中必不可少的经验治疗,也是对病原菌培养、药敏试验和抗菌治疗逻辑的错误理解。
4.2 关于多粘菌素B(多粘菌素)与抗敌素(硫酸黏菌素)
《新版目录》中对于多粘菌素B(多粘菌素)注射剂的使用限制为“限有药敏试验证据支持的多重耐药细菌感染的联合治疗”,而对于抗敌素(硫酸黏菌素)注射剂却无任何限制条款。尽管这两个品种在药理学特性上有一定的区别,但在临床治疗定位上,两种药物均限用于各类广泛耐药的革兰氏阴性菌(如泛耐药的鲍曼不动杆菌、泛耐药的铜绿假单胞菌和耐碳青霉烯类的肠杆菌等)引起的各类感染,包括血流感染、呼吸机相关的肺炎(VAP)等,且均不推荐单独应用,常与碳青霉烯类、替加环素、β-内酰胺酶抑制剂、磷霉素等1种或2种药物联合应用。因此,《新版目录》对于上述两个品种的适应证限制完全不同值得相关部门进一步考证。
5 结语
医疗机构抗菌药物的遴选和应用是药事管理的重要工作,也是医疗机构抗菌药物管理的重要抓手,其管理水平的高低将直接影响到临床用药的合理程度。国家基本医保目录的调整变化是顺应医疗改革实践中倡导的“技术的归技术、科学的归科学、监管的归监管”的先进管理理念的具体体现。因此,各级医疗机构在进行抗菌药物目录调整工作时,应该充分理解并掌握国家基本医保目录调整变化的核心内涵,结合临床治疗的实际需求做好目录的遴选与临床应用工作,才能在精细化药事管理工作中充分体现以医疗技术为核心的管理理念,真正体现医疗技术的价值回归。
参考文献
[ 1 ] 国家医疗保障局,人力资源和社会保障部.国家医保局 人力资源社会保障部关于印发《国家基本医疗保险、工伤保险和生育保险药品目录》的通知[Z]. 2019-08-20.
[ 2 ] HU FP,GUO Y,YANG Y,et al. Resistance reported from China antimicrobial surveillance network(CHINET)in 2018[J]. Eur J Clin Microbiol,2019,38(12):2275-2281.
[ 3 ] 郑少微,李萍,张正良,等. 2005-2017年中国CHINET常见革兰阴性菌对碳青霉烯类抗生素耐药的监测结果[J].临床急诊杂志,2019,20(1):40-44.
[ 4 ] 陈勇川,彭永富,张成,等.回顾性分析本院抗菌药使用与G-菌耐药率变化的相关性[J].中国临床药理学杂志,2011,27(4):272-275.
[ 5 ] 卫生部.抗菌药物临床应用管理办法[S]. 2012-05-08.
[ 6 ] 卫生部.卫生部办公厅关于继续深入开展全国抗菌药物临床应用专项整治活动的通知[Z]. 2012-03-05.
[ 7 ] 卫生部.卫生部办公厅关于进一步开展全国抗菌药物临床应用专项整治活动的通知[Z]. 2013-05-06.
[ 8 ] 国家卫生健康委员会.关于持续做好抗菌药物临床应用管理有关工作的通知[Z]. 2018-05-09.
[ 9 ] 国家卫生健康委员会.国家卫生健康委办公厅关于持续做好抗菌药物临床应用管理工作的通知[Z]. 2019-03- 29.
[10] PERAGINE C,WALKER SAN,SIMOR A,et al. Impact of a comprehensive antimicrobial stewardship program on institutional burden of antimicrobial resistance:a 14-year controlled interrupted time series study[J]. Clin Infect Dis,2019. DOI:10.1093/cid/ciz1183.
[11] AKPAN MR,AHMAD R,SHEBL NA,et al. A review of quality measures for assessing the impact of antimicrobial stewardship programs in hospitals[J]. Antibiotics:Basel,2016. DOI:10.3390/antibiotics5010005.
[12] BARLAM TF,COSGROVE SE,ABBO LM,et al. Implementing an antibiotic stewardship program:guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America[J]. Clin Infect Dis,2016,62(10):e51-e77.
(收稿日期:2020-02-04 修回日期:2020-02-22)
(編辑:孙 冰)
