多倍体植物自交不亲和性研究进展
2020-05-06唐碧瑜党江波夏清清崔璐璐赵科科李春秀梁国鲁向素琼
唐碧瑜 党江波 夏清清 崔璐璐 赵科科 李春秀 梁国鲁 向素琼
摘 要 植物自交不亲和性是生殖过程中的重要现象,自发现以来一直是有性植物研究的热点。介绍植物多倍化后的自交不亲和性的变化,分析了植物多倍化后自交不亲和变化机理主要有竞争互作导致自交不亲和崩溃、异等位基因导致自交不亲和崩潰、转座子引起的自交不亲和改变,还有其他影响因素如无融合生殖、近交衰退、花粉管长度、花粉量等,并对自交不亲和性今后的研究方向进行了展望。
关键词 有性植物;自交不亲和性;多倍体
中图分类号:S335.1 文献标志码:C DOI:10.19415/j.cnki.1673-890x.2020.7.012
植物自交不亲和性(Self-incompatibility,SI)与自交亲和性(Self-compatibility,SC)相对应,常见于雌雄同株的开花植物,是植物在受精过程中特异性地识别并拒绝自花或亲缘关系很近的花粉的一种遗传机制,是物种进化的结果[1]。它是一个古老的遗传性状,19世纪中叶伟大的生物学家达尔文就对显花植物的自交不亲和性进行了描述[2]。早在1921年Prell肯定了自交不亲和性是由遗传因素决定的,并且自交不亲和存在着多种复杂的遗传机制[3]。植物自交不亲和性一般是由S位点(S-locus)调控导致的,通常单个S位点具有多个等位基因[4-5]。自交不亲和有自我/非自我识别两个系统,这两个系统由S位点控制,当花粉和雌蕊表达相同的S等位基因时,就会触发自交不亲和反应。自交不亲和性也已被证明是由许多不同的分子机制调节的,这表明有许多独立的起源[6]。不同的物种有不同的S基因,比如茄科(Solanaceae)[7]、蔷薇科(Rosaceae)[8]等主要由S-RNase和SFB/SLF调控,十字花科(Brassicaceae)[9]主要由SLG、SRK、SCR/SP11调控,而罂粟科(Papaveraceae)[10]主要是由PrsS、PrpS调控。之所以说自交不亲和的遗传机制复杂,是因为自交不亲和性不单单是由S位点调控,还有非S位点蛋白共同互作调控,比如十字花科的MLPK[11]、ARCl[12]、Exo70A1[13]、THL1/2[14]、SLR1/SLR2[15]、MOD-MIP[16]等,蔷薇科、茄科等有HT-B[17]、SCF(SKP1-Cullin1-F-box-Rbx1) [18]等。
植物自交不亲和会导致果实少籽,对于果树和收获果实的蔬菜等生产具有良好的价值,但某些植物需要克服自交不亲和性以获得种子资源用于繁殖,因此自交不亲和对物种的进化稳定和植物生产是有利有弊的。自然界存在大量多倍体植物,据统计,被子植物中约有70%高等植物是多倍体。随着人工染色体加倍技术的发展,现已培育出很多人工多倍体植物[19]。自交不亲和性作为有性植物生殖过程中的重要特性,20世纪末就有很多学者在研究植物不同倍性的自交不亲和性,如茄属[20]、矮牵牛属[21]等。多倍体植物由于染色体数目不同于二倍体,基因的剂量也不同,其自交不亲和特性也会发生变化。本文对多倍体植物自交亲和性程度变化和机理的研究进展进行综述,以期为相关研究提供参考。
1 植物多倍体化后自交不亲和性变化
植物多倍体化后自交不亲和性的变化主要表现为其自交不亲和程度降低或增强。有人发现多倍化破坏了许多物种的自交不亲和性[22]。甘蓝是孢子体自交不亲和的十字花科植物,轩淑欣[23]发现四倍体甘蓝自交亲和系数高于二倍体甘蓝,研究认为导致多倍体自交不亲和程度降低的原因可能受SLG和SRK基因的剂量增加而导致了其表达活性的降低,从而使甘蓝四倍体的自交不亲和性程度降低。二倍体的白菜(Brassica rapa)(AA,2n=20)、甘蓝(Brassica oleracea)(CC,2n=18)和黑芥(Brassica nigra)(BB,2n=16)是自交不亲和的,但3个异源四倍体的甘蓝型油菜(Brassica napus)(AACC,2n=38)、埃塞俄比亚芥菜(Brassica carinata)(BBCC,2n=34)和芥菜(Brassica juncea)(AABB,2n=36)是自交亲和的,自交亲和性程度的变化与它们基因组关系密切[24]。同时,Brittany等[25]在拟南芥中发现多倍体及物种洲际扩散会导致自交亲和,由于杂合同源四倍体将产生杂合等位基因和同源等位基因花粉的混合物,自交不亲和性降低。在殖民地种群中发现富集自交亲和个体,似乎介导了其他洲的自交亲和品种。这可以通过全基因组加倍和物种洲际扩散来预测自交不亲和性的改变机理。Robertson[26]证明了茄科的倍性影响其自交亲和性,多倍体会导致自交不亲和崩溃。但也有茄属却有不同的变化,2007年李树贤等[27]发现同源四倍体茄子自交不亲和程度变强,但与S基因及S-RNase的累积无关。当然也不是所有多倍化后自交不亲和程度都会改变,比如薇甘菊二倍体和同源四倍体之间没有观察到明显自交不亲和程度差异[28]。
2 植物多倍化后自交不亲和变化机理
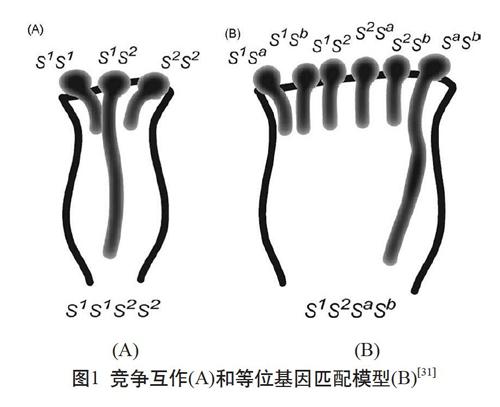
目前,根据大数据分析,70%自交不亲和的二倍体植物多倍化后自交亲和程度发生改变,同源多倍体和异源多倍体的自交不亲和性的改变通常与配子体自交不亲和性崩溃有关,多倍体特别是四倍体中的配子体自交不亲和性崩溃是众所周知的现象[29]。Mable等[30]提出自交不亲和等位基因的独立分离遵循基于四体遗传模型的孟德尔模式,并且很少有证据表明在多个拷贝中发现等位基因的剂量效应,虽然表明某些遗传背景中可能是由于修饰位点的影响,但改变了显性复杂的位点在多倍化后没有经历过多的修饰。植物多倍化后自交不亲和程度降低可能是由于竞争互作导致,也可能是由于异等位基因导致的自交不亲和崩溃[31](见图1),这两个模型普遍存在于配子体自交不亲和植物中。S单倍型被用来描述S位点的变异,而等位基因被用来描述S位点基因的变异[32]。
2.1 竞争互作导致自交不亲和崩溃
竞争互作是由单个花粉管中存在两个不同功能的花粉S基因引起的花粉部分突变,如图1(A)。茄科和车前科都是单个花粉粒具有两个S以上的基因型,多倍化导致配子体自交不亲和(GSI)的改变。已知多倍体茄科和车前科GSI的改变是由竞争互作引起的,如图1(A),如果花柱中存在同源S-RNase,则包含相同S等位基因的花粉粒不能穿柱,而包含两个不同S等位基因的花粉粒可以穿柱[21]。在茄科植物中,异等位花粉具有亲和性,因此多倍体可以很容易从SI向SC的转化。苹果亚科如苹果属和梨属也存在竞争互作模式,Lewis&Modlibowska[33]用苹果亚科的二倍体植株中未分离的二倍体花粉和二倍体植株的同源四倍体花粉都证明竞争互作导致SI变成SC,由于樱桃属和蔷薇科亚科的S位点结构不同,因此苹果属和梨属植物很可能存在与樱桃属不同的竞争互作[34-35]。樱桃属与茄科、车前科不同,多倍体并不直接导致SC,将在下文仔细叙述樱桃属的内部竞争机制。
2.2 异等位基因导致自交不亲和崩溃
异等位基因是单个花粉管中存在两个或两个以上非功能性S基因的花粉引起的花粉部分突变,如图1(B)。樱桃属的种间杂交对研究植物多倍体化后自交不亲和性提供了诸多思路。樱桃属多数是非自我识别的自交不亲和系统,SI由具有多个S等位基因的单个S位点控制。每个S等位基因都携带雌雄特异性决定因素(S决定因子),这些S决定因子之间的相互作用能够区分自我/非自我系统[36]。学者推测樱桃属的SI识别机制可能不同于蔷薇科、苹果亚科、茄科和车前科中的机制。不同的识别机制可能是樱桃属非功能性S基因积累导致自交不亲和原因之一,这就容易导致从SI到SC的转变[33-35]。
酸樱桃是由二倍体甜樱桃和四倍体‘ground樱桃(Prunus fruticosa Pall)杂交产生的四倍体物种,像甜樱桃一样,酸樱桃表现出基于S-RNase的GSI系统,但是天然酸樱桃包括SI和SC类型,表明多倍体本身不会导致SI的分解[37]。一系列遗传和分子研究表明,酸樱桃是异等位基因导致自交不亲和系统崩溃,酸樱桃中SI的基因型依赖性损失是由非功能性S基因的积累引起的[38-39],在酸樱桃2x花粉中存在两个非功能性S基因,使得其呈现自交亲和的现象[37]。Hauck[38]开发和验证了一个模型,证实了酸樱桃中的SC是花粉中存在两个或两个以上非功能性S单倍型引起的,因此酸樱桃是异等位花粉导致SC,如图1(B)。虽然中国樱桃和酸樱桃都有自交亲和材料,但中国樱桃与酸樱桃不同,Huang等[40]得出异穗花粉的竞争互作造成中国樱桃自交亲和,与异等位基因的花粉无关。芸薹属和拟南芥含有非功能性S单倍型,這些单倍型含有编码表现出缺失或重排的非功能等位基因SRK或SCR[41-43]。
2.3 转座子引起的自交不亲和改变
除竞争互作和异等位基因导致自交不亲和崩溃以外,有研究表明转座子的移动也会导致多倍体自交不亲和变为亲和。如甘蓝型油菜从SI到SC的交配系统转变是由插入在BnSP11-1基因启动子中的一个类Helitron转座子引起的,Helitron转座子的移动导致多倍体甘蓝型油菜的交配系统从SI转变为SC,结果提供了转座子在多倍体物种进化中起关键作用的证据[24]。各种转录因子、转座子、启动子等都有可能影响自交不亲和,无论在二倍体还是在多倍体中都需要探索。
3 影响多倍体自交不亲和程度改变的其他因素
多倍体自交不亲和的改变一般与S位点有关,但也有很多其他因素会导致自交不亲和试验的不严谨,比如无融合生殖、近交衰退、花粉管长度、花粉量等其他原因。无融合生殖经常与多倍体相关,四倍体几乎都是通过有性繁殖形成种子,而五倍体到八倍体普遍先发生无融合生殖[44]。三倍体花楸发生无融合生殖,其中存在自交不亲和现象,所以发生种间异花授粉,从而通过有性杂交并促进物种的多样化和进化[45]。二倍体苹果是自交不亲和品种,同源四倍体苹果是自交亲和材料与二倍体苹果自交亲和的突变体材料杂交,自交亲和程度降低,可能是由苹果同源四倍体花粉管更长、花粉量较少的原因导致[39]。
近交衰退,指的是近亲繁殖的有害影响,由于稀有的、隐性的、有害的等位基因增加,通过近交而得到纯合子,也可能导致自交后种子缺乏[28];有研究证明很难区分近交衰退和晚期自交不亲和性[46];异叶菊的二倍体和同源四倍体的自交结籽率低的原因也是在这两者之间[47]。
因此,无融合生殖、近交衰退、花粉管长度、花粉量等其他原因都会影响植物多倍化后的自交不亲和性程度。
4 展望
目前,由于多数植物没有完成全基因组测序,积极发掘和创造多个属及其近缘植物的自交亲和基因资源,了解自交亲和性的遗传规律,进而通过多种途径在自交不亲和材料中获得自交亲和性较强的植物材料,有助于人们对自交不亲和分子机理的深入研究,进一步应用和操控植物的自交不亲和性,从而让此特性更好地用于生产和育种实践。植物中存在诸多多倍体,自交不亲和材料的染色体加倍后的多倍体材料同样能为研究自交不亲和提供良好的试材,但是基因组加倍后基因重组、基因冗余、碱基缺失等都可能使基因表型及性状改变。原本自交不亲和的二倍体材料,基因组加倍后表现出自交亲和性,其分子机制大相径庭,比如四倍体酸樱桃和四倍体中国樱桃都是自交亲和品种,但中国樱桃的自交亲和性是因为S位点竞争互作导致,酸樱桃的自交亲和性则与S位点无关[40]。部分多倍体材料能克服远缘杂交,培育出具有优良性状的材料,如Brennan和Hiscock[48]在孢子体自交不亲和的菊科中用二倍体自交不亲和品种Senecio squalidus和四倍体自交亲和品种Senecio vulgaris杂交得出自交亲和的六倍体品种Senecio cambrensis,得出利用异源杂交得到理想亲本基因组和染色体表达的不同能解决自交不亲和的问题。因此,多倍体材料可为科研育种和繁殖方式创新提供基础材料。植物通过长时间进化而来的自交不亲和特性要得到清晰准确地揭示,需要更多新技术、新材料与新思维等的共同作用来逐步明晰,如Ye等[49]利用CRISPR/Cas9基因组编辑技术对同源四倍体马铃薯Sli基因进行了定点突变,克服马铃薯自交不亲和,培育出自交亲和的二倍体马铃薯,用二倍体杂交种替代同源四倍体,并用实生种子替代薯块繁殖,对马铃薯的育种和繁殖方式进行了颠覆性创新。如果在二倍体与多倍体(尤其四倍体)间自交不亲和性可以自如转换,则自交不亲和特性就可以更好地被利用来为农业生产服务,而解析染色体组成更为复杂的多倍体的自交亲和性如何改变就显得有特别重要的意义。
參考文献:
[1] Nathália S S, Ethiéne G, Raquel L, et al. Self-incompatibility in Habranthus gracilifolius (Amaryllidaceae): pre- and post-pollination barriers[J]. Brazilian Journal of Botany, 2018, 41(2):1-10.
[2] Matton D P, Nass N, Clarke A E, et al. Self-Incompatibility: How Plants Avoid Illegitimate Offspring[J]. Proceedings of the National Academy of Sciences, 1994, 91(6):1992-1997.
[3] Wheeler M, Tong V, Franklin F. The molecular and genetic basis of pollen-pistil interactions [J]. New Phytologist, 2001, 151(3):565-84.
[4] Nettancourt D. Incompatibility in Angiosperms[J]. Sexual Plant Reproduction, 1977, 10(4):185-199.
[5] Hiscock S, Tabah D. The Different Mechanisms of Sporophytic Self-Incompatibility[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2003, 358(1434):1037-1045.
[6] Allen A, Lexer C, Hiscock S. Comparative Analysis of Pistil Transcriptomes Reveals Conserved and Novel Genes Expressed in Dry, Wet, and Semidry Stigmas[J]. Plant Physiology, 2010, 154(3):1347-1360.
[7] Anderson M A, Cornish E C, Mau S L, et al. Cloning of cDNA for A Stylar Glycoprotein Associated with Expression of Self-Incompatibility in Nicotiana Alata[J]. Nature, 1986, 321(6065):38-44.
[8] Sassa H, Nishio T, Kowyama Y, et al. Self-incompatibility (S) alleles of the Rosaceae encode members of a distinct class of the T2/S ribonuclease superfamily[J]. Molecular & General Genetics Mgg, 1996, 250(5):547-557.
[9] Stein J, Howlett B, Boyes D, et al. Molecular Cloning of A Putative Receptor Protein Kinase Gene Encoded at The Self-Incompatibility Locus of Brassica Oleracea[J]. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(19):8816-8820.
[10] Wheeler M, Graaf B, Hadjisif N, et al. Identification of The Pollen Self-Incompatibility Determinant in Papaver Rhoeas[J]. Nature, 2009, 459(7249): 992-995.
[11] Murase K, Shiba H, Iwano M, et al. Membrane-Anchored Protein Kinase Involved in Brassica Self-Incompatibility Signaling[J]. Science, 2004, 303(5663): 1516-1519.
[12] GU T, Mazzurco M, Sulaman W, et al. Binding of An Arm Repeat Protein to The Kinase Domain of The S-Locus Receptor Kinase[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(1):382-387.
[13] Samuel M, Chong Y, Haasen K, et al. Cellular Pathways Regulating Responses to Compatible and Self-Incompatible Pollen in Brassica and Arabidopsis Stigmas Intersect at Exo70A1, a Putative Component of the Exocyst Complex[J]. Plant Cell, 2009, 21(9): 2655-2671.
[14] Bower M, Matias D, Fernandes-Carvalho E, et al. Two Members of The Thioredoxin-H Family Interact with The Kinase Domain of A Brassica S Locus Receptor Kinase[J].The Plant Cell Online, 1996, 8(9):1641-1650.
[15] Boyes D, Chen C, Tantikanjana T, et al. Isolation of A Second S-Locus Related Cdna from Brassica Oleracea: Genetics Relationships Between The S-Locus and Two Related Loci[J]. Genetics, 1991, 127: 221-228.
[16] Fukai E, Nishio T, Nasrallah M. Molecular Genetic Analysis of The Candidate Gene for MOD, A Locus Required for Self-Incompatibility in Brassica Rapa[J]. Molecular Genetics & Genomics, 2001, 265(3):519-525.
[17] Goldraij A, Kondo K, Lee C , et al. Compartmentalization of S-Rnase and HT-B Degradation in Self-Incompatible Nicotiana[J]. Nature, 2006, 439(7078):805-810.
[18] Minamikawa M, Koyano R, Kikuchi S, et al. Identification of SFBB-Containing Canonical and Noncanonical SCF Complexes in Pollen of Apple (Malus × Domestica) [J]. Plos One, 2014, 9(5):e97642.
[19] 刘祖洞.遗传学下册[M].北京:高等教育出版社,1991.
[20] Hosaka K, Hanneman R. Genetics Of Self-Compatibility in A Self-Incompatible Wild Diploid Potato Species Solanum Chacoense.2.Localization Of An S Locus Inhibitor (Sli) Gene on The Potato Genome Using DNA Markers[J]. Euphytica, 1998, 103(2): 265-271.
[21] Entani T, Takayama S, Iwano M, et al. Relationship between Polyploidy and Pollen Self-incompatibility Phenotype in Petunia Hybrida Vilm[J]. Bioscience, Biotechnology & Biochemistry, 1999, 63(11):1882-1888.
[22] Richards A. Plant Breeding Systems || Pollination biology and gene flow[J]. Plant Breeding Systems,1997(1):147-199.
[23] 轩淑欣,张成合,申书兴,等.甘蓝自交不亲和系同源四倍体的获得及其亲和性[J].农业生物技术学报, 2005,13(2):258-259.
[24] Gao C, Zhou G, Ma C, et al. Helitron-like transposons contributed to the mating system transition from out-crossing to self-fertilizing in polyploid Brassica napus L. [J]. Scientific Reports, 2016, 6(1):33785.
[25] Brittany L, Brandie M, Laura F. Intercontinental dispersal and whole-genome duplication contribute to loss of self-incompatibility in a polyploid complex[J]. American Journal of Botany, 2018, 105(2):249-256.
[26] Robertson K, Goldberg E, Igic B. Comparative Evidence for The Correlated Evolution of Polyploidy and Self-Compatibility in Solanaceae[J]. Evolution, 2010, 65(1):139-155.
[27] 李樹贤,吴志娟,赵萍.同源四倍体茄子自交亲和性遗传的初步分析[J].西北农业学报, 2007,16(6):170-173
[28] Soltis R. Pollen tube growth and self-incompatibility in Heuchera micrantha var. Diversifolia (Saxifragaceae)[J]. International Journal of Plant Sciences, 1999, 160(6): 1157-1162.
[29] Golz J F, Su V, Clarke A, et al. A Molecular Description of Mutations Affecting The Pollen Component of The Nicotiana Alata S Locus[J]. Genetics, 1999, 152(3): 1123-1135.
[30] Mable B, Beland J, Di Berardo C. Inheritance and Dominance of Self-Incompatibility Alleles in Polyploid Arabidopsis Lyrata[J]. Heredity, 2004, 93(5): 476-486.
[31] Tao R, Iezzoni A . The S-RNase-based gametophytic self-incompatibility system in Prunus exhibits distinct genetic and molecular features[J]. Scientia Horticulturae (Amsterdam), 2010, 124(4):423-433.
[32] Yamane H, Tao R. Molecular Basis of Self-(in)compatibility and Current Status of S-genotyping in Rosaceous Fruit Trees[J]. Journal of the Japanese Society for Horticultural Science, 2009, 78(1):137-157.
[33] Lewis D, Modlibowska I. Genetical Studies in Pears IV. Pollen-Tube Growth and Incompatibility[J].Genetics, 1942,43: 211-222
[34] Adachi Y, Komori S, Hoshikawa Y, et al. Characteristics of Fruiting and Pollen Tube Growth of Apple Autotetraploid Cultivars Showing Self-Compatibility[J]. Engei Gakkai zasshi, 2009, 78(4):402-409.
[35] Sassa H, Kakui H, Minaanikawa M. Pollen-expressed F-box gene family and mechanism of S-RNase-based gametophytic self-incompatibility (GSI) in Rosaceae[J]. Sexual Plant Reproduction, 2009, 23(1):39-43.
[36] Fujii S, Kubo K, Takayama S. Non-self- and self-recognition models in plant self-incompatibility[J]. Nature Plants, 2016, 2(9):16130.
[37] Hauck N, Yamane H, Tao R, et al. Self-compatibility and incompatibility in tetraploid sour cherry(Prunus Cerasus L.)[J]. Sexual Plant Reproduction, 2002, 15(1): 39-46.
[38] Hauck N, Ikeda K, Tao R, et al. The Mutated S1-Haplotype in Sour Cherry Has an Altered S-Haplotype-Specific F-Box Protein Gene[J]. Journal of Heredity, 2006, 97(5): 514-520.
[39] Tsukamoto T, Potter D, Tao R, et al. Genetic and molecular characterization of three novel S-haplotypes in sour cherry(Prunus cerasus L.)[J]. Plant Molecular Biology, 2008, 59(11): 3169-3185.
[40] Huang S X, Wu H Q, Li Y R, et al. Competitive Interaction Between Two Functional S-Haplotypes Confer Self-Compatibility on Tetraploid Chinese Cherry (Prunus Pseudocerasus Lindl.Cv.NanjingChuisi)[J]. Plant Cell Reports, 2008, 27(6): 1075-1085.
[41] Boggs N, Dwyer K, Nasrallah M, et al. In Vivo Detection of Residues Required for Ligand-Selective Activation of the S-Locus Receptor in Arabidopsis[J]. Current Biology, 2009, 19(9):786-791.
[42] Shimizu K K, Rie Shimizu‐Inatsugi, Tsuchimatsu T, et al. Independent origins of self-compatibility in Arabidopsis thaliana[J]. Molecular Ecology, 2008, 17(2): 704-714.
[43] Dwyer K, Berger M, Ahmed R, et al. Molecular Characterization and Evolution of Self-Incompatibility Genes in Arabidopsis thaliana: The Case of the Sc Haplotype[J]. Genetics, 2013, 193(3):985-994.
[44] Dobe? C, Lückl A, Hülber K, et al. Prospects and limits of the flow cytometric seed screen-insights from Potentilla sensu lato (Potentilleae, Rosaceae)[J]. New Phytologist, 2013, 198(2):605-616.
[45] Ludwig S, Robertson A, Rich T, et al. Breeding systems, hybridization and continuing evolution in Avon Gorge Sorbus[J]. Annals of Botany, 2013, 111(4):563-575.
[46] 郝祎祺,赵鑫峰.被子植物早期近交衰退与晚期自交不亲和[J].生物多样性,2011(1):110-116.
[47] Ness B, Soltis D, Soltis P. Autopolyploidy in Heuchera Micrantha (Saxifragaceae)[J]. American Journal of Botany, 1989, 76(4):614-626.
[48] Brennan A, Hiscock S. Expression and inheritance of sporophytic self-incompatibility in synthetic allohexaploid Senecio cambrensis(Asteraceae)[J]. New Phytologist, 2009, 186(1):251-261.
[49] Ye M, Peng Z, Tang D, et al. Generation of self-compatible diploid potato by knockout of S-RNase[J]. Nature Plants, 2018(9):651-654.
(責任编辑:易 婧)
收稿日期:2019-12-02
基金项目:国家自然科学基金项目(31272138);重庆市社会民生科技创新项目(cstc2016shmszx12080003)。
作者简介:唐碧瑜(1995—),女,重庆涪陵人,西南大学园艺园林学院细胞生物学2017级在读硕士研究生,研究方向为细胞遗传。
E-mail: tangby8023@163.com。
※为通信作者,E-mail: xiangsq@swu.edu.cn。
