家蝇三龄幼虫Clip-Msp基因克隆及白假丝酵母菌刺激下的时空表达*
2020-05-06常振策李忠旬修江帆卢成贾利娜国果吴建伟
常振策,李忠旬,修江帆,卢成,贾利娜,国果,2,吴建伟,2***
(1.贵州医科大学 贵州省普通高等学校现代病原生物学特色重点实验室,贵州 贵阳 550025;2.贵州医科大学 寄生虫学教研室,贵州 贵阳 550025)
家蝇(Muscadomestica)携带多种病原体后仍能正常生存和繁殖,得益于其强大的先天免疫系统[1-4],因此,家蝇可作为先天免疫研究的理想模型[5-6]。近年来,家蝇的免疫相关功能基因的生物学功能已经成为研究热点,核酸转录水平分析其表达模式是研究功能基因的第一步。Clip-丝氨酸蛋白酶超家族属于非消化性蛋白酶家族,参与昆虫的先天免疫和生长发育[7]。本课题组前期研究发现,家蝇幼虫感染白假丝酵母菌后Clip-丝氨酸蛋白酶基因(clip-serine protease gene ofmuscadomestica,Clip-Msp)表达水平增高,认为该基因与家蝇抗C.albicans感染相关[8]。目前,家蝇Clip-丝氨酸蛋白酶基因克隆表达报道甚少,也未见家蝇幼虫感染白假丝酵母菌后Clip-丝氨酸蛋白酶基因时空表达的相关研究。为了初步探索Clip-Msp基因在家蝇抗C.albicans感染过程中的免疫功能,本研究通过克隆家蝇Clip-Msp基因,并分析Clip-Msp基因在C.albicans刺激家蝇幼虫后的时空表达谱,为进一步研究Clip-Msp基因的分子功能和家蝇的免疫应答奠定基础。
1 材料与方法
1.1 材料
1.1.1动物、质粒和菌株 家蝇(Muscadomestica)三龄幼虫为本课题组饲养,克隆感受态E.coliDH5α购自北京全式金公司,克隆载体pMD19-T购自Takara公司。
1.1.2主要试剂及仪器 Trizol Reagent、PrimeScriptTMOne Step RT-PCR Kit、基因克隆相关试剂、氨苄青霉素、SYBR Premix Ex TaqTM II (Perfect Real Time)试剂盒均购自Takara公司,固相RNase清除剂和组织RNA保存液均购自Solarbio公司。使用仪器有核酸凝胶电泳装置及成像系统,显微超微量注射仪,ABI PRISM 7300,Nanodrop2000。
1.2 方法
1.2.1pMD19-T/Clip-Msp克隆载体的构建 按照Trizol说明书提取家蝇三龄幼虫总RNA,然后以总RNA为模板,按照PrimeScriptTMOne Step RT-PCR Kit逆转录合成cDNA,作为Clip-Msp基因克隆时PCR扩增的模板。42 ℃时2 min,冰浴5 min基因组中的DNA。逆转录反应条件:37 ℃ 20 min、85 ℃ 10 s、4 ℃ 10 s。在Primer 5.0上设计Clip-Msp基因的克隆引物(SkF、SkR),由上海生工合成。Clip-Msp基因克隆上游引物(SkF)为ATGTATACAAAAATGCAAG,下游引物(SkR)为TCACTTTGAACCTTCGCCGCTATT。Clip-Msp基因PCR扩增的反应条件:94 ℃ 5 min预变性,94 ℃ 30 s、57 ℃ 30 s、72 ℃ 1 min,30个循环;72 ℃最后延伸10 min。PCR产物用DNA凝胶试剂盒纯化回收,在16 ℃将纯化的PCR产物和pMD19-T载体连接12~16 h,将pMD19-T/Clip-Msp转化至E.coliDH5α克隆感受态细胞中,LB平板(含氨苄青霉素100 mg/L)筛选阳性转化子,转接液体培养后提取重组质粒进行测序鉴定。
1.2.2生物信息学分析 运用DNAMAN V6.0软件分析Clip-Msp基因的开放阅读框及氨基酸序列;在SignaIP4.1(http://www.cbs.dtu.dk/services/SignalP/)网站上分析Clip-Msp蛋白信号肽位点,在TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0)上分析Clip-Msp蛋白跨膜区,在SMART(http://smart.embl-heidelberg.de)上分析Clip-Msp蛋白功能结构域。
1.2.3Clip-Msp基因在家蝇幼虫感染后的时空表达 在Oligo6.0上设计Clip-Msp和GAPDH基因的实时荧光定量PCR(Real-Time PCR)引物,由上海生工合成。Clip-Msp基因荧光上游引物(SyF)为ATAGGGAAGGTAGAACGG,下游引物(SyR)为CATAACATCTCCACGGAAT;GAPDH基因荧光上游引物(NyF)为GTCGTATTGGCCGTTTGGTT,下游引物(NyR)为GGGTGGAGTCGAATTTGAACA。取家蝇三龄幼虫分为2组,一组显微注射0.21 μL 1×1013cfu/L 0.21 μL的白假丝酵母菌,作为感染组;另一组注射等体积的PBS缓冲液,作为对照组。收集感染组和对照组不同作用时点(3、12、24及48 h)的幼虫组织(唾液腺、血淋巴、气管、脂肪体、肠道、马氏管、体壁),提取RNA并逆转录成cDNA,以各时间点组织的cDNA为模板,GAPDH基因为内参照,采用Real-Time PCR检测Clip-Msp表达,仪器为ABI PRISM 7300 (ABI,USA)。按照SYBR Premix Ex TaqTM II (Perfect Real Time)说明书配制反应体系,每个样本做3个重复,实验进行3次。反应条件:95 ℃ 预变性30 s,95 ℃ 5 s、60 ℃ 34 s、40个循环,95 ℃ 15 s、60 ℃ 20 s,95 ℃ 15 s。感染组Clip-MspmRNA的相对表达量用2-ΔΔCt计算,处理好的数据在Graphpad prism6上分析作图。
1.3 统计学分析
2 结果
2.1 pMD19-T/Clip-Msp克隆载体的构建
家蝇三龄幼虫总RNA电泳检测可见:18S条带较28S条带明亮清晰,28S条带暗淡模糊,说明提取的总RNA完整(图1)。用Clip-Msp基因的克隆引物(SkF和SkR)对pMD19-T/Clip-Msp重组菌进行PCR扩增,电泳结果显示,其PCR产物在1 524 bp左右有一特异性条带,与预期的片段大小相一致,经测序鉴定表明Clip-Msp基因的克隆载体构建成功(图2)。

注:M为DNA分子量标准,1为家蝇三龄幼虫总RNA。图1 总RNA的琼脂糖凝胶电泳结果Fig.1 The integrity of total RNAs analyzed in agarose gel electrophoresis
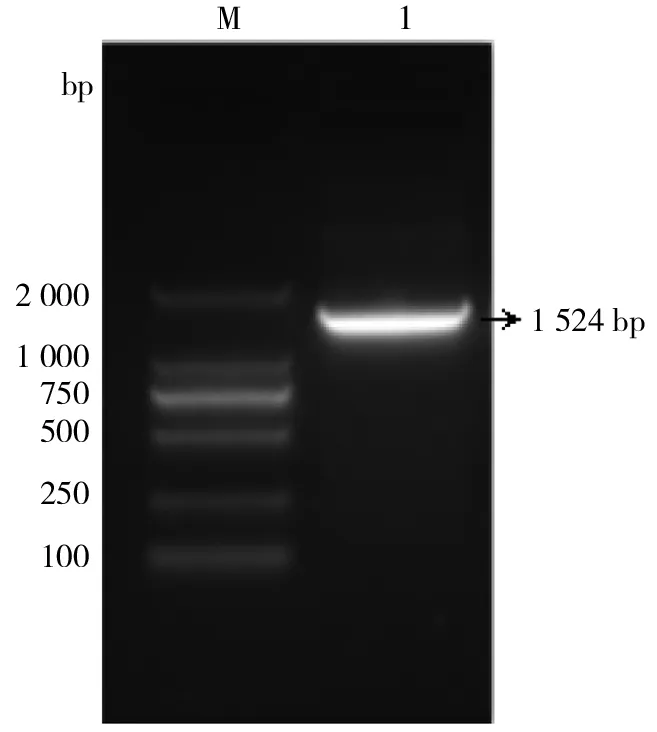
注:M为DNA分子量标准,1为pMD19-T/Clip-Msp重组菌落PCR。图2 pMD19-T/Clip-Msp重组菌落PCR的琼脂糖凝胶电泳结果Fig.2 Clip-Msp PCR product amplified from recombinant colony PCR of pMD19-T/Clip-Msp and analyzed in Agarose gel electrophoresis
2.2 生物信息学分析
结果显示,Clip-Msp基因ORF长为1 524 bp,编码507个氨基酸(图3)。Clip-Msp蛋白的氨基酸序列中没有信号肽(图4),N端第13~35位氨基酸为跨膜区,推测其为非经典分泌型蛋白(图5)。Clip-Msp蛋白的Tryp_SPc结构域为247~494位氨基酸,Clip结构域为45~92位氨基酸,属于单催化结构域Clip-丝氨酸蛋白酶超家族(图6)。

图3 Clip-Msp基因的开放阅读框及氨基酸序列Fig.3 Clip-Msp ORF and its the amino acid sequence
2.3 Clip-Msp基因的时空表达
感染组家蝇三龄幼虫在感染白假丝酵母菌后后不同时间点、不同组织中Clip-Msp基因的表达比较,差异有统计学意义 (P<0.05);3 h时以血淋巴中表达量增加最高(图7),12 h时以脂肪体、气管、唾液腺和肠道中表达量增加为主,脂肪体内的相对表达量最高(图8);24 h时以肠道中表达最高,脂肪体次之(图9);48 h时以血淋巴中表达量最高,马氏管和肠道次之(图10)。提示Clip-Msp基因主要在血淋巴、脂肪体和肠道中表达。
3 讨论
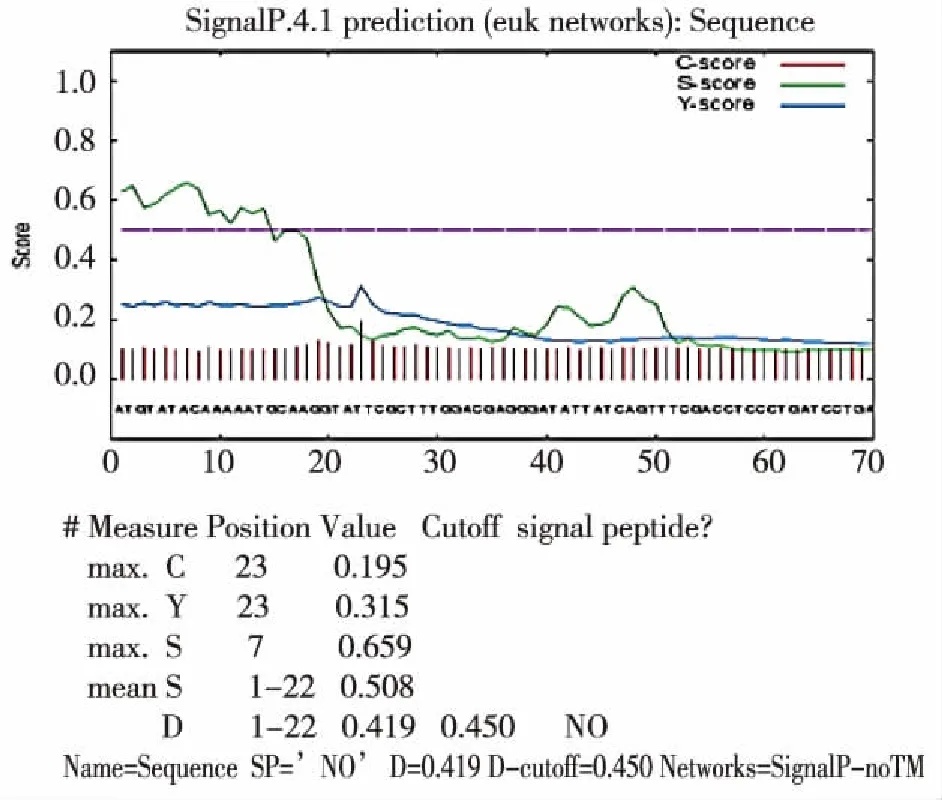
注:C值为剪切位点值,在剪切位点处C值最高;S值显示变化趋势,在信号肽区域S值较高;Y值为综合考虑S值和C值的一个参数,剪切点通常在S值陡峭位置的高C值位点即Y-max推测。图4 Clip-Msp蛋白的信号肽分析Fig.4 Signal peptide analysis of Clip-Msp protein
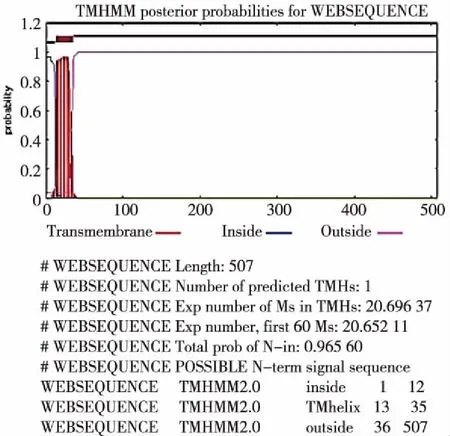
注:Inside表示胞内区,Outside表示胞外区,Transmembrane表示跨膜区;各自数值越大,表示某氨基酸位于对应区域内的可能性越大。图5 Clip-Msp蛋白的跨膜区分析Fig.5 Transmembrane analysis of Clip-Msp protein
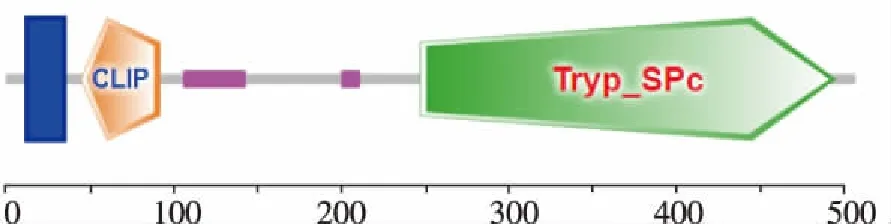
图6 Clip-Msp蛋白的功能结构域分析Fig.6 Conserved domain analysis of Clip-Msp protein

注:(1)与对照组比较,P<0.01;(2)与对照组比较,P<0.001。图7 三龄家蝇幼虫感染白假丝酵母菌后3 h时不同组织中Clip-Msp相对表达Fig.7 Relative mRNA expression levels of Clip-Msp in different tissues at 3 h after infection
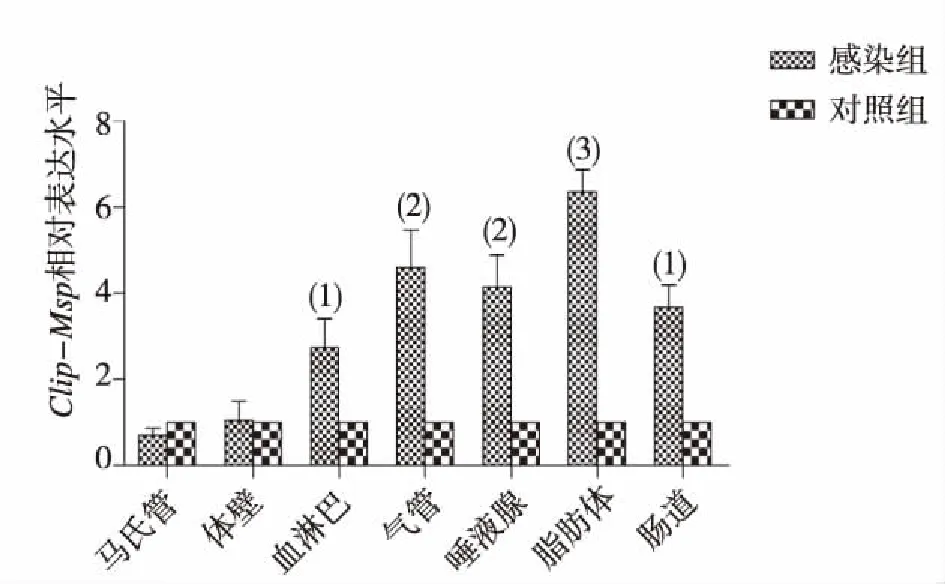
注:(1)与对照组比较,P<0.05;(2)与对照组比较,P<0.01;(3)与对照组比较,P<0.001。图8 感染3日龄家蝇幼虫后12 h不同组织中Clip-Msp相对表达Fig.8 Relative expression levels of Clip-Msp in different tissues ath 12 h after infection
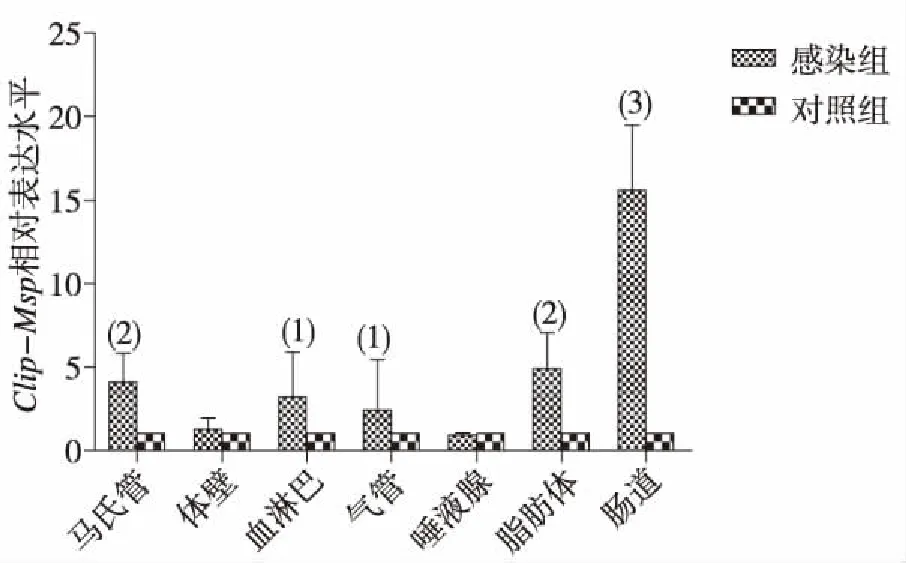
注:(1)与对照组比较,P<0.01;(2)与对照组比较,P<0.05;(3)与对照组比较,P<0.001。图9 三龄家蝇幼虫感染白假丝酵母菌后24 h不同组织中Clip-Msp相对表达Fig.9 Relative expression levels of Clip-Msp in different tissues at 24 h after infection

注:(1)与对照组比较,P<0.05;(2)与对照组比较,P<0.001。图10 三龄家蝇幼虫感染白假丝酵母菌后48 h不同组织中Clip-Msp相对表达Fig.10 Relative mRNA expression levels of Clip-Msp in different tissues at 48 h after infection
昆虫先天免疫(Insect innate immunity)是指当外来病原体感染昆虫时,机体通过自身的模式识别受体来识别病原相关分子模式,从而激活相关先天免疫应答,产生抗菌肽等非特异性功能效应分子清除病原体[9-12]。家蝇不仅是重要的医学媒介昆虫[13-14],也是先天免疫研究的理想模型[5-6]。本课题组前期研究发现,家蝇幼虫感染白假丝酵母菌后Clip-Msp基因表达量增高,认为该基因与家蝇抗C.albicans感染相关[8]。通过生物信息学分析可知,Clip-Msp氨基酸序列中有一个Clip结构域和Tryp_SPc(类胰蛋白酶结构)结构域,因此它属于Clip-丝氨酸蛋白酶超家族。分泌型蛋白通常指的是在N端有信号肽,并且依赖内质网-高尔基体途径分泌到胞外的蛋白[15]。反之,那些不通过内质网-高尔基体途径分泌到质膜和胞外的蛋白为非经典分泌型蛋白[16]。非经典分泌途径包括质膜孔形成、基于膜结合细胞器、绕过高尔基体[17]。据报道,黑腹果蝇84个单结构域的Clip-丝氨酸蛋白酶中,有12个缺乏典型的信号肽,为分泌型蛋白。分析黑腹果蝇Clip-丝氨酸蛋白酶发现:cSP44和cSP56以透膜区代替信号肽分泌到胞外为非经典分泌型蛋白,cSP54和cSP229既无透膜区也无信号肽为非分泌型蛋白[18-20]。Clip-Msp的开放阅读框无信号肽,具有透膜区,可能与黑腹果蝇cSP44和cSP56相似,是否以透膜区的非经典方式分泌到胞外或其它途径分泌至胞外有待进一步研究。
Clip-Msp在白假丝酵母菌感染家蝇三龄幼虫后,总体上呈先升高后降低的趋势。血淋巴Clip-Msp相对表达量在3 h和48 h较高,脂肪体Clip-Msp表达量在12 h和24 h较高,肠道Clip-Msp表达量在24 h达到最大值。可能是Clip-Msp参与真菌免疫应答不同时间点在不同组织中起作用所致。据报道,含有发卡结构的丝氨酸蛋白酶通过昆虫体液免疫中的水解级联反应,激活酚氧化酶系统,引发黑化反应;参与Toll通路中的信号转导,调控抗菌肽的合成[21-22]。当机体受到真菌感染后,Clip-丝氨酸蛋白酶前体通过自身的水解级联反应活化成为Clip-SPs,随后激活血细胞内的酚氧化酶原,参与血淋巴的黑化[21,23-24]。因此,感染初期(感染后3 h)Clip-Msp基因在血淋巴中表达量最高。随着作用时间的增加,感染迅速向全身蔓延,Clip-Msp参与机体内Toll免疫信号途径的激活,抗真菌肽在脂肪体中合成[8,25-26]。因此,感染中期(感染后12-24 h)脂肪体中Clip-Msp的表达量最高。感染中后期(感染后24 h),感染逐渐控制,但Clip-Msp在肠道中表达量最高,可能与增强肠道局部免疫调节有关[27]。感染后期(感染后48 h),白假丝酵母菌的数量减少,黑化现象逐渐减弱,为了防止机体过度免疫造成损伤,丝氨酸蛋白酶抑制剂抑制了Clip-Msp的表达[28]。但血淋巴中表达量仍然很高,可能与白假丝酵母菌感染血淋巴导致肠道菌群失调有关。在感染后检测的7种组织中,以血淋巴、脂肪体和肠道的表达量增加最为明显。推测Clip-Msp主要在血淋巴、脂肪体和肠道中表达。关于Clip-Msp在家蝇三龄幼虫体内的免疫调节功能,课题组将进一步研究。
综上所述,本研究成功构建了pMD19-T/Clip-Msp克隆载体,Clip-Msp基因开放阅读框全长1 524 bp,共编码507个氨基酸,无信号肽,存在跨膜区,属于非经典分泌型蛋白;Clip-Msp蛋白的N端存在一个Clip结构域,C端有一个Tryp_SPc催化结构域,属于单催化结构域Clip-丝氨酸蛋白酶超家族;白假丝酵母菌感染家蝇三龄幼虫后,Clip-Msp基因在不同时间点、不同组织中表达存在差异(P<0.05),主要分布在家蝇三龄幼虫的血淋巴、脂肪体和肠道中。
