西南高海拔区域苹果光合作用与光和CO2响应模型的筛选
2020-05-06冯建文吴亚维韩秀梅李顺雨
冯建文,吴亚维,宋 莎,韩秀梅,杨 华,李顺雨
(1.贵州省农业科学院 果树科学研究所,贵州 贵阳 550006;2.威宁县现代高效农业产业示范园区管理委员会,贵州 威宁 553100;3.威宁县果业中心,贵州 威宁 553100)
苹果Malus domestica属于蔷薇科Rosaceae苹果亚科Maloideae苹果属Malus落叶果树,与葡萄、柑橘和香蕉合称为“世界四大水果”[1]。我国作为全球第一大苹果主产国,2017年苹果栽种面积上升到222.04万hm2,占世界栽培面积的31.04%,产量上升至4 139.15万t,占世界总产量的33.29%[2]。
叶片的光合作用是苹果树生长发育和产量形成的基础,而光合作用受环境生态因子和生理因子的共同影响[3]。其中,光和CO2是光合作用的主要能量来源和底物,也是影响光合作用的最直接因子。国内外关于苹果叶片光合作用对光和CO2响应方面的研究已有报道[4-5]。西南冷凉高地是我国南方唯一的苹果优生区,该区域具有低纬度、高海拔、紫外线强、夏季气候冷凉、昼夜温差大等独特气候条件。已有该区域苹果品种光合特性的研究报道[6-7],但未涉及苹果品种光合作用对光与CO2响应方面的研究。
光合作用对光和CO2的响应模型是植物生理和植物生态学的重要研究方法,可为研究植物光合特征对主要影响因子的响应提供依据[8]。选择合适的数学模型来拟合光合-光响应曲线和光合-CO2响应曲线,才能计算得到衡量植物光合能力的重要光合参数,从而为后续的研究提供可靠的数据[9]。目前,用于拟合光合-光响应的模型有直角双曲线模型[10-11]、非直角双曲线模型[12]、指数模型[13]、直角双曲线修正模型[14]等;用于拟合光合-CO2响应的模型有直角双曲线模型、Michaelis-Menten模型(M-M模型)、直角双曲线修正模型等[15]。
笔者在西南冷凉高地产区开展了5个苹果品种的光合-光响应和光合-CO2响应研究,并进行了苹果光合-光响应和光合-CO2响应的拟合效果分析,旨在探明苹果对光强度和CO2浓度变化的响应机制,筛选较适合西南冷凉高地的苹果光合-光响应和光合-CO2响应模型,为后续深入开展西南高海拔区域苹果光合特性研究提供参考。
1 材料与方法
1.1 材 料
在贵州省毕节市威宁县黑石头镇农业局示范园(26°45′21″N,103°59′47″E)进 行 试 验。该 示范园海拔2 120 m。所用5个苹果品种为‘黔选2号’(‘红富士’单株变异,2011年由贵州省果树蔬菜工作站审定)、‘黔选3号’(‘长富2号’单株变异,2011年由贵州省果树科学研究所审定)、‘嘎拉’‘蜜脆’和‘红星’,均为6年生,砧木均为丽江山荆子,常规管理,乔化栽植,株行距2 m×4 m。
1.2 方 法
1.2.1 光响应数据的测定
2018年7月下旬,选择连续3 d晴朗天气,于9:00—11:30用便携式光合测定系统(Li-6400XT,USA)测定光响应数据。CO2小钢瓶是CO2注入系统,为光合作用提供反应的CO2底物。在测定之前,对小钢瓶进行校准,保证CO2注入系统能够控制样品室内CO2浓度的稳定。CO2体积分数控制在400 μmol/mol,温度控制在33 ℃,空气相对湿度约为54%。光合有效辐射(PAR,photosynthetically active radiation)的梯度设置为2 000、1 500、1 000、500、250、120、60、30、15、0 μmol/(m2·s)。测定指标包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等。不同光强设定数据采集时间为120~300 s。然后用各模型拟合光响应曲线,得到光响应曲线的初始斜率(即初始量子效率,α)、光饱和点(Isat)、光补偿点(Ic)、最大净光合速率(Pnmax)和暗呼吸速率(Rd)[16-17]。
1.2.2 CO2响应数据的测定
2018年7月下旬,选择连续3 d晴朗天气,于9:00—11:30用便携式光合测定系统(Li-6400XT,USA)测定CO2响应数据。CO2小钢瓶是CO2注入系统,为光合作用提供反应的CO2底物。在测定之前,对小钢瓶进行校准,保证CO2注入系统能够控制样品室内CO2浓度的稳定。样品室控制光强为1 200 μmol/(m2·s),温度控制在33 ℃,空气相对湿度为54%左右。CO2体积分数的梯度设置为400、300、200、150、100、50、400、600、800、1 000、1 200、1 500、1 800、2 000 μmol/mol。测定指标包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等。不同CO2浓度设定数据采集时间为120~300 s。然后用各模型拟合CO2响应曲线,得到CO2响应曲线的初始羧化速率(η)、CO2饱和点(CO2saturation point,CSP)、CO2补偿点(CO2compensation point,CCP)、最大净光合速率(Pnmax)和光呼吸速率(Rp)[9]。
1.2.3 光响应曲线和CO2响应曲线拟合模型
利用直角双曲线模型、非直角双曲线模型、指数方程模型和直角双曲线修正模型进行光合-光响应曲线的拟合;运用直角双曲线模型、Michaelis-Menten模型(M-M模型)、直角双曲线修正模型进行光合-CO2响应曲线拟合,各模型和数学表达式及具体参数设置情况见表1。

表1 拟合模型的数学表达式及参数设置†Table 1 Mathematical expressions and parameter setting of fitting models
根据光响应曲线和CO2响应曲线实测数据点的走势,估算Isat、Pnmax、Ic(Pn为0时的光合有效辐射PAR)、CCP、CSP,Rd和Rp等参数,估算出的光响应和CO2响应特征参数作为实测值与模型拟合值比较分析。
1.3 数据处理
运用软件“光合计算器”[14]光响应和CO2响应的模块对5个品种苹果光响应和CO2响应曲线实测数据进行拟合,得到α、β、Pnmax、Isat、Ic、CCP、CSP,Rd和Rp等指标,运用Office 2010软件进行数据整理和分析。
2 结果与分析
2.1 5个品种苹果叶片气体交换参数的光响应曲线比较
田间实测5个品种苹果叶片的光响应曲线如图1所示。由图1可见,随着PAR的增加,5个品种苹果叶片的Pn、Gs和Tr均逐渐增大,Ci值逐渐下降。光合有效辐射PAR在0~2 000 μmol/(m2·s)范围,5个品种苹果叶片Pn-PAR曲线变化趋势高度一致。随着PAR的增加,0~1 000 μmol/(m2·s) 范围内Pn随着PAR的增加快速上升,5个品种苹果叶片的Pn先迅速升高,达到最高Pn的67.53%~69.59%,随后逐渐趋于平缓,但5个苹果品种中,‘黔选3号’的Pn值比‘黔选2号’‘嘎拉’‘蜜脆’‘红星’的值低。随着PAR增加,Gs和Tr均整体呈现不稳定的上升趋势,Ci呈现较稳定的下降趋势,PAR在0~500 μmol/(m2·s)范围内随着PAR的增加快速下降,随后下降较缓慢。5个品种苹果叶片Gs-PAR、Tr-PAR变化总体呈上升趋势,PAR在0~120 μmol/(m2·s)范围内,‘蜜脆’和‘嘎拉’的Gs表现下降的趋势,而‘黔选2号’‘黔选3号’‘红星’3个品种叶片的Gs变化不大,有较小的波动,PAR在120~2 000 μmol/(m2·s)范围,5个品种叶片的Gs逐渐增加。在PAR达到1 500 μmol/(m2·s)时,‘嘎拉’苹果叶片的Gs、Ci和Tr均有一个明显峰值,但Pn依然呈现平稳缓慢上升,并未出现峰值。说明Gs的增加直接导致Ci和Tr的增加,1 200 μmol/(m2·s)光合辐射条件下,Gs不是‘嘎拉’苹果光合速率的限制因子。光合有效辐射PAR达2 000 μmol/(m2·s)时,5个品种苹果叶片的光合速率均未出现气孔限制。

图1 田间实测5个品种苹果叶片的光响应曲线Fig.1 Light response curses of five cultivars of M.domestica leaves measured in field
2.2 5个品种苹果叶片气体交换参数的CO2响应曲线比较
田间实测5个品种苹果叶片的CO2响应曲线如图2所示。由图2可见,当CO2体积分数在0~2 000 μmol/mol范围,5个品种苹果叶片的Pn-CO2和Ci-CO2曲线变化趋势基本一致,Gs-CO2和Tr-CO2曲线的变化趋势基本一致。0~600 μmol/mol 范围,随着CO2体积分数的增加,5个品种苹果叶片的Pn先迅速升高,达到最高Pn的56.66%~63.30%,随后平稳增长,Ci值基本呈线性增加,除‘蜜脆’苹果叶片Ci在CO2体积分数1 500~2 000 μmol/mol范围有较大波动外,‘黔选2号’‘黔选3号’‘嘎拉’‘红星’苹果Ci变化呈线性增加。5个品种苹果叶片Gs、Tr变化曲线呈现高度的相似性,说明Gs的变化直接影响Tr的变化,表现为同步变化,但Gs的变化并未影响Ci的值,各品种一致呈线性增加,尤其是‘黔选3号’的Gs明显低于其他4个品种且呈现缓慢下降趋势,但其Ci和其他4个品种无明显差异。
2.3 5个品种苹果叶片模型拟合Pn的光响应数值比较
运用直角双曲线模型、非直角双曲线模型、指数方程模型、直角双曲线修正模型4种光响应模型对5个品种苹果叶片Pn光响应数据进行拟合,由“光合计算器”得出的决定系数(R2)为0.997 3~1.000 0,拟合值与实测值的差值均小于1,拟合效果较好。5个品种苹果叶片光合作用光响应曲线测定数据及其拟合值见表2。
直角双曲线模型和指数模型的Pn拟合值的各个点与实测值存在较为明显的偏差。直角双曲线模型在PAR 0~15和250~500 μmol/(m2·s) 范围内,拟合值小于实测值,而指数方程模型在PAR 60~250和1 500~2 000 μmol/(m2·s)范围内,拟合值小于实测值,PAR 0~30和50~1 000 μmol/(m2·s)范围内,拟合值大于实测值。
直角双曲线修正模型Pn拟合值与实测值较为接近,但与实测值有偏差,表现在PAR 30~120和1 000 μmol/(m2·s)大于实测值,在其余PAR范围低于实测值。
非直角双曲线模型的Pn拟合值与实测值较为接近,但也有偏差,拟合值与实测值的差值为-0.17~0.17 μmol/(m2·s)。

图2 田间实测5个品种苹果叶片的CO2响应曲线Fig.2 CO2 response curses of five cultivars of M.domestica leaves measured in field

表2 5个品种苹果叶片光合作用Pn测定值及其光响应曲线拟合值Table 2 Measured Pn values in photosynthesis of five cultivars of M.domestica leaves and its fitted values based on light response curves

续表2Continuation of Table 2
2.4 5个品种苹果叶片模型拟合的光响应特征参数比较
用4种模型拟合不同苹果品种光响应曲线得到的特征参数α、Pnmax、Isat、Ic、Rd与实测值见表3。
直角双曲线模型的Pnmax拟合值均大于实测值,偏差较大,5个品种苹果叶片的α、Rd拟合值均比实测值大,除‘嘎拉’和‘红星’Ic的拟合值比实测值小外,‘黔选2号’‘黔选3号’‘蜜脆’的Ic拟合值比实测值大。
非直角双曲线模型的Pnmax拟合值均大于实测值,偏差较大,5个品种苹果叶片的α拟合值均比实测值大,‘黔选2号’‘嘎拉’‘蜜脆’的Rd拟合值比实测值大,但‘黔选3号’和‘红星’的Rd拟合值比实测值小,‘嘎拉’和‘红星’的Ic拟合值比实测值大,而‘黔选2号’‘黔选3号’‘蜜脆’的Ic拟合值比实测值小。
指数模型Pnmax、Ic、Rd的拟合值均比实测值小,且Ic和Rd的拟合值与实测值偏差较大。
用直角双曲线修正模型拟合的各参数值与实测值较为接近,5个品种苹果叶片的α值均大于实测值。
2.5 5个品种苹果叶片模型拟合Pn的CO2响应数值比较
运用直角双曲线模型、M-M模型、直角双曲线修正模型3种模型对5个品种苹果叶片Pn-CO2响应数据进行拟合,由“光合计算器”得出的决定系数(R2)为0.962 4~0.999 0,拟合效果较好。5个品种苹果叶片光合作用CO2响应曲线测定数据及其拟合值见表4。
直角双曲线模型和M-M模型的Pn拟合值均一致。直角双曲线模型在CO2体积分数0~10和600~1 500 μmol/mol范围内,拟合值小于实测值,M-M模型和直角双曲线拟合值完全一致;CO2体积分数在150~400和1 800~2 000 μmol/mol范围内,拟合值高于实测值。
直角双曲线修正模型的Pn拟合值与实测值较为接近,偏差范围表现在CO2体积分数150~300和1 200~1 800 μmol/mol,Pn拟合值大于实测值,其余CO2体积分数时Pn拟合值小于实测值。

表3 光响应模型拟合的决定系数与5个品种苹果叶片的主要光合参数Table 3 Fitted determination coefficients based on light response models and main photosynthesis parameters of five cultivars of M.domestica leaves

表4 5个品种苹果叶片光合作用Pn测定值及其CO2响应曲线拟合值Table 4 Measured Pn values in photosynthesis of five cultivars of M.domestica leaves and its fitted values based on CO2 response curves
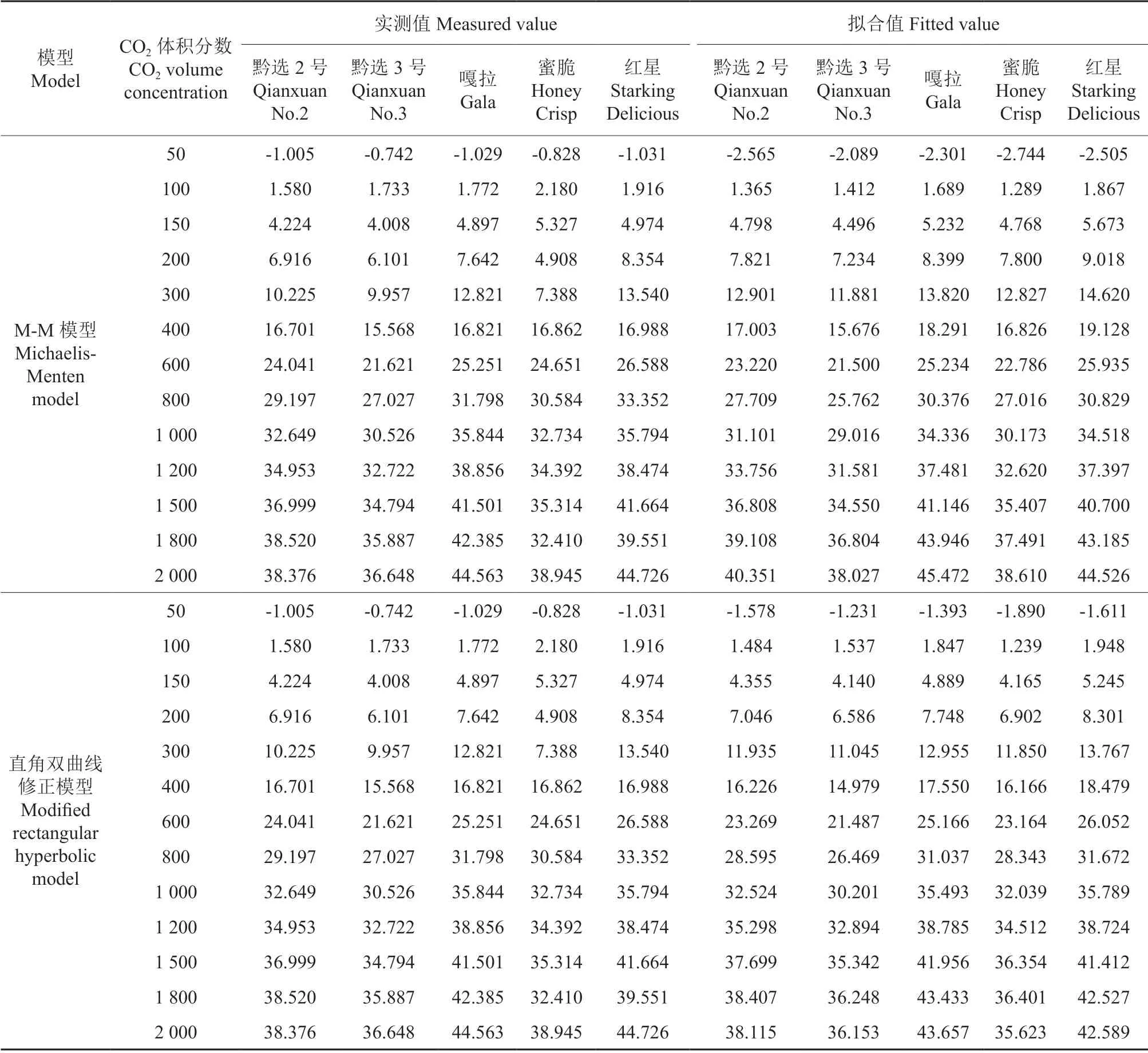
续表4Continuation of Table 4
2.6 5个品种苹果叶片模型拟合CO2响应特征参数比较
用3种模型拟合不同品种苹果叶片CO2响应曲线得到的特征参数η、Pnmax、CCP、CSP、Rp与实测值见表5。
用直角双曲线模型和M-M模型拟合的Pnmax、CSP、Rp及R2拟合值完全一致,用2种模型均无法拟合出CSP,但用直角双曲线模型能拟合出η值,用M-M模型无法拟合出η值。用直角双曲线模型和M-M模型拟合的Pnmax、CCP、Rp及η值均大于实测值,偏差较大。此外,用直角双曲线模型拟合的5个品种的Rp是Rd的1.65~2.32倍。用直角双曲线修正模型拟合的各参数值与实测值较为接近,5个品种苹果叶片的η值均大于实测值(表5)。
3 结论与讨论
3.1 结 论
光合-光响应中,气孔导度(Gs)的变化影响蒸腾速率(Tr)的变化,5个品种苹果叶片的光合速率均对强光有较好的适应性,在其他影响因子相同的情况下,CO2浓度可能是生产中的实际限制因子。光合-CO2响应中,5个品种苹果叶片Gs与Tr表现为同步变化,但Gs的变化并未影响Ci值,Ci值呈线性增加,在CO2浓度满足光合作用底物消耗的情况下,PAR是苹果叶片发挥光合能力的限制因子。采用模型拟合不同品种苹果叶片光合-光响应曲线,拟合效果由优到劣依次为直角双曲线修正模型、非直角双曲线模型、直角双曲线模型、指数方程模型。采用模型拟合不同品种苹果叶片光合-CO2响应曲线,拟合效果由优到劣依次为直角双曲线修正模型、直角双曲线模型、M-M模型。

表5 CO2响应模型拟合的决定系数与5个品种苹果叶片的主要光合参数Table 5 Fitted determination coefficients based on CO2 response models and main photosynthesis parameters of five cultivars of M.domestica leaves
3.2 讨 论
3.2.1 苹果光合作用与PAR和CO2响应特性
从5个品种苹果叶片的光与CO2响应曲线来看,在环境CO2(体积分数400 μmol/mol)供给充足的条件下,PAR在500~1 000 μmol/(m2·s)时,苹果Pn可满足苹果光合;在PAR为1 200 μmol/(m2·s)的情况下,CO2供给体积分数达到750~1 000 μmol/mol,苹果Pn可满足苹果光合。通过在威宁开展苹果光合日变化研究,笔者发现9:00—18:00实测苹果PAR为98.61~1 194.38 μmol/(m2·s),CO2体积分数为382.61~445.87 μmol/mol,与PAR在500~750 μmol/(m2·s),CO2供给体积分数达到750~1 000 μmol/mol相比,自然环境中PAR远超过750 μmol/(m2·s)。因此,在其他影响因子相同的情况下,PAR不是苹果光合速率的限制因子,CO2浓度可能是生产中的实际限制因子。
叶片气孔是植物体与外界环境进行H2O、CO2和O2等气体交换的重要门户[18]。因此,在研究叶片光合速率变化的原因时,首先要查明是否存在光合作用的气孔限制。叶片光合速率对一些干扰响应过程中,确定气孔阻力占优势的一个重要依据,是叶肉细胞间CO2浓度(Ci)与净光合速率(Pnmax)在同一个方向上变化,如果这两者的变化方向是相反的,则占优势的限制因素是在叶肉细胞内,而非气孔[19]。在Pn-PAR响应研究中,随着PAR的增强,5个品种苹果叶片的Pn、Gs和Tr呈现增加趋势,说明气孔可能受PAR调控,与前人研究结果一致[20]。而Ci与Pn的变化相反,呈下降变化趋势,说明Ci主要受Pn影响,Pn的升高使得CO2的消耗增加,导致Ci对应下降。其间,尽管Gs随着PAR增强而增加,而Gs的增加也在一定程度上导致了Ci的提高,这在PAR为 1 500 μmol/(m2·s)时‘嘎拉’苹果上的表现最为明显,但并未对整体Ci变化趋势造成决定性影响。说明本试验中CO2浓度满足光合作用底物消耗的情况下,PAR是苹果叶片发挥光合能力的限制因子。在Pn-CO2响应研究中,CO2体积分数在0~750 μmol/mol时,随着CO2浓度的增加,Pn呈现快速上升,随后平缓上升,Ci呈现线性上升,而Gs和Tr呈现无规律变化,说明CO2供给增加能够促进Pn和Ci的增加,但对Gs无直接的规律性影响,Gs的变化对于Pn和Ci也未产生直接影响。在Pn-PAR和Pn-CO2响应研究中,Gs值与Tr值的变化趋势高度一致,说明Gs的变化直接决定Tr,进一步验证了叶片Gs与Tr正相关的结果[21]。
本研究中,PAR设定在0~2 000 μmol/(m2·s),CO2体积分数也设定在50~2 000 μmol/mol,在西南冷凉高地苹果产区的威宁,本试验中测得的苹果园光合有效辐射PAR最高为1 194.38 μmol/(m2·s),自然环境中CO2体积分数主要在382.61~445.87 μmol/mol,均较难达到2 000 μmol/mol的试验体积分数。
3.2.2 适合拟合苹果光响应曲线的光响应模型
在本研究中,采用直角双曲线模型、非直角双曲线模型、指数模型和直角双曲线修正模型,均能较好地拟合不同品种苹果叶片光合-光响应曲线,拟合效果由优到劣依次为直角双曲线修正模型、非直角双曲线模型、直角双曲线模型、指数方程模型。虽然非直角双曲线模型的拟合值与实测值较为接近,但由于直角双曲线、非直角双曲线模型和指数模型本身是无极值的模型,无法直接得到Isat。本研究中,指数模型拟合值普遍低于曲线模型,非直角双曲线模型能较好地拟合低光照范围的光响应曲线,直角双曲线模型和非直角双曲线模型拟合的最大净光合速率值偏高,指数模型拟合的暗呼吸速率值偏低,直角双曲线修正模型的拟合值在各个阶段与实测值均较为接近,研究结果与前人的研究结果一致[22-29]。此外,直角双曲线模型、非直角双曲线模型、指数模型拟合的决定系数R2>0.99,但不能说明拟合的光合参数与实测值就很接近,因此,R2越大仅能说明模型拟合程度越高,并不能保证拟合的结果一定与实测值相符。从获得的特征参数数量和其与实测值的接近程度相比较,采用直角双曲线修正模型能够拟合出‘黔选2号’‘黔选3号’‘嘎拉’‘蜜脆’‘红星’的Isat,能够拟合得到的参数数量最多,且与实测值更为接近。但是在实际生产中,晴天中午的全日辐射仅为1 500~2 000 μmol/(m2·s),不可能达到品种‘嘎拉’拟合的最高值3 746.05 μmol/(m2·s),说明5个苹果品种对强光有较好的适应性,且在其他因子适宜的条件下,光合有效辐射的升高能进一步提高苹果叶片的净光合速率。
3.2.3 适合拟合苹果CO2响应曲线的CO2响应模型
在本研究中,直角双曲线修正模型、M-M模型和直角双曲线模型均能较好地拟合不同品种苹果叶片Pn-CO2响应曲线,拟合效果由优到劣依次为直角双曲线修正模型、直角双曲线模型、M-M模型。采用直角双曲线修正模型能够反映出光合作用的CO2饱和现象,反映叶片的光合能力,并得出CO2饱和点。羧化效率反映了植物叶片对CO2的利用情况,羧化效率越高,说明植物叶片对CO2的利用越充分[30]。M-M模型本身无初始羧化速率这个参数,所以无法拟合得到初始羧化速率这一数值。其他拟合值Pnmax、CCP、Rp、R2与直角双曲线模型相同,通过比较拟合得到的信息量及其与实测值的接近程度可知,直角双曲线修正模型优于直角双曲线模型和M-M模型,直角双曲线修正模型拟合的效果最佳[30-32]。前人的结论均是在CO2对光合作用饱和的情况下得出的,本研究中未出现较为明显的光合对CO2的饱和现象,可能与光诱导时间较短、固定光源强度 1 200 μmol/(m2·s)偏小有关[9]。
本研究的试验点位于威宁南部区域,北部区域也是苹果主产区,下一步考虑扩大研究区域。本研究中仅在相同的条件下控制光强和CO2浓度进行响应特征研究,而不同海拔、不同季节的环境因子存在差异,研究不同季节和海拔梯度果园苹果叶片光合作用与光和CO2的响应特征是下一步的研究方向。
