苯甲醇合成苯甲醛的氧化反应动力学
2020-05-06刘建武严生虎沈介发
刘建武,严生虎,张 跃,沈介发
1.常州大学制药与生命科学学院,江苏 常州 213164;
2.石油和化工行业连续流技术工程实验室,江苏 常州 213164
苯甲醛是一种重要的精细化工中间体,广泛应用于医药、香料、农药和染料等行业[1]。工业上生产苯甲醛的方法主要是甲苯氯化水解法和甲苯氧化法,甲苯氯化水解法需要消耗大量的氯气以及酸/碱[2],甲苯氧化法合成的苯甲醛只是该工艺的中间副产物,难以满足日益增长的市场需求[3]。关于醇氧化制备醛酮的研究已有大量报道,使用的氧化剂如铬试剂[4-5]、锰试剂[6]及过渡金属氧化物[7-8]、高价碘试剂[9-10]等,这些氧化剂虽然活性很强,反应速度快,但反应过程很难控制,易造成环境污染。祁敏等[11]研究了负载型CuO/HZSM-5 催化苯甲醇液相氧化行为,反应具有较低反应活化能和较高的反应速率常数。李竹霞等[12]研究了Mn3+氧化剂甲苯制苯甲醛的反应动力学。吴云等[13]采用具有纳米孔洞的金属-有机骨架材料Cu3(BTC)2(H2O)3为催化剂,过氧化氢为氧化剂,利用紫外可见光谱研究催化氧化苯甲醇生成苯甲醛的反应动力学行为。
近年来,2,2,6,6-四甲基哌啶-1-氧自由基(TEMPO)有机小分子催化醇氧化已在催化领域得到广泛应用。TEMPO 催化醇的氧化体系通常以二氯甲烷为溶剂,次氯酸钠溶液为氧化剂,TEMPO 和NaBr/KBr 催化醇氧化合成醛酮。ANELLI 等[14]采用NaBr 为助催化剂时,4-CH3O-TEMPO 能够快速催化次氯酸盐对醇的选择性氧化。任伟[15]公开了一种由醇氧化成醛或酮的方法,以TEMPO 为催化剂,碘为助催化剂,过氧化氢叔丁醇为氧化剂,在60~100 ℃下反应2~24 h,可以将不同种类的脂肪醇氧化为相应的醛或酮。余依玲等[16]将TEMPO 与铜配合物构成共催化体系TEMPO/[Cu(BAAP)2]-CPGMA,应用于分子氧氧化苯甲醇的催化氧化过程。
关于TEMPO 催化次氯酸钠氧化醇合成醛酮的研究已经有大量报道[17-18],其反应机理也给出了相关描述[19],但缺少相关动力学研究报道。本工作将以N,N-二甲基甲酰胺(DMF)为溶剂,采用初始浓度法研究2,2,6,6-四甲基哌啶-1-氧自由基(TEMPO)催化氧化苯甲醇生成苯甲醛的反应动力学,建立相关动力学模型,为TEMPO 氧化合成苯甲醛的连续流反应器设计以及过程强化等提供技术依据和工业基础。
1 实验部分
1.1 反应实验
准确称取16.00 g 苯甲醇和0.253 8 g TEMPO 于100 mL 容量瓶中,DMF 溶剂定容,振荡摇匀备用。量取与1 mL 苯甲醇-DMF 溶液等物质的量的NaClO 于反应器中,依次加入适量TEMPO 催化剂和DMF 溶剂,磁力搅拌下待反应液温度恒定,然后将1 mL 苯甲醇溶液迅速加入至反应器,反应一定时间后加入适量硫代硫酸钠终止反应。将反应物全部倒入分液漏斗中,用二氯甲烷进行萃取,合并有机层,加入1 g 甲苯,并用二氯甲烷定容,然后进行组分分析。
1.2 分析方法
采用Agilent 公司的7890B 型气相色谱仪(GC)进行组分分析。HP-5(30 m×320 μm×0.25 μm)色谱柱;FID 氢火焰离子化检测器;载气:氮气流量25 mL/min,氢气流量30 mL/min,空气流量400 mL/min;柱温65 ℃,升温速率40 ℃/min;进样口温度260 ℃,终止温度250 ℃,检测器温度300 ℃;柱前压34.5 kPa;分流比10:1;进样量0.4 μL。
苯甲醇/苯甲醛的标准工作曲线见图1 和图2。拟合得到苯甲醇/苯甲醛与溶剂物质的量比浓度Yi与其峰面积比Xi的内标工作曲线方程:YA=1.261XA,YD=1.246XD。根据内标工作曲线方程计算得到苯甲醇的比浓度(CA)/苯甲醛的比浓度(CD)。

图1 苯甲醇的内标工作曲线Fig.1 The internal standard curve of benzyl alcohol

图2 苯甲醛的内标工作曲线Fig.2 The internal standard curve of benzyldehyde
2 结果与讨论
2.1 动力学模型建立
在温度0~20 ℃,苯甲醇与次氯酸钠物质的量之比为1:1 时,若反应时间小于30 min,则TEMPO催化次氯酸盐氧化苯甲醇的产物苯甲醛的选择性接近99%,只有微量苯甲酸生成,建立以下模型:

催化剂TEMPO(K)与次氯酸钠作用生成亚稳态氮羰基阳离子(BK),氮羰基阳离子进一步氧化苯甲醇生成苯甲醛,上述第一步反应很快,而第二步反应相较于第一步反应要慢很多[20]。因此,可近似的认为在很短时间内B 全部变为BK,整个反应速率将主要取决于第二步反应。其反应速率方程可以转化为:

式中:r 为反应速率,mol/(L·min);CA和CB分别为苯甲醇和次氯酸钠浓度,mol/L;t 为反应时间,min;k 为反应速率常数,(L/mol)(α+β-1)/min;α 和β 分别为苯甲醇和次氯酸钠反应级数。
2.2 模型参数的确定
2.2.1 反应级数
实验选取苯甲醇与次氯酸钠物质的量之比为1:1,反应物初始浓度CA0和CB0相等,则速率方程表达式(4)简化为:

对式(5)两边取对数得:

测得0 ℃时苯甲醇浓度随时间的变化(CA0为147.8 mmol/L),结果见图3。对苯甲醇浓度随反应时间变化的数据进行曲线拟合,计算得出曲线在不同时刻的斜率dCA/dt,再将ln(-dCA/dt)对lnCA作图,结果见图4。对图4 数据进行线性拟合,由其斜率可得该反应级数为1.956,所以TEMPO 催化苯甲醇的氧化反应近似为一个总反应级数为2 的反应。

图3 苯甲醇浓度随时间的变化Fig.3 Concentration change of benzyl alcohol with time
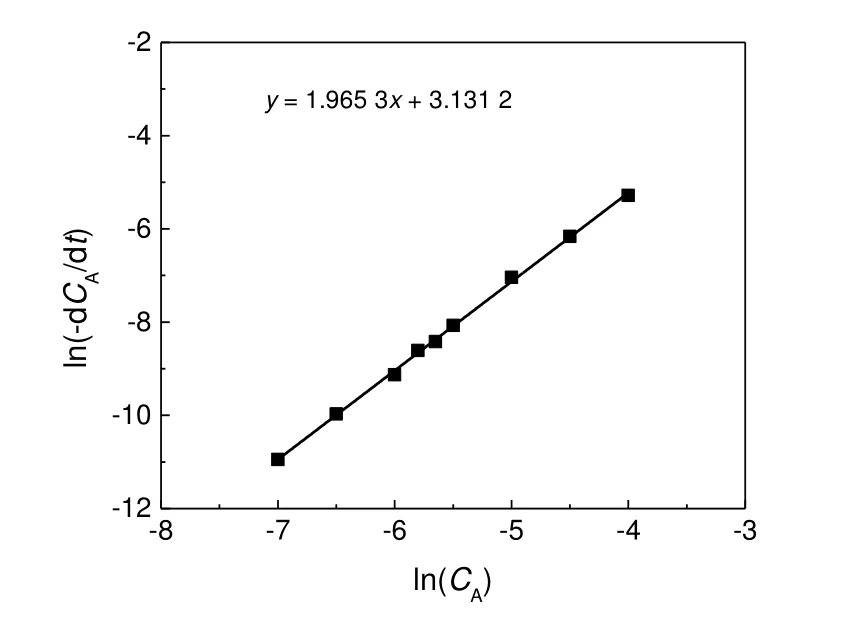
图4 ln(-dCA/dt)对lnCA 拟合Fig.4 The fitting linear plot of ln(-dCA/dt)-lnCA
控制反应温度0 ℃,固定苯甲醇初始浓度CA0为147.8 mmol/L 不变,选择两个次氯酸钠的浓度(147.8 mmol/L 和2.217 mmol/L),测得苯甲醇浓度随时间的变化关系,通过拟合计算得到初始反应速率分别为540.0 mmol/(L·min)和803 5 mmol/(L·min)。将上述数据代入式(4),计算得β 为0.98,则该反应相对于次氯酸钠和苯甲醇的反应级数均近似为1,即:r =− dCAdt = kCACB。当苯甲醇与次氯酸钠初始浓度CA0和CB0相等时,则简化为:
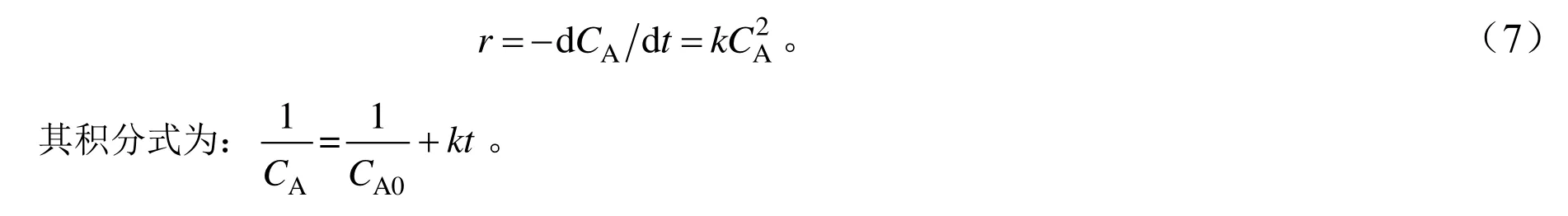
2.2.2 反应速率常数
苯甲醇与次氯酸钠物质的量之比为1:1,在催化剂用量不变的条件下(苯甲醇CA0为147.8 mmol/L,次氯酸钠CB0为147.8 mmol/L,催化剂用量TEMPO 与苯甲醇的物质的量之比为0.01:1),测得不同反应温度下苯甲醇浓度随反应时间的变化情况,将CA-1对t 作图,结果见图5。由图5 可知,不同温度下CA-1与反应时间的关系均呈线性关系,说明反应确实为2 级,由斜率可得相应温度下的速率常数。

图5 不同温度时的CA-1 与t 的关系Fig.5 Correlation between CA-1 and t at different temperatures
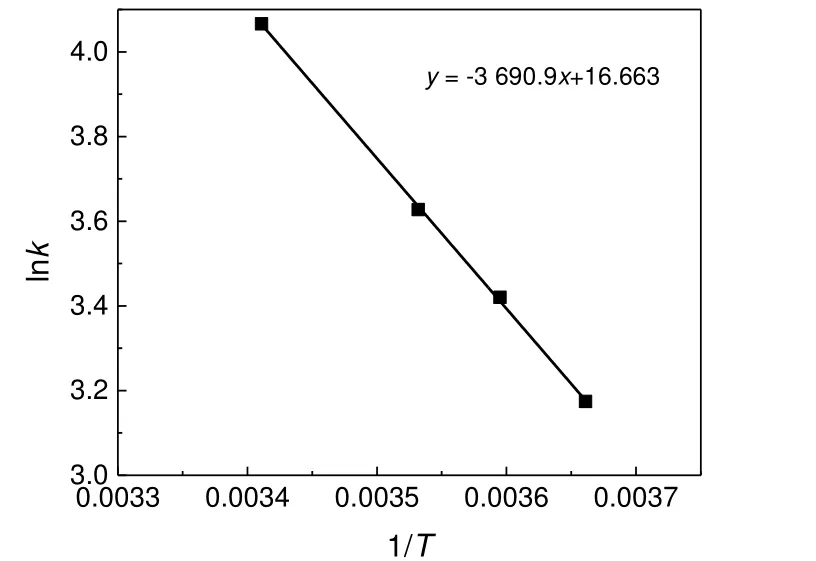
图6 lnk 与T-1 的关系Fig.6 The relationship between lnk and T-1
根据阿伦尼乌斯方程: lnk = lnk0−Ea /RT,将lnk 对T-1作图,结果见图6。由拟合曲线的斜率和截距求得该反应的指前因子k0为1.72×107L/(mol·min),活化能为30.69 kJ/mol。TEMPO 催化苯甲醇氧化反应动力学方程:

2.3 动力学方程的验证
在优化工艺条件下(苯甲醇与次氯酸钠的物质的量比为1:1、TEMPO 与苯甲醇的物质的量比为0.01:1、DMF 与苯甲醇的体积比为10:1、反应温度为0 ℃),不同反应时间的苯甲醇浓度计算值与实验值的比较见图7。由图7 可知,实验数据和动力学方程计算结果还是基本吻合,平均相对误差为6.78%。因此,通过前文获得的动力学方程可以对TEMPO催化苯甲醇的实际氧化行为进行有效的预测。

图7 苯甲醇浓度的实验值与计算值比较Fig.7 Comparison of experimental and calculated concentration of benzyl alcohol
3 结 论
以N,N-二甲基甲酰胺(DMF)为溶剂,2,2,6,6-四甲基哌啶-1-氧自由基(TEMPO)催化氧化苯甲醛的反应动力学为二级反应,对苯甲醇和次氯酸钠分别为一级反应,活化能为30.69 kJ/mol,指前因子为1.72×107L/(mol·min)。建立的反应动力学方程计算值和实验值的平均相对误差为6.78%,两者吻合较好,可为苯甲醇液相氧化反应器设计和反应工艺条件的选择和优化提供基础依据。
