淋巴细胞活化基因-3敲除(Lag-3-/-)小鼠构建及初步表型分析
2020-05-06万颖寒慈磊王珏龚慧万志鹏奚骏何敏珠孙瑞林费俭2沈如凌
万颖寒,慈磊,王珏,龚慧,万志鹏,奚骏,何敏珠,孙瑞林,费俭2,,沈如凌*
(1. 上海实验动物研究中心,上海 201203; 2. 模式生物技术联合实验室,上海实验动物研究中心,上海 201203/同济大学生命科学与技术学院,上海 200092; 3. 上海南方模式生物科技股份有限公司,上海 201318;4. 同济大学生命科学与技术学院,上海 200092)
Lag-3全称淋巴细胞激活基因-3,又称为CD223和Ly66,是一种定位于膜上的糖蛋白,属于免疫球蛋白(lg)超家族成员,含有四个Ig样结构域。Lag-3在活化的T细胞、Treg细胞、浆细胞样树突状细胞(pDC)、天然杀伤性细胞(NK)和B细胞上表达[1-2]。 T细胞激活后,白细胞介素2(IL-2),IL-7和IL-12会上调Lag-3的表达,Lag-3以比CD4更高的亲和力与MHC II类分子结合,对CD3T细胞受体(TCR)复合物信号传导起负调控作用,进而抑制T细胞的过度活化和增殖,调控体内的免疫平衡[2-3]。Lag-3也参与调节肿瘤微环境中的免疫应答,其通过阻断T细胞抗肿瘤功能的恢复途径在肿瘤免疫逃避中发挥重要作用[4],因此在免疫治疗中是一个重要的免疫检查点分子,受到广泛关注[5-7]。
鉴于Lag-3基因在体内的重要功能,早在1996年就建立了第一个Lag-3体内基因敲除小鼠模型,利用该模型首先发现Lag-3基因缺失显著影响了NK细胞的活性[8],在后续的研究中发现,在体内Lag-3不但调控活化T细胞的扩增[9],还调节浆细胞样树突状细胞稳态[10];在自身免疫疾病研究方面,近年来,利用Lag-3条件敲除小鼠模型,证明Lag-3可通过抑制Treg细胞的增殖,促进自身免疫疾病的发生,在1型糖尿病小鼠模型中敲除Lag-3可显著降低1型糖尿病的发生[11];这些研究表明,Lag-3在体内多种生理、病理过程中扮演了重要角色。
急性肝炎仍然是危害人类生命健康的一类重要疾病。刀豆蛋白A(ConA)诱导的急性肝损伤模型,通过活化Th1细胞,刺激库普弗细胞和肝细胞释放TNF-α,IFN-γ等细胞因子,招募淋巴细胞浸润,造成急性肝损伤,是研究人类肝脏自身免疫性肝炎和病毒性肝炎的常用模型。虽已有证据显示Lag-3在病毒感染,肝炎等疾病过程中发挥作用,但还未有报道对Lag-3在体内肝损伤过程中的功能进行研究。
为了便于研究Lag-3在急性肝损伤过程中的功能,我们利用CRISPR/Cas9技术建立了Lag-3 基因敲除小鼠(Lag-3-/-),并在该模型上首次利用刀豆蛋白诱发急性肝损伤模型,对Lag-3在急性肝损伤过程中的功能进行了研究。
1 材料与方法
1.1 材料
1.1.1 实验动物
Lag-3-/-小鼠由上海南方模式生物科技股份有限公司储存(储存编号:PR1-20180509)20只SPF级雌性C57BL/6小鼠,4周龄,体重10 ~ 12 g;5只SPF级雌性C57BL/6小鼠,8周龄,体重18 ~ 20 g;20只SPF级雄性C57BL/6小鼠,8周龄,体重10 ~ 12 g;12只SPF级雌性ICR假孕小鼠,8周龄,体重28 ~ 30 g;12只SPF级雄性ICR结扎小鼠8周龄,体重28 ~ 30 g;由上海南方模式生物科技股份有限公司繁育提供【SCXK(沪)2014-0002】。饲养于上海实验动物研究中心SPF级实验动物房【SYXK (沪) 2014-0002】,按照SPF级动物饲养要求进行饲养。所有操作均由上海南方模式生物科技股份有限公司实验动物管理和使用委员会(IACUC)审批通过(审批号:IACUC号2017-0032)。
1.1.2 主要试剂
pX-T7-sgRNA质粒、Cas9表达载体由上海南方模式生物科技股份有限公司构建。质粒小量提试剂盒和琼脂糖胶回收试剂盒购自OMEGA公司,MESSAGE mMACHINE T7 Ultra Kit试剂盒购自Ambion公司;APC标记大鼠抗小鼠Lag-3抗体购自Biolegend公司;DH5α 感受态细胞及各种限制性内切酶、DNA聚合酶、 T4 DNA连接酶和PCR相关试剂购自TaKaRa公司。
1.2 实验方法
1.2.1 sgRNA 设计和表达载体构建
小鼠Lag-3基因定位于第6 条染色体的19F2-F3 区段(Chromosome 19: 124,904,361-124,911,705,ENSMUSG00000032217.1),全长2001 bp,有8个的外显子,表达蛋白全长521 aa。针对小鼠Lag-3基因结构,通过在线sgRNA设计软件(http: / /crispr.mit.edu /),针对敲除区域(exon 2)在intron 1和intron 2中设计sgRNA,最终在两个intron中各选择2个sgRNA靶位点,sgRNA序列信息分别为:sgRNA1: 5′-CATCATGCCTCCCTGTTGAA-3′; sgRNA2: 5′-TGCCTCAGCCTCCCTTCAAC-3′; sgRNA3: 5′-AC TACAGGATGCCGGTGTGT-3′;sgRNA4: 5′-GTGGA TTGCTCCCCACACAC-3′。根据4个sgRNA靶位点合成相应的oligoDNA用于sgRNA表达载体构建。
设计4 对针对Lag3基因的sgRNA 寡聚核苷酸链: 正义链1: 5′-CACCGCATCATGCCTCCCTG TTGAA-3′,反义链1: 5′-AAACTTTCAACAGGGAGG CATGATG-3′;正义链2: 5′-CACCGTGCCTC AGCCTCCCTTCAAC-3′,反义链2: 5′-AAACT GTTGAAGGGAGGCTGAGGCA-3′; 正义链3: 5′-CACCG ACTACAGGATGCCGGTGTGT-3′,反义链3: 5′-AAACTACACACCGGCATCCTGTAGT-3′; 正义链4: 5′-CACCGGTGGATTGCTCCCCACACAC -3′,反义链4: 5′-AAACTGTGTGTGGGGAGCAATCCAC-3′。
将Lag-3 sgRNA 寡核苷酸单链以逐步降温的方法退火成双链。BbsI酶切pX-T7-sgRNA质粒使其线性化,回收后与4个寡核苷酸双链分别进行连接、转化感受态大肠杆菌;挑选抗性单克隆提取质粒DNA,进行测序鉴定,鉴定正确的阳性克隆保存备用。
1.2.2 sgRNA 和Cas9表达载体的体外转录
sgRNA的表达载体pX-T7-sgRNA 经酶切线性化后,按照HiScribeTMT7 High Yield RNA Synthesis Kit试剂盒说明书进行体外合成;Cas9表达载体经酶切线性化,按照mMESSAGEmMACHINE T7 Ultra Transcription Kit试剂盒说明书进行体外转录。
1.2.3 阳性小鼠品系获得及鉴定
通过显微注射将Cas9 mRNA和sgRNA注射到C57BL/6小鼠受精卵胞质中,注射后受精卵移植到假孕雌鼠子宫中,待出生后获得F0代小鼠,PCR方法筛选阳性基因型的F0代小鼠。Lag-3基因敲除F1代杂合子小鼠(Lag-3-/+)由F0代阳性小鼠与C57BL/6野生型小鼠交配获得,引物对P1/P2序列信息为:P1:5′-GCTTCTGGGACTGCTTTGG-3′;P2:5′-GGGTTGTCTAGGCGAGGG-3′,PCR产物测序鉴定。PCR条件为:94 ℃ 3 min; 35个循环的95 ℃ 30 s,56 ℃ 15 s,72 ℃ 2 min; 72 ℃ 5 min。F2代Lag-3基因敲除纯合子小鼠(Lag-3-/-)模型由F1代杂合子小鼠自交获得,基因型鉴定策略同F1代小鼠。
1.2.4 逆转录实时定量PCR(RT-PCR)检测
将刀豆蛋白A(concanavalin A, ConA)通过尾静脉按12 mg/kg剂量注射到小鼠体内,18 h后取材。按照TRIzol RNA抽提试剂说明书,分别从脾、腹腔巨噬细胞和淋巴结中分离抽提细胞总RNA。使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(Transgen)将分别来自Lag-3-/-和野生型小鼠的RNA样品逆转录成cDNA;TransStart Top Green qPCR SuperMix(Transgen)用于实时PCR扩增。反应条件如下:95℃ 3 min; 40个循环的95℃ 30 s,60℃ 15 s,72℃ 30 s;95℃ 15 s,60℃ 15 s。Lag-3特异性引物序列信息为:上游序列:5′-CCTGGATCCTAACTTTCTACGAAG-3′,下游序列:5′-CGCTCAGCACCGTGTAG-3′。小鼠β-actin基因作为Lag-3基因表达水平的内参。β-actin引物序列信息为:上游序列:5′-ATTGCTG ACAGGATGCAGAA-3′,下游序列:5′-GCTGATCC ACATCTGCTGGAA-3′。
1.2.5 流式细胞术(FACS)检测Lag-3表达
将ConA通过尾静脉按12 mg/kg剂量注射到小鼠体内,18 h后取材。异氟烷麻醉小鼠后,取脾淋巴细胞、腹腔巨噬细胞和淋巴结,过筛网后分别获得细胞悬液;经去除红细胞和PBS洗涤后,①用荧光抗体APC anti-mouse Cd223(Lag-3)对细胞进行标记,检测Lag-3表达;②用荧光抗体FITC anti-mouse CD3e和APC anti-mouse Cd223(Lag-3)对细胞进行双标,检测Lag-3在T细胞上的表达,标记后的细胞,在冰上避光孵育20 min,将细胞重悬于Stain Buffer中(含1%FBS的PBS),Stain Buffer洗涤两次后按常规方法上流式细胞仪CytoFlex检测,每个样品检测收集10 000 个细胞,结果用CellQuest软件分析。
1.2.6 血生化检测
同窝生Lag-3-/-小鼠和野生型小鼠经ConA注射处理(方法同1.2.5),18 h后小鼠经异氟烷麻醉进行眼球取血,未经刀豆蛋白注射的同窝Lag-3-/-小鼠和野生型小鼠同样进行眼球取血,使用全自动生化分析仪(日立7180型)对血液生化指标进行检测。
1.2.7 组织和病理学检测
同窝生Lag-3-/-小鼠和野生型小鼠经ConA注射处理(方法同1.2.5)后进行各组织器官取材、称重,同窝生未经刀豆蛋白注射的Lag-3-/-小鼠和野生型小鼠同时进行取材。组织拍照后,小鼠各组织器官经过PBS清洗后固定于4%多聚甲醛中,组织包埋切片后H&E染色拍照分析。
1.3 统计学分析

2 结果
2.1 Lag-3-/-小鼠的制备
Lag-3-/-小鼠的构建策略如图1所示,Cas9/sgRNA将Lag-3基因exon 2敲除,exon 2区域的缺失将造成蛋白读码框移码,Lag-3蛋白无法正确翻译,从而造成基因功能性缺失。将转录后的Lag-3 sgRNA和Cas9 mRNA混合物通过显微注射方式注射到C57BL/6小鼠受精卵胞质中,180枚经过显微注射的受精卵移植到9只ICR假孕鼠输卵管中,共出生36只F0代小鼠(出生率为20%),经PCR对F0代小鼠的基因型进行鉴定,凝胶电泳结果(图2)显示29只小鼠中能检测到Cas9/gRNA作用后的变小条带(阳性率80%),选择其中2只雄性小鼠(5号和23号)分别与野生型C57BL/6雌鼠交配,PCR鉴定加产物测序,确定F1代突变杂合子小鼠有2种基因类型:敲除类型1为缺失421个碱基对;敲除类型2为缺失405个并且替换2个碱基对。选择敲除类型1型的F1代Lag-3-/+小鼠进行自交,获得F2代Lag-3-/-小鼠用于后续实验,阳性小鼠鉴定结果如图3所示。
2.2 Lag-3-/-小鼠mRNA水平和蛋白水平验证
注射ConA刺激后采用Real-time PCR和流式细胞术(FACS)分别在mRNA和蛋白水平检测Lag-3基因敲除小鼠敲除效果。RT-PCR结果如图4A所示:ConA刺激后,Lag-3敲除纯合子小鼠的心脏、脾、肺、肾、骨髓组织和腹腔巨噬细胞的Lag-3 mRNA表达水平均显著低于野生型小鼠(P< 0.001)。利用流式细胞术(FACS)检测小鼠腹腔巨噬细胞、脾细胞和淋巴细胞的Lag-3蛋白表达情况,结果如图4B-C所示:Lag-3-/-小鼠的Lag-3信号水平非常低,腹腔巨噬细胞、脾细胞和淋巴细胞中可检测到的Lag-3信号表达分别占父群的(0.7 ± 0.36)%,(0.66 ± 0.48)%和(0.28 ± 0.09)%;而相应的野生型小鼠的Lag-3信号水平分别占父群的(12.39 ± 2.63)%,(24.5 ± 3.56)%和(5.73 ± 0.6)%。该结果从mRNA和蛋白水平上证明已成功构建Lag-3-/-小鼠。

注:针对敲除区域(exon2), Cas9/sgRNA识别并剪切目标靶序列,将Lag-3基因exon 2敲除。图1 Lag-3-/-小鼠构建策略Note. For the knockout region (exon2), the Cas9/sgRNA complex knocks out the Lag-3 gene exon 2 by recognizing and cleaving the target sequence.Figure 1 Lag-3-/- mice construction strategy

注:A:Lag-3基因F0代小鼠敲除小鼠鉴定策略;B:F0代小鼠基因型鉴定电泳结果。图2 F0代小鼠基因型鉴定Note. A, Identification strategy of Lag-3 gene knockout mice in the F0 generation. B, Electrophoresis results of genotype identification in F0 generation mice.Figure 2 Genotype identification of F0 generation mice

注:A:Lag-3-/-小鼠基因型鉴定策略;B:Lag-3-/-小鼠基因型鉴定电泳结果。野生型小鼠PCR产物为一条990 bp条带;Lag-3-/+小鼠PCR产物为990 bp和569 bp两条带;Lag-3-/-小鼠PCR产物为一条569 bp条带。WT-野生型小鼠,HE-Lag-3-/+小鼠,HO-Lag-3-/-小鼠。图3 F2代小鼠基因型鉴定Note. A, Genotype identification strategy for Lag-3-/- mice. B, Electrophoresis results of genotype identification in Lag-3-/- mice. The wild-type mouse PCR product was a 990 bp band; the Lag-3-/+ mouse PCR product was two bands of 990 bp and 569 bp; and the Lag-3-/-mouse PCR product was a 569 bp band. WT-wild type mice, HE-Lag-3-/+ mice, HO-Lag-3-/-mice.Figure 3 Genotype identification of F2 mice
2.3 ConA刺激前后Lag-3-/-小鼠CD3+T细胞比例变化
利用流式细胞术(FACS)对小鼠血液、骨髓细胞和脾细胞中的CD3+T细胞表达检测,结果如图5所示:未注射ConA的情况下,和野生型小鼠相比,Lag-3-/-小鼠的血液和脾细胞中CD3+T细胞比例无显著性差异,但骨髓中的CD3+T细胞比例显著性低于野生型小鼠;ConA刺激后,野生型小鼠血液中的CD3+T细胞显著性升高,骨髓和脾中的CD3+T细胞比例略有下降,但没有显著性差异;而在Lag-3-/-小鼠中,ConA刺激后,小鼠血液、骨髓细胞和脾细胞中的CD3+T细胞比例较刺激前均显著性降低。该结果说明Lag-3基因敲除显著降低了ConA刺激后小鼠CD3+T细胞量。
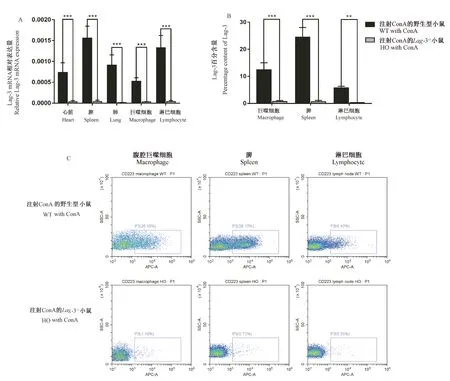
注:A:Lag-3基因敲除野生型和纯合子小鼠组织Lag-3 mRNA表达水平检测结果;B:不同基因型小鼠腹腔巨噬细胞、脾细胞和淋巴结中Lag-3百分含量柱状图。与注射ConA的野生型小鼠组相比,**P< 0.01,***P< 0.001;C:不同基因型小鼠腹腔巨噬细胞、脾细胞和淋巴结中Lag-3表达情况散点示意图。APC标记荧光抗体anti-CD223检测。图4 Lag-3-/-小鼠mRNA和蛋白相对表达水平检测(n=3)Note. A, Detection of Lag-3 mRNA expression levels in tissues of wild-type and Lag-3 gene knockout homozygous mouse tissue. B, Bar chart of Lag-3 percentage content in peritoneal macrophages, spleen cells and lymph nodes of mice with different genotypes. Compared to WT with ConA,**P< 0.01,***P< 0.001. C, Scatter plot of Lag-3 positive cell in peritoneal macrophages, spleen cells and lymph nodes of mice with different genotypes. APC labeled fluorescent antibody anti-CD223.Figure 4 Detection of relative mRNA and protein expression levels in Lag-3-/- mice(n=3)

注:A:野生型小鼠和Lag-3-/-小鼠血液、脾细胞和骨髓细胞中CD3+T细胞比例散点示意图;FITC标记荧光抗体anti-CD3检测;B:野生型小鼠和Lag-3-/-小鼠血液、脾细胞和骨髓细胞中CD3+T细胞统计图;与注射ConA Lag-3-/-组相比,*P< 0.05,**P< 0.01,***P< 0.001。图5 流式细胞术检测Lag-3-/-小鼠ConA刺激前后CD3+T细胞比例变化Note. A, Scatter plot of the ratio of CD3+T cells in blood, spleen cells and bone marrow cells in wild-type and Lag-3-/- mice; FITC-labeled fluorescent antibody anti-CD3 assay. B, Statistical map of the ratio of CD3+T cells in blood, spleen cells and bone marrow cells of wild-type and Lag-3-/- mice. Compared to WT with ConA,*P < 0.05,**P< 0.01, ***P< 0.001.Figure 5 Changes in the ratio of CD3+T cells in Lag-3-/- mice by flow cytometry before and after ConA stimulation
2.4 Lag-3基因敲除减轻ConA诱导引起的小鼠肝损伤
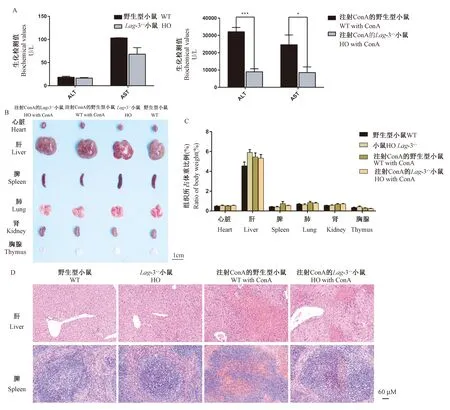
注:A:野生型小鼠和Lag-3-/-小鼠经ConA给药诱导前后,小鼠的肝功能指标变化:ALT-谷丙转氨酶,AST-谷草转氨酶,每组3只小鼠。与Lag-3-/-组或注射ConA Lag-3-/-组相比,*P< 0.05,***P< 0.001; B:ConA诱导前后小鼠主要组织病理图C:组织所占体重比;D,野生型小鼠和Lag-3-/-小鼠ConA诱导前后,小鼠脏和脾H&E染色图(比例尺=60 μm)。图6 ConA诱导前后,野生型小鼠和Lag-3-/-小鼠病理检测Note. A, Changes in liver function indexes of wild-type and Lag-3-/- mice before and after injection with ConA. ALT-alanine aminotransferase, AST-aspartate aminotransferase, 3 mice per group (Compared to Lag-3-/-or Lag-3-/- with ConA,*P <0.05,***P <0.001. B, Photograph of main tissues of mice before and after ConA injection. scale bar=1 cm, 3 mice per group. C, Measurement of tissue/body weight ratio of mice before and after ConA injection. D, HE staining of liver and spleen before and after ConA injection in wild type mice and Lag-3-/- mice, scale bar=60 μm.Figure 6 Pathological detection of wild-type mice and Lag-3-/-mice before and after ConA induction
分别取ConA注射前后的野生型和Lag-3-/-小鼠血清,进行血生化指标检测,如图6A所示:诱导前两组小鼠的肝功能指标谷丙转氨酶(ALT)和谷草转氨酶(AST)水平无差异,注射ConA后,两组小鼠的肝功能指标ALT和AST均有大幅度增加,但野生型小鼠的ALT和AST增幅比Lag-3-/-小鼠更大,两组小鼠之间有显著性差异;分别取诱导前后的野生型和Lag-3-/-小鼠的心脏、肝、脾、肺、肾和胸腺组织进行称重和病理检测,结果发现:诱导前后各组小鼠的心脏、肝、脾、肺、肾和胸腺按组织/体重比分析,差异无显著性(图6C);取组织拍照(图6B)并进行H&E染色后病理学观察(图6D),发现诱导后野生型小鼠的肝和脾组织充血更明显。该结果说明Lag-3基因敲除可以减轻ConA诱导的肝损伤。
3 讨论
在过去十年中,旨在激活免疫系统以攻击癌细胞的疗法是对抗癌症的重要策略之一。
我们利用CRISPR/Cas9基因编辑技术,通过受精卵直接注射Cas9 mRNA和guideRNA,构建了C57BL/6背景的Lag-3-/-小鼠模型,获得的F0代小鼠80%都可以检测到CRISPR/Cas9介导的基因编辑效果,证明我们的设计方案和采用的方法是一个高效快速获得Lag-3基因敲除小鼠的方法。
通过对小鼠心脏、脾、肺、巨噬细胞和淋巴结Lag-3 RNA水平表达检测发现,基因敲除纯合子小鼠只能检测到本底信号,证明RNA水平实现了对Lag-3基因的敲除。在随后的蛋白水平验证发现,尽管Lag-3具有广泛的表达谱[12],但根据我们在预实验中采用流式检测的方法发现:正常情况下,小鼠的脾、腹腔巨噬细胞、骨髓和淋巴结的Lag-3表达水平很低(数据未显示),而刀豆蛋白A(concanavalin A, ConA)处理可以显著上调小鼠体内腹腔巨噬细胞、淋巴结和脾Lag-3的表达,这与以前的报道,活化的T细胞中Lag-3表达上调相一致。野生型小鼠和Lag-3-/-小鼠的对比发现,与ConA处理前相比,野生型小鼠Lag-3表达明显上调,而Lag-3-/-小鼠心脏、脾和腹腔巨噬细胞中Lag-3 mRNA处于本底水平,与野生型小鼠相比有显著区别,同样流式检测方法检测腹腔巨噬细胞、脾细胞和淋巴结中Lag-3的表达情况,发现其蛋白表达也在本底水平。 这些数据表明,我们已成功构建Lag-3基因敲除小鼠品系。
对Lag-3基因敲除小鼠的初步表型分析发现,Lag-3-/-小鼠骨髓中的CD3+T细胞比例显著减少,而外周血和脾中的CD3+T细胞比例没有显著性变化;但我们用T细胞激活的刺激剂ConA处理小鼠后发现,Lag-3-/-小鼠无论骨髓、外周血还是脾中的CD3+T细胞比例较野生型小鼠均有非常显著降低,尤其Lag-3-/-小鼠外周血CD3+T细胞比例只有野生型的1/15,我们推断Lag-3的缺失影响了T细胞的增殖,造成无法响应ConA的刺激。
ConA作为一种T细胞激活剂,在动物实验中,经常用于诱导急性肝损伤,模拟人类肝脏自身免疫性肝炎和病毒性肝炎。ConA刺激初步表型分析结果显示,基因敲除小鼠可能在肝损伤方面有相应的表型缺陷。另外,根据2018年Wang等[13]新的研究结果,与原来认为的MHC-II是Lag-3唯一的配体不同,纤维蛋白原样蛋白1(FGL1)而非MHC-II是Lag-3主要的功能配体。FGL1是一个分泌蛋白,正常情况下,在体内主要在肝中表达,表明Lag-3可能在肝生理病理过程中发挥重要功能。基于这两方面的证据,我们用ConA诱导的急性肝损伤模型对野生型和Lag-3-/-小鼠的响应情况进行了比较分析,结果显示Lag-3基因敲除可以显著减轻ConA诱导的急性肝损伤。目前对Lag-3研究的热点,主要集中在其作为一个重要的肿瘤免疫治疗靶点,通过与PD1靶点的协同作用进行抗肿瘤研究[5-6]。我们的研究结果显示,Lag-3也可能是一个治疗急性肝损伤的靶点,目前多家药企已经开发了相应的抗体药物,并且进入临床,这些药物后续也有可能用于自身免疫性或者病毒性急性肝损伤的治疗。
综上所述,我们利用CRISPR/Cas9技术,建立了Lag-3基因敲除小鼠品系,在RNA和蛋白水平对该基因的敲除效果进行了验证,并通过ConA诱发的肝损伤模型,证明了Lag-3在急性肝损伤过程中发挥重要作用,为Lag-3体内基因功能研究提供了新的模型,为急性肝损伤的治疗提供了新的线索。
