还原型谷胱甘肽对脂多糖诱导的大鼠急性肺损伤肺泡细胞凋亡的影响
2020-05-06林育能何新荣徐佳兴钟义富陈德晖
林育能,何新荣,姚 意,徐佳兴,钟义富,陈德晖
(1.广州医科大学附属第一医院 儿科,广东 广州 510120;2.中山大学肿瘤防治中心 重症医学科,广东 广州 510060;3.中山大学肿瘤防治中心 检验科,广东 广州 510060)
急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)是各种病因导致的急性肺损伤(Acute lung injury,ALI)[1],是ICU最主要的死亡因素之一[2]。不少研究报道ARDS/ALI存在肺泡凋亡现象[3-4]。还原型谷胱甘肽(Reduced glutathione,GSH),在谷胱甘肽转移酶的作用下,能与过氧化物及自由基相结合,保护细胞膜中含巯基的蛋白质和含巯基的酶不被破坏[5],调节凋亡作用[6]。目前有关GSH对ARDS/ALI 肺泡凋亡的研究尚少。本研究拟在脂多糖(Lipopolysaccharide,LPS)诱导ARDS/ ALI的动物模型上,观察补充GSH对ARDS/ALI模型炎症损伤和肺泡细胞凋亡的变化,探讨GSH对内毒性ALI的保护作用及其可能机制。
1 材料与方法
1.1 动物模型的建立 本研究方案由广州医科大学动物伦理委员会批准,实验是按照学校有关实验动物使用的要求进行的。实验使用了40只2~3个月龄的清洁级雄性Sprague-Dawley大鼠(体重300 g左右),按照随机数纳入为伪模型组(n=10)、ALI模型组(n=15)和GSH干预组(n=15)。实验前1d将动物在实验室饲养,保持标准饮食和随意饮水。实验时,先用盐酸氯胺酮(60 mg/kg)肌肉注射麻醉后,仰卧固定于手术台上行吸入式气管滴注LPS溶液0.2 mL(3 mg/kg,Escherchia Coli O111:B4,Sigma公司,美国)建立ALI模型。然后术后皮下注射生理盐水(20 mL/kg)防止血容量不足。干预组在给予LPS后2h后,给予液体复苏的同时从尾静脉注入还原型谷胱甘肽溶液1 mL(0.3g/kg,重庆药友制药有限公司)。模型组和伪模型组给予等量的生理盐水。根据预实验的结果,于注射 LPS后6 h后使用戊巴比妥处死大鼠。
1.2 标本的采集与检测 处死大鼠时,通过心脏左心室穿刺采集大鼠的血液样品,使用GEM 3000血气分析仪作血气分析, XN9000全自动血液学分析仪进行白细胞分类计数,将血液离心收集上清液用于分析血浆中的炎症因子白介素6(IL-6)。
动物处死后结扎左支气管,收集支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)。BALF蛋白质含量使用商业试剂盒采用考马斯亮兰法检测(南京建成生物工程研究所),用于评价肺损伤的血管渗出性。血浆和BALF的IL-6浓度的测定均采用大鼠IL-6酶联免疫吸附实验(ELISA)试剂盒(武汉博士德生物工程有限公司)进行检测。BALF中可溶性凋亡相关因子配体(sFasL)浓度使用大鼠sFasL ELISA试剂盒(上海将来实业股份有限公司)检测。将BALF离心沉淀重新混悬后作瑞氏染色,进行多形核中性粒细胞(PMN)计数。将沉淀用碘化丙啶(Propidium Iodide,PI)染色法,FACSCAN流式细胞仪检测细胞凋亡,在分析PI荧光的直方图时,先用门技术排除成双或聚集的细胞以及发微弱荧光的细胞碎片,在G1/G0期前出现一亚二倍体峰(subG1)为细胞凋亡峰,以subG1占二倍体(G1/G0)的百分率计算细胞凋亡率。通过计算右肺叶组织的湿/干比评估肺组织渗出和水肿程度。取左肺叶匀浆上清液并使用试剂盒(南京建成生物工程研究所)测定肺的丙二醛(Malondialdehyde,MDA)含量,用于评估肺泡细胞损伤程度。
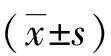
2 结果
2.1 血气分析 伪模型组大鼠在6 h观察期间,呼吸平顺。ALI模型组和GSH干预组的动物出现进行性加重的呼吸急促,与伪模型组对比,两组的血气分析均表现出氧分压下降,二氧化碳分压升高,肺的氧合指数降低(P<0.05)。但GSH干预组的氧合能力较ALI模型组显著改善(P<0.05,见表1)。
表1 3组动物血气分析结果

组别例数pH氧分压(mmHg)二氧化碳分压(mmHg)氧合指数伪模型107.33±0.04 89.8±3.5 44.2±2.3427.8±16.8ALI模型157.03±0.16#42.2±4.5# 59.2±11.3#198.3±25.5#GSH干预157.11±0.09#※46.7±4.0#※53.1±7.6 220.6±22.2#※F21.40466.14 9.50360.05P<0.05<0.05<0.05<0.05
#:与伪模型组比较P<0.05;※:与ALI模型组比较P<0.05,1 mmHg=0.133 28 kPa。
2.2 白细胞计数与IL-6含量 与伪模型组对比,ALI模型组与GSH干预组动物血液和BALF的粒细胞计数以及IL-6浓度显著升高(P<0.05)。GSH干预组的白细胞和PMN计数与比ALI模型组比较,无显著性差异(P>0.05)。GSH干预组的IL-6浓度却显著低于ALI模型组(P<0.05,见表2)。
表2 3组动物白细胞计数与IL-6含量

组别例数血液白细胞计数(×109/L)中性粒细胞(×109/L)IL-6(pg/mL)BALF中性粒细胞(×109/L)IL-6(pg/mL)伪模型107.6±2.21.5±0.670±151.8±0.394±14ALI模型1521.2±3.6#7.6±0.8#328±32#8.2±1.0#425±29#GSH干预1519.9±4.2#7.2±1.0#308±27#※7.6±1.2#388±45#※F50.71173.10329.72147.64328.51P<0.05<0.05<0.05<0.05<0.05
#:与伪模型组比较P<0.05;※:与ALI模型组比较P<0.05。
2.3 BALF蛋白与肺组织MDA含量 ALI模型组与GSH干预组的BALP的蛋白含量比伪模型组明显升高(P<0.05),但GSH试验组要显著低于ALI模型组(P<0.05)。同样地,干预组肺组织的MDA含量虽然比伪模型组高,但要低于模型组(P<0.05,见表3)。
表3 3组动物BALP蛋白与肺组织MDA含量

组别例数蛋白(g/L)MDA(nmol/mg prot)伪模型100.90±0.09 1.34±0.10 ALI模型151.97±0.20#2.56±0.31#GSH干预151.65±0.21#※2.24±0.29#※F107.3364.22P<0.05<0.05
#:与伪模型组比较P<0.05;※:与ALI模型组比较P<0.05。
2.4 BALF的sFasL浓度与细胞凋亡率 3组BALF的sFasL含量有显著性差异(F=133.47,P<0.05)。ALI模型组与GSH干预组BALF的sFasL含量均明显高于伪模型组(P<0.05)。但干预组的sFasL含量显著低于ALI模型组(P=0.023,图1A)。流式细胞仪检测的结果显示,3组的细胞凋亡率也有显著性差异(F=56.38,P<0.05),与ALI模型组比较,GSH能降低细胞的凋亡率(P=0.016,见图1B)。
2.5 肺组织湿/干比 3组大鼠的肺组织湿/干比有显著性差异(F=18.43,P<0.05)。伪模型组大鼠肺的湿/干比为3.83±0.62。ALI模型组和GSH干预组分别为6.83±1.46和5.57±1.22,均明显高于伪模型组(P<0.05),但GSH干预组的湿/干比显著低于ALI模型组(P<0.05)。

图1 3组动物BALF的sFasL浓度和细胞凋亡率
3 讨论
在本研究中,给予LPS可以诱发大鼠明显的肺部炎症和ALI,表现出明显的低氧血症。给予GSH后,BALF的中性粒细胞没有显著减少,提示GSH并不能阻止LPS引起的炎症细胞的浸润,但是能抑制炎症介质IL-6的产生。与模型对照组比较,谷胱甘肽组动物BALF的蛋白渗出减少,肺组织过氧化损伤的产物MDA含量也显著减少,肺的湿/干比降低,都说明了GSH有助于减轻LPS诱导的肺损伤,从而使得肺的氧合得到改善。在失血性休克或腹膜炎大鼠模型上有研究也发现GSH有类似的保护作用[7-8]。
不少研究发现ARDS存在肺泡细胞凋亡现象。Martin发现[3],ARDS患者BALF中的sFasL含量超过健康人,当在体外培养的支气管肺泡上皮细胞中加入LPS后,sFasL的释放成倍增加。Satoru[4]发现在ARDS发病24h内,患者肺泡灌洗液中的sFasL含量最为明显。我们的研究结果显示,ARDS/ALI大鼠的BALF中的sFasL显著升高,并且BALF中凋亡细胞明显增多。给予GSH处理后,ALI/ARDS大鼠BALF的sFasL含量和细胞凋亡率均显著降低,这说明通过Fas/FasL途径介导的肺泡上皮细胞凋亡应该是GSH减轻肺损伤的一个重要机制。
由于是探索性研究,本研究存在一些不足之处。首先,考虑到肺泡灌洗的影响和ARDS肺部改变的不均一性特点,没有做肺部形态学的病理检测;其次,没有直接检测肺组织Fas/FasL的mRNA表达的改变;第三,没有探讨GSH影响Fas/FasL介导的凋亡通路的机制,这也正是本研究下一步的研究方向。
