CircRNA-79530与TWIST形成正反馈回路调控滋养细胞EMT的机制
2020-05-06周俏苗陈秋霞黄海燕许晶肖美芳龚护民吴栋才
周俏苗 陈秋霞 黄海燕 许晶 肖美芳 龚护民 吴栋才
1海南省患者儿童医学中心妇产科(海口570000);2海南省人民医院妇产科(海口570000)
先兆子痫是孕产妇和新生儿高发病率和高病死率的主要原因之一[1]。先兆子痫的发病机制涉及许多因素,例如螺旋动脉重构受损,氧调节异常,全身性炎症和不适当的母体血管破坏[2]。在这些因素中,螺旋动脉重塑被认为是引起先兆子痫的关键诱因,并与绒毛外滋养层细胞的功能障碍有关[3]。TWIST 是一种诱导上皮间质转化(epithelial-mesenchymal transition,EMT)的转录因子,通过启动子激活或抑制,下调上皮表型相关基因(例如E-钙黏着蛋白)或上调间质细胞表型相关基因来控制EMT 相关基因的转录[4]。滋养层细胞在流产中的作用已受到越来越多的关注[5]。本研究立题依据是EMT 相关分子与滋养细胞的迁移和侵袭能力有关[6]。在绒毛顶端或附近与绒毛滋养层细胞区别的绒毛外滋养层细胞滋养层细胞失去了一些上皮表型,具有强大的迁移和侵袭能力[7]。滋养层细胞还分泌基质金属蛋白酶(metalloproteinase,MMP),如MMP9,并改变粘附相关分子(例如E-钙黏着蛋白,N-钙黏着蛋白和波形蛋白)的丰度[8]。这类似于肿瘤中EMT 的过程,并促进滋养层细胞迁移和侵入子宫[9]。细胞外信号调节激酶的磷酸化和AP-1 转录因子的激活是参与滋养层细胞迁移和侵袭调节的主要信号途径之一。近年来,环状RNA(circular RNA,circRNA)已被确定为转录后水平上基因表达调控的重要分子[10]。circRNA 是由非经典剪接形式产生的,最常见的情况是一个外显子的剪接供体位点与上游外显子的剪接受体位点连接[11]。circRNA 可能调节miRNA 的功能并且在转录控制中发挥作用[12]。本研究目的是探讨CircRNA-79530 与TWIST 形成正反馈回路调控滋养细胞EMT 的机制。
1 材料与方法
1.1 实验材料
1.1.1 胎盘标本采集招募20 例严重早发先兆子痫的患者和20 例非严重早发先兆子痫的患者参与本次研究,所有患者的胎龄范围为28 ~32 周。剖宫产后15 min 内获得所有胎盘样本。然后将绒毛膜组织从胎盘的中央部分分离,排除纤维化,梗塞和钙化的组织。用盐水洗涤组织以去除多余的血液后,将它们立即在液氮中冷冻并保存在-80 ℃直至使用。本研究已经获得医院医学伦理学委员会批准(批准文号2018-01152)。
1.1.2 细胞培养和质粒构建滋养层细胞HTR8/SVneo 用于本次实验,并在Dulbecco 改良的Eagle培养基中培养,并添加了10%FBS 和1%青霉素-链霉素(10 000 U/mL)。通过转染pcDNA3.0-TWIST质粒可过量表达人TWIST,根据制造商的说明,使用Lipofectamine 3000 用1 g 质粒转染在6 孔细胞板(5×105)中生长的HTR8/SVneo 细胞。6 h 后,用完全培养基代替转染溶液。
1.1.3 实验分组根据实验要求,将收集样本标本分为两组:重度先兆子痫组(严重早发先兆子痫的患者胎盘组织)和非重度先兆子痫组(非严重早发先兆子痫的患者胎盘组织);将HTR8/SVneo 细胞分为对照组和TWIST 转染组(转染pcDNA3.0-TWIST 使TWIST 过表达)。
1.2 实验方法
1.2.1 双荧光素酶报告基因检测重组荧光素酶报告质粒包含circ-79530启动子(pEZX-PG04-Cul2)和CircRNA-79530(psiCHEK)的潜在miRNA 结合位点序列-2-circ-79530)。circ-79530 启动子和TWIST 过表达或敲低载体分别共转染到PLC-PRF-5 或HTR8/SVneo 细胞中。
1.2.2 实时定量PCR(qRT-PCR)使用Trizol 试剂从胎盘组织中分离总RNA。使用SYBR Premix Ex TaqⅡ试剂盒测量TWIST 和CircRNA-79530 的表达。用ABI7900 系统进行qRT-PCR。PCR 扩增程序的初始变性步骤是在94 ℃下进行1 min 变性,然后在95 ℃下进行40 循环30 s,然后在60 ℃下进行1 min 的循环。GAPDH 和U6 分别被选作TWIST和CircRNA-79530 的内部对照。按照以下步骤进行:50 ℃3 min,95 ℃5 min,然后进行35个循环,分别是95 ℃20 s,60 ℃30 s。使用的特异性引物显示如下:TWIST-5′-AGAAGTCTGCGGGCTGTG-3′,5′-CCTCGTAAGACTGCGGAC-3′;GAPDH5′-TGTTCGTCATGGGTGTGAAC-3,5′-ATGGCATGGACTGTGGTCAT-3′。CircRNA-795305′-GGTGTGTTCAACTGTTCGGA-35′-ATGGCATGGACTGTGGTCAT-3′,根据2-△△Ct方法分析数据。
1.2.3 细胞增殖、活力测定使用5-乙炔基-2′-脱氧尿素(EdU)染色法和CCK-8 法测定细胞活力。对于EdU 染色测定,将HTR8/SVneo 细胞通透并用Click-iT EdU 成像试剂盒染色。将处理过的细胞用4%甲醛固定15 min,然后与0.5%Triton X-100温育20 min。此后,在黑暗中用0.5 mL Click-iT 反应混合物处理细胞30 min。除去反应混合物后,将细胞用PBS 中的3%BSA 洗涤,并将细胞核用1 g/mL DAPI 在黑暗中染色15 min。对于CCK-8 测定,使用细胞计数试剂盒(CCK-8)。简而言之,将HTR8/SVneo细胞用载体转染48 h。用PBS洗涤细胞3次,然后加入1∶10 稀释的CCK-8 溶液,并在37 ℃下孵育2 h。通过酶标仪在450 nm下测量结果。
1.2.4 细胞凋亡测定将在6 孔板中培养的HTR8/SVneo 细胞添加hoechst 33258 并与培养基孵育10 min,然后用PBS 洗涤细胞,倒置荧光显微镜,装有用于Hoechst 33258(365 nm)的滤光片,用于检测核形态的变化。将在6 孔板中生长的HTR8/SVneo 细胞暴露于低氧条件下并用载体转染,然后根据Annexin V-FITC 细胞凋亡检测试剂盒收集细胞并用Annexin V 和PI 染色。在具有Cell Quest 软件的FACS Calibur 仪器中分析细胞样品。
1.2.5 蛋白质免疫印迹用RIPA 裂解缓冲液(加入蛋白酶抑制剂混合物提取细胞上方的总蛋白。使用Pierce BCA 蛋白测定试剂盒测定蛋白浓度。加载约40 μg 蛋白质以进行10%含丙烯酰胺的SDS-PAGE,并转移至硝酸纤维素膜。用5%脱脂牛奶封闭后,随后使用针对GAPDH(1∶10 000)的抗体对膜进行探测。在室温下与偶联有HRP 的二抗孵育90 min后,使用增强的化学发光检测系统检测具有过氧化物酶活性的蛋白条带,并使用G-Box iChemi 化学发光图像捕获系统进行可视化。靶蛋白与GAPDH 的条带强度之比被认为是靶蛋白水平。
1.2.6 Transwell 细胞迁移和侵袭实验为了评估TWIST 对细胞迁移和侵袭的影响,将悬浮在无血清培养基中的2 × 104个HTR8/SVneo 细胞转移到24 孔transwell 的上腔室中,有或没有Matrigel,然后将含有10%FBS 的培养基放入下腔室。在37 ℃下孵育24 h 后,对迁移或侵袭的细胞进行计数,并在0.5%结晶紫在20%乙醇中染色15 min 后,在光学显微镜下拍照。每组计数五个随机选择的区域,所有测定独立重复3 次。
1.3 统计学方法本研究中数据全部采用SPSS20.0 统计分析软件(美国IBM 公司)进行处理;计量资料采用±s表示,组间比较采用单因素方差分析或者重复测量的方差分析,组间两两比较采用LSD-t检验;计数资料采用百分率(%)表示,组间比较采用χ2分析;P<0.05 为差异有统计学意义。
2 结果
2.1 重组荧光素酶检测为了探索TWIST 的转录调控,我们分析了全基因组转录TWIST 靶标。揭示了TWIST 在Cul2 及其启动子上的结合基序,使用针对TWIST 的特异性抗体对HTR8/SVneo 细胞进行ChIP-PCR 分析,显示TWIST 在CircRNA-79530 启动子上的存在,验证了ChIP-seq 结果。见图1。
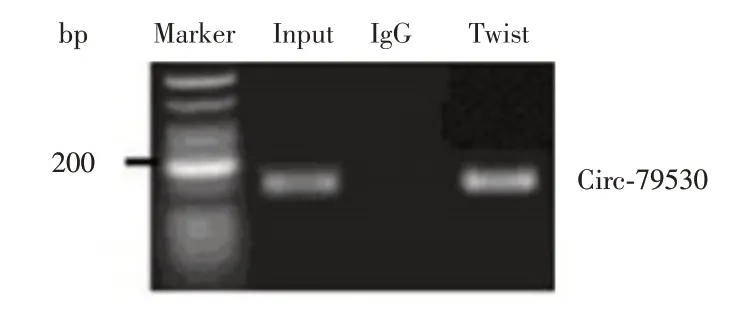
图1 重组荧光素酶检测结合位点Fig.1 Detection of binding sites by recombinant luciferase
2.2 RT-PCR 实时分析PCR 实时分析两组样本中TWIST、CircRNA-79530 的mRNA 表 达 情 况,重度先兆子痫组较非重度先兆子痫组TWIST、CircRNA-79530 的mRNA 表达降低(P<0.05)。见表1。
表1 样本TWIST 和CircRNA-79530mRNA 表达比较Tab.1 Comparison of twist and circrna-79530 mRNA expression in samples ±s
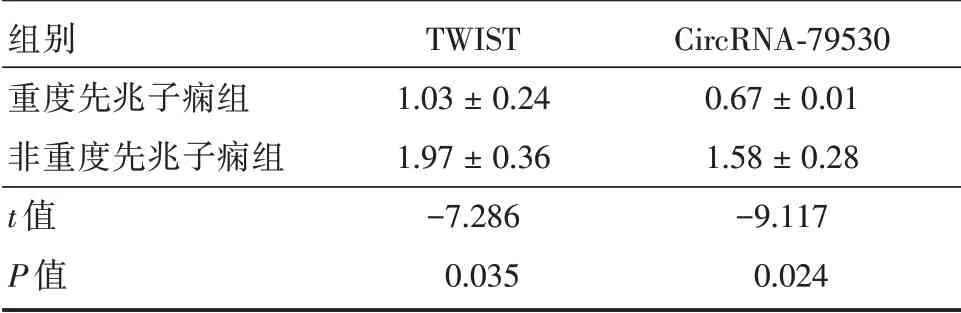
表1 样本TWIST 和CircRNA-79530mRNA 表达比较Tab.1 Comparison of twist and circrna-79530 mRNA expression in samples ±s
组别重度先兆子痫组非重度先兆子痫组t 值P 值TWIST 1.03±0.24 1.97±0.36-7.286 0.035 CircRNA-79530 0.67±0.01 1.58±0.28-9.117 0.024
2.3 细胞增殖检测对细胞增殖活力检测,发现第12 小时TWIST 转染组较对照组细胞增殖升高(P<0.05),第36 小时TWIST 转染组较对照组细胞增殖升高(P<0.01)。说明TWIST 过表达对HTR8/SVneo 细胞的增殖有促进作用。见表2。
表2 细胞增殖检测Tab.2 Cell proliferation test ±s
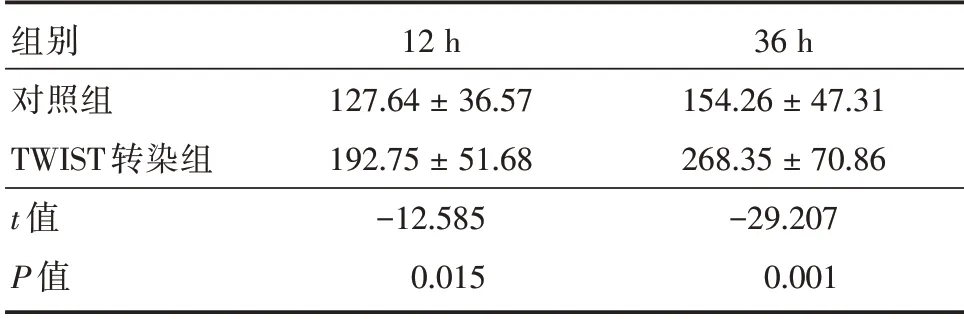
表2 细胞增殖检测Tab.2 Cell proliferation test ±s
组别对照组TWIST 转染组t 值P 值12 h 127.64±36.57 192.75±51.68-12.585 0.015 36 h 154.26±47.31 268.35±70.86-29.207 0.001
2.4 细胞凋亡及活力检测细胞在培养36 h 根据制造商的规程使用凋亡检测试剂盒进行检测细胞凋亡情况,对照组较TWIST 转染组细胞凋亡率升高(P<0.05),TWIST 转染组较对照组细胞活力升高(P<0.05)。在Hoechst 33358 染色的帮助下,笔者观察到TWIST 过表达可减少凋亡细胞的数量。见图2,表3。

图2 Hoechs 染色检测细胞凋亡情况Fig.2 Detection of apoptosis by hoechs staining
表3 细胞凋亡及活力比较情况Tab.3 Comparison of cell apoptosis and viability ±s
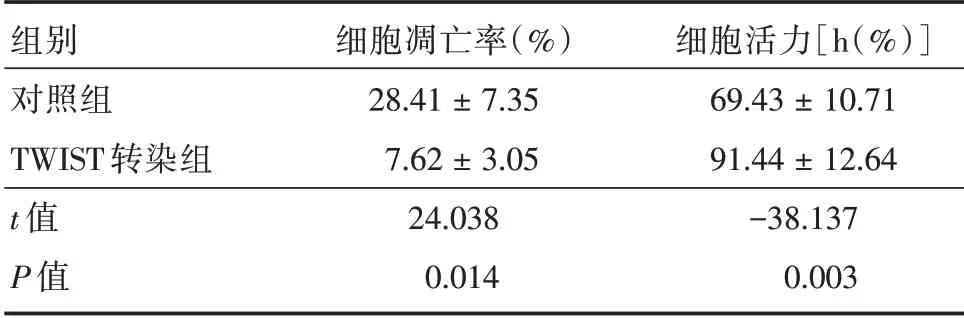
表3 细胞凋亡及活力比较情况Tab.3 Comparison of cell apoptosis and viability ±s
组别对照组TWIST 转染组t 值P 值细胞凋亡率(%)28.41±7.35 7.62±3.05 24.038 0.014细胞活力[h(%)]69.43±10.71 91.44±12.64-38.137 0.003
2.5 TWIST 促进细胞EMT 发生蛋白印迹检测HTR8/SVneo 中EMT 过程相关因子蛋白表达情况,对照组较TWIST 转染组E-钙黏附蛋白、波形蛋白、β-连环蛋白、MMP9 表达降低(P<0.05)。说明TWIST 促进细胞的EMT 的发生。见表4。
2.6 TWIST 促进HTR8/SVneo 细胞侵袭转移通过迁移和侵袭无实验测定检测TWIST 对细胞的影响作用,对照组较TWIST 转染组细胞迁移数量、细胞侵袭减少(P<0.05),TWIST 促进滋养层细胞迁移和侵袭。见图3、表5。
表4 蛋白印迹分析EMT 蛋白表达Tab.4 Western blot analysis of EMT protein expression ±s
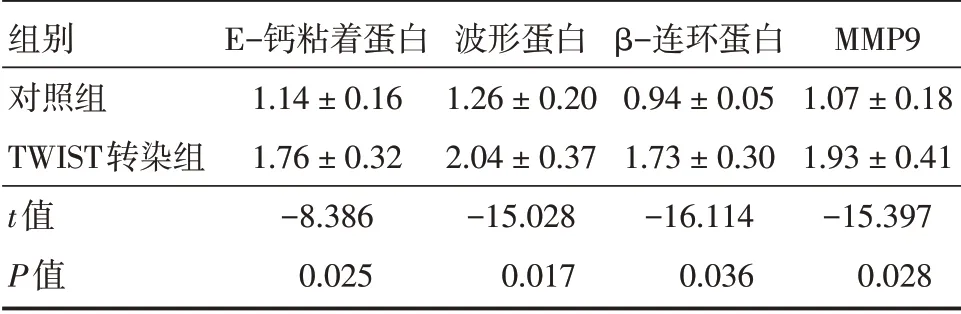
表4 蛋白印迹分析EMT 蛋白表达Tab.4 Western blot analysis of EMT protein expression ±s
组别对照组TWIST转染组t值P值E-钙粘着蛋白1.14±0.16 1.76±0.32-8.386 0.025波形蛋白1.26±0.20 2.04±0.37-15.028 0.017 β-连环蛋白0.94±0.05 1.73±0.30-16.114 0.036 MMP9 1.07±0.18 1.93±0.41-15.397 0.028

图3 细胞侵袭与迁移Fig.3 Cell invasion and migration
表5 细胞侵袭转移测定Tab.5 Determination of cell invasion and metastasis ±s

表5 细胞侵袭转移测定Tab.5 Determination of cell invasion and metastasis ±s
组别对照组TWIST 转染组t 值P 值细胞迁移×102(个)3.87±0.35 11.27±2.86-15.247 0.019细胞侵袭×102(个)1.88±0.21 7.24±1.28 10.034 0.025
2.7 凋亡蛋白指标检测蛋白印迹分析caspase-3、Bax 蛋白表达升高(P<0.05),TWIST 转染组较对照组Bcl-2 蛋白表达升高(P<0.05)。见表6。
3 讨论
滋养层细胞的异常迁移和侵袭与妊娠的一些常见并发症有关[12]。在植入和胎盘发育阶段,滋养细胞参与子宫螺旋动脉重塑和胎盘床脉管系统发育,其缺陷会导致胎盘疾病,例如自然流产,先兆子痫和胎儿生长受限[13]。本研究证明TWIST 通过与靶基因CircRNA-79530 结合,并上调CircRNA-79530的表达。接下来,本研究证明CircRNA-79530与TWIST 正相关,并促进了EMT 进展。最近,非经典的剪接体机制重新发现并产生了circRNA。异质circRNA 组及其作为竞争性内源RNA 的功能改变了学界对癌症的看法,尤其是在癌变和癌症进展方面。有趣的是,单个基因位点可通过其他反向剪接产生多个circRNA。这种选择性剪接还可以扩展circRNA 的多样性,并且一些盒外显子比线性mRNA 更有利地包含在circRNA 中。笔者发现TWIST 的外源表达促进了circRNA 形成的转录。CircRNA-79530 与不良预后相关,并促进HTR8/SVneo 细胞的转移和进展。子痫前症可导致高胎儿发病率和怀孕导致的病死率。临床上其复杂的致病和危险综合症增加了对先兆子痫患者的治疗和护理难度。越来越多的证据表明,TWIST 和CircRNA-79530 在先兆子痫的发病机理和发展中起着重要作用[14]。本研究发现胎盘组织中TWIST 和CircRNA-79530 的表达下调。TWIST 的过度表达促进了滋养细胞的增殖,转移和EMT 的形成,而TWIST 的沉默则表现出相反的作用。生物信息学分析表明,CircRNA-79530是TWIST的直接靶标,在滋养细胞中受TWIST 正调控。TWIST 已显示在人胎盘,高侵害性EVT 和HTR-8/ SV neo 细胞中高表达,并在癌细胞的存活和侵袭中发挥重要的积极作用[15]。在低氧条件下,TWIST 的表达在人胎盘的滋养细胞中显示为异常[16]。本研究显示与非重度先兆子痫患者相比,TWIST 表达在重度先兆子痫患者中降低。此外TWIST 的过表达减少了HTR-8/SVneo 细胞的凋亡并增强了增殖,迁移和侵袭以及管的形成。这些发现表明,TWIST 可能是调节子痫前期发展和进程的重要因素。
表6 凋亡蛋白指标检测情况Tab.6 Detection of apoptotic protein index ±s

表6 凋亡蛋白指标检测情况Tab.6 Detection of apoptotic protein index ±s
组别对照组TWIST 转染组t 值P 值caspase-3 1.82±0.24 1.03±0.12 7.238 0.025 Bax 1.73±0.22 1.01±0.10 8.087 0.017 Bcl-2 1.32±0.18 2.14±0.36-13.114 0.036
TWIST 是胚胎发育和肿瘤生物学中公认的转录因子[17]。发现TWIST 功能障碍在许多恶性肿瘤的癌症发生、增殖、血管生成、侵袭和转移中起着重要作用[18-19]。TWIST 被认为是通过抑制细胞凋亡来促进肿瘤起始和存活的癌蛋白。TWIST 下调促进细胞生长停滞,而TWIST 过表达抑制细胞衰老并响应遗传毒性损伤而促进细胞增殖。与此相符,笔者表明TWIST 的过表达抑制了HTR-8/SVneo细胞的凋亡并增强了增殖。TWIST 已被证明具有抑制由多种刺激(例如p53、化学疗法、TNF-α)诱导的凋亡的能力。TWIST 介导的凋亡抑制作用由caspase 途径调控。TWIST 是凋亡过程中caspase 途径的底物。半胱氨酸蛋白酶对TWIST 的加工导致泛素化和蛋白酶体介导的降解。在本研究中,caspase 3 表达增加可能是导致缺氧治疗的HTR-8/SVneo 中TWIST 表达减少的原因。许多证据表明,TWIST 通过增强侵袭性伪足的形成、迁移和外渗,参与了肿瘤的侵袭和转移过程。这与发现TWIST增强与癌转移中ECM 分解有关的MMP3,MMP2,MMP9 的表达有关。与这些发现一致,笔者观察到TWIST 过表达诱导了MMP9 表达的增加。同样,在本研究中,TWIST 过表达被证明可促进HTR-8/SVneo 细胞的体外迁移和侵袭。此外,发现TWIST诱导的HTR-8/SVneo 细胞侵袭与E-钙黏蛋白上调有关,因为TWIST 可以与E-钙粘蛋白启动子结合并下调E-钙黏蛋白基因启动子的活性。基质胶上细胞体外管的形成是许多生物学事件的结果,包括细胞增殖、迁移、细胞间相互作用和细胞伸长。尽管这不能完全模仿体内血管生成的整个过程,但它反映了孕早期滋养层细胞的潜在整体功能。
笔者认为,CircRNA-79530 与TWIST 形成正反馈回路:滋养细胞中TWIST正调控CircRNA-79530;CircRNA-79530 与不良预后相关,并促进HTR8/SVneo 细胞的转移和进展;TWIST 通过增强侵袭性伪足的形成,迁移和外渗参与了肿瘤的侵袭和转移过程;该过程很可能是通过TWIST 正调控CircRNA-79530 推进实施的。
综上所述,TWIST 直接与CircRNA-79530 结合形成正反馈,促进滋养细胞的增殖活力,有助于EMT 和细胞的迁移侵袭能力。
