Mg2+-CO32--Gly--H2O体系热力学分析
2020-05-06窦爱春刘云建苏明如吴江华
窦爱春 刘 彤 张 也 刘云建 苏明如 吴江华
(1.江苏大学 材料科学与工程学院,江苏 镇江 212013;2.长沙矿冶研究院有限责任公司,长沙 410000)
次生氧化矿中通常有价金属品位低、杂质含量高,采用传统火法和酸法处理效率不高,配合物碱性体系浸出方法以其独特的选择性而备受青睐。以NH3、Cl-以及OH-为主要研究配体的氨法和碱法就是其中的经典,尽管其应用范围已经由最初的氧化锌矿,拓展到处理氧化铜矿[1-2]、红土镍矿[3-4]、氧化铅矿[5]以及铅锌尘泥[6-8],发展比较迅速,也取得了比较好的实验结果。但其配体本身性质及其与金属离子配合能力问题仍是其短板[9,13-17],一定程度上制约了其大规模工业化应用。
氨基酸盐法[9-12]的发展为配合物碱性体系浸出方法引入了新的研究配体,氨基酸类配体成本价格不一,某些比NH3、Cl-以及OH-与金属离子配合能力更强的氨基酸类配体成本也许更低,而且氨基酸盐法浸出条件为弱碱性,操作条件更为温和,且氨基酸本身对人体和环境毒副作用小。
钙、镁均为次生氧化矿中大宗杂质,实践表明[9-12],氨基酸盐法对钙镁有非常好的选择性,这也是该法的一大特点。作为一类新的配合物碱性体系浸出方法,氨基酸盐法在基础理论研究方面需要进一步跟进,才能支撑下一步的拓展应用。作者已经就部分氨基酸类配体对钙镁的选择性作了相应热力学分析[13-17],揭示了钙镁在体系中的溶解行为实质。本文对Mg2+-CO32--Gly--H2O体系热力学进行了深入研究,构建了碳酸镁(MgCO3)在氨基乙酸盐(Gly--H2O)体系中溶解平衡热力学模型,期望能够解释镁溶出行为的实质,可以为氨基乙酸盐法对镁的选择性提供理论依据。
1 Mg2+-CO32--Gly--H2O体系热力学模型
MgCO3为Mg2+-CO32--Gly--H2O体系中仅有的平衡固相,与以往研究方法[13-17]相同,热力学模型基于体系中可能存在的如下平衡反应建立:水溶液体系中水的电离反应;难溶化合物MgCO3离解反应;CO32-和Gly-加合质子反应;Gly-、OH-、HCO3-、CO32-与Mg2+的配合反应。
1)H2O电离平衡
水的离子积常数表述为:
Kw=[H+][OH-]
(1)
2)MgCO3离解平衡
难溶化合物MgCO3离解反应:
(2)
其溶度积:
(3)
忽略空气中CO2在Mg2+-CO32--Gly--H2O体系中溶解平衡,由反应(2)可得:
(4)
3)CO32-平衡
CO32-加质子反应及其平衡常数为:
(5)
除加质子反应外,CO32-还可能与Mg2+发生配位反应,相关反应及平衡常数为:
(6)
CO32-一级加质子产物HCO3-也可能与Mg2+发生配位反应,相关反应及平衡常数为:
(7)
由式5~7可得碳酸根离子总浓度([CO32-]T):
(8)
4)Mg2+平衡
体系中Gly-和OH-也可能与Mg2+发生配位反应,相关反应及平衡常数为:
Mg2++Gly-Mg(Gly)+
(9)
Mg2++OH-Mg(OH)+
(10)
由式(6)、(7)、(9)、(10)可得镁离子总浓度([Mg2+]T):
(11)
5)Gly-平衡
Gly-除与Mg2+发生配位反应,其也可能发生加质子反应,相关反应及平衡常数为:
Gly-+yH+HyGlyy-1
(12)
由式(9)、(12)可得氨基乙酸根离子总浓度([Gly-]T):
(13)
上述模型中,有式(1)、(3)、(4)、(8)、(11)、(13)总计6个平衡方程,其中,热力学常数为已知,剩余[H+]、[OH-]、[Mg2+]T、[Mg2+]、[CO32-]T、[CO32-]、[Gly-]T和[Gly-]共计8个未知数,按以往研究方法[13-17]和浸出实践,对[Gly-]T和[H+]进行赋值,用MATLAB软件编程计算可求解剩余6个未知数。实际矿物浸出过程是若干个非常复杂反应进程,众多离子间相互干扰,为了更加切合实际,本文中尽量选取离子强度高的热力学数据(表1)进行计算。

表1 298 K时相关物种热力学数据Table 1 Thermodynamic data of related species at 298 K
注*H2O和*MgCO3数据分别表示水的离子积常数和碳酸镁溶度积常数。
2 结果与讨论
随着[Gly-]T在浓度0~2.5 mol/L和pH值在5~14范围内的变化,用MATLAB软件将热力学计算结果分别绘制成曲面图。
2.1 镁离子总浓度变化
体系溶液中镁离子总浓度[Mg2+]T变化如图1所示。
图1a显示,pH值小于7时,MgCO3在酸性Gly--H2O体系有一定的溶解度,且随着体系pH值升高,MgCO3溶解度急剧下降;图1(a)中,MgCO3在碱性Gly--H2O体系中溶解度非常低,而且不能分辨出明显变化趋势。
结合1(b)可见,在pH值7~14时,随着pH值进一步升高,MgCO3溶解度进一步下降;至pH值8~13范围内变化趋于平缓;pH值大于13时,MgCO3溶解度有所提高,应该是高pH值条件下,OH-参与对Mg2+的配合作用所导致的。整体来看,在pH值7~14碱性范围内,MgCO3溶解度在Gly--H2O体系中极低,碳酸镁溶解度小于0.006 mol/L(144 mg/L),说明碳酸镁在碱性Gly--H2O体系中不可能大量溶解。

图1 [Mg2+]T与[Gly-]T和pH值的变化曲面关系Fig.1 Impact of pH and [Gly-]T on [Mg2+]T
2.2 游离镁离子浓度变化
体系溶液中游离镁离子浓度[Mg2+]变化如图2所示。比较图2和图1(a)可以发现,[Mg2+]与[Mg2+]T变化趋势基本相同,当pH值小于7时,[Mg2+]值仅略低于[Mg2+]T值。这表明在Mg2+-CO32--Gly--H2O体系中,镁主要是以游离Mg2+形式存在;并且少量的Mg2+与Gly-、CO32-、HCO3-和OH-均部分生成配合物,以相应的配离子形式存在。由此可见,MgCO3在酸性Gly--H2O体系中的溶解仍以酸溶作用为主。
当pH值在7~14内,因为Gly-、CO32-、HCO3-、OH-会与Mg2+生成配合物,理论上[Mg2+]值会逐渐降低,但由于图2中[Mg2+] 值极小,并不能明显分辨出该现象。因此对游离镁离子浓度取对数分析如图3。
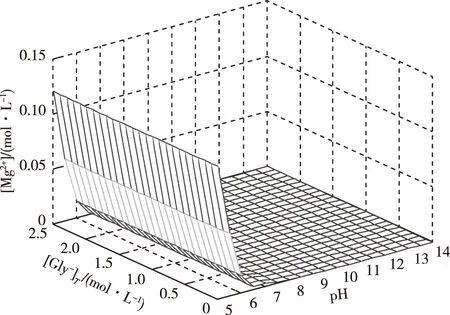
图2 [Mg2+]与[Gly-]T和pH值的曲面关系Fig.2 Impact of pH and [Gly-]T on [Mg2+]
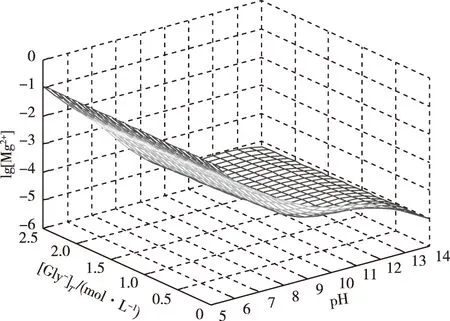
图3 lg[Mg2+]与[Gly-]T和pH值的曲面关系Fig.3 Impact of pH and [Gly-]T on lg[Mg2+]
图3显示,当pH值升高时,由于配体与镁离子的配合作用,使得镁离子在体系溶液中的浓度逐渐降低,并且游离镁离子浓度极低。以上说明,MgCO3在碱性Gly--H2O体系中的溶解以配合作用为主。尽管如此,从图1中可以看出,上述配体与镁离子的配合作用也不能从根本上解决MgCO3的溶解问题,结果表明Gly-、CO32-、HCO3-、OH-这些配体的配合能力较弱,不能够满足要求。
2.3 游离氨基乙酸根离子浓度变化
游离氨基乙酸根[Gly-]离子浓度随[Gly-]T和pH值的变化如图4所示。图4表明,当pH值在5~7范围内,[Gly-]值非常小,几乎为0,表明Gly-在酸性条件下近乎完全被其加质子作用和所形成的镁配离子约束,使得游离Gly-极少。

图4 [Gly-]与[Gly-]T和pH值的曲面关系Fig.4 Impact of pH and [Gly-]T on [Gly-]
当pH值在7~11.5范围内,溶液体系的碱性逐渐增强,使得体系中的H+减少,同时Gly-与H+的加质子作用减弱,导致溶液中出现大量的游离Gly-。但是Mg2+与Gly-的配合能力较弱,最终溶液体系中大量的游离Gly-过剩,这一点可以表明[Gly-]值会随溶液的pH值升高而逐渐增大;因此当pH值达到11.5之后,[Gly-]值就已经接近[Gly-]T值,这就表明在pH值为11.5时,Gly-加质子作用已经基本结束,另一方面也表明溶液体系中只有少量的游离Gly-与Mg2+形成了镁配离子。
2.4 游离碳酸根离子浓度变化
游离碳酸根[CO32-]离子浓度随[Gly-]T和pH值的变化如图5所示。
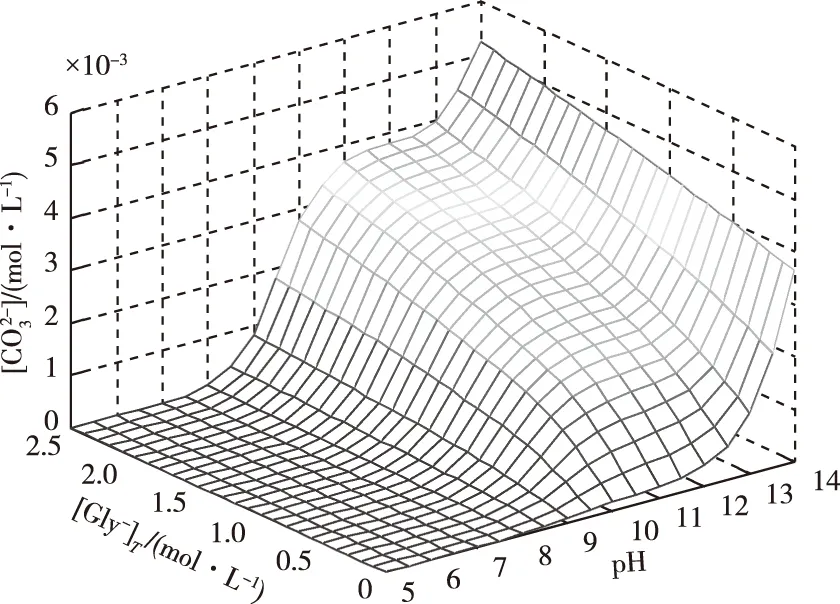
图5 [CO32-]与[Gly-]T和pH值的曲面关系Fig.5 Impact of pH and [Gly-]T on [CO32-]
通过对比图4与图5可以发现CO32-与Gly-相似,CO32-不仅能够与镁离子形成配合物,同时其本身也存在加质子作用,这就使得其呈现出与Gly-相似的变化趋势。但[CO32-]的变化会受MgCO3溶度积规则的制约,而[Gly-]却没有,这一点[CO32-]与[Gly-]变化趋势会发生差异。图5中的[CO32-]数值非常低,其数量级为10-4mol/L;此外,通过对比图4、图5中配体随pH值变化的趋势能够看出,当pH值达到11.5之后,图4中[Gly-]的数值开始保持稳定,且趋近于[Gly-]T值;而图5中的pH值接近12.5之后,[CO32-]值却有逐渐增大的趋势,这是由溶液体系中[Mg2+]降低的原因导致。当pH值很高时,OH-与Gly-同时对Mg2+作用形成协同配位,因此溶液中的[Mg2+]进一步降低,由于溶度积规则的影响,于此相应也会造成[CO32-]增大的现象。在图3中pH值超过12.5时,[Mg2+]值明显降低也可验证上述阐述。
2.5 Mg2+物种分布
Mg2+-CO32--Gly--H2O体系中含Mg2+类别包括Mg2+、Mg(Gly)+、Mg(OH)+、MgCO3(aq)和Mg(HCO3)+。通过对比上述不同含Mg2+物种浓度占比[Mg2+]T,如图6所示,可以得到,在酸性条件下(pH<7),溶液体系中含镁的物种以游离Mg2+为主,此处[Gly-]T值范围为0.1~2.5 mol/L。当然,除游离Mg2+外,还有Mg(Gly)+与Mg(HCO3)+两种物种能够显现出来,但从图中很明显的观察到,Mg(Gly)+配离子占比在酸性条件下却并不占优势,表明在酸性条件下,Gly-与HCO32-与Mg2+形成配位。随后逐渐提高溶液体系pH值,溶液中的H+减少,与此同时,CO32-与Gly-的加质子作用开始减弱,导致溶液中游离Mg(HCO3)+与Mg2+的浓度降低,Mg(Gly)+则增加。由此说明,在酸性条件下,MgCO3在Gly--H2O体系中的溶解仍以酸浸作用为主。
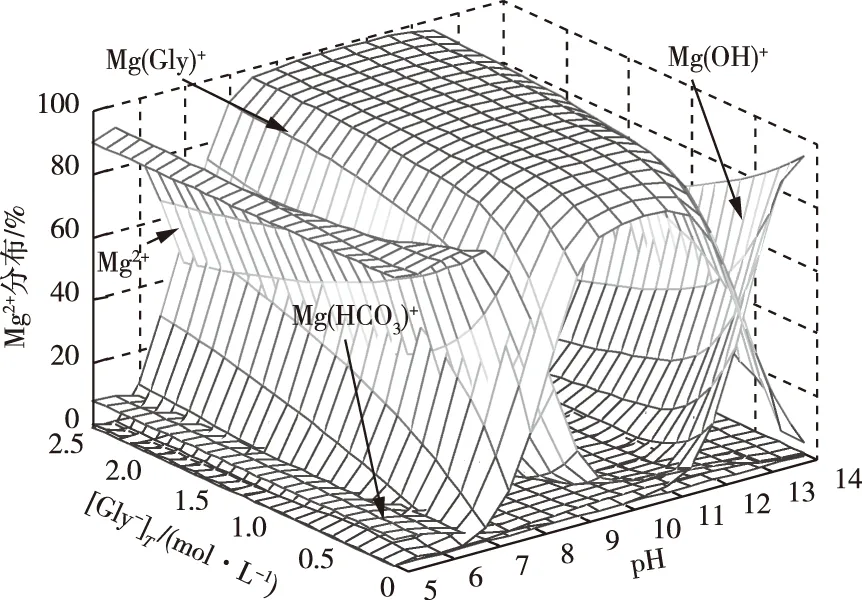
图6 Mg2+-CO32--Gly--H2O体系中镁物种分布Fig.6 Species distribution of Mg2+ in Mg2+-CO32--Gly--H2O system
图6显示,在碱性条件下(7 综上,Mg2+-CO32--Gly--H2O体系在碱性环境中以Mg(Gly)+占主导优势,其次是游离Mg2+与Mg(OH)+两类含镁物种可以显现,而MgCO3(aq)并未显现,说明Mg2+与CO32-的配合作用在该pH值研究范围内可以忽略。Mg(OH)+是在pH值升至12的时候开始显现,随体系溶液的pH值升高,Mg(OH)+在溶液中的比例迅速增长,Mg(Gly)+在溶液中的占比迅速降低,也就是表明此时体系中,镁的溶出结果是Gly-与OH-均参与和Mg2+的配位作用,图1(b)可见,受该作用的影响,[Mg2+]T有所提高,但仍未对MgCO3的溶出境况造成本质改变,其溶解度仍然非常低。 因此Mg2+-CO32--Gly--H2O体系在碱性条件下,镁的溶出结果主要是配体Gly-和Mg2+的配合作用。尽管在强碱条件下,OH-也会参与对Mg2+的配位作用,但OH-和Gly-相似,不易与Mg2+配合作用,导致镁极难被溶出。充分表明在碱性Gly--H2O体系中,MgCO3不可能被大量溶出。 在Mg2+-CO32--Gly--H2O体系中含Gly-的物种包括Gly-、Mg(Gly)+、HGly以及H2Gly+。通过对比上述不同含Gly-物种浓度占比[Gly-]T,此时[Gly-]T值范围是0.1~2.5 mol/L。如图7所示,可以得到在pH值5~14研究范围内,明显含Gly-的物种只有Gly-与HGly,但是占比总和超过99%。 图7 Mg2+-CO32--Gly--H2O体系中Gly-物种分布Fig.7 Species distribution of Gly- in Mg2+-CO32--Gly--H2O system 图7可见,随着pH值逐渐增大,H+浓度不断降低,造成Gly-加质子作用逐渐减弱,导致HGly(一级加质子)在溶液中的占比逐渐降低。于此同时,随着pH值进一步提高,HGly逐渐向游离Gly-转化,导致Gly-占比逐渐上升。当pH值升至11.5时,HGly在溶液体系中的占比已经低于2%,而游离Gly-占比增大至98%以上,表明Gly-加质子作用在pH值11.5时已基本结束。另外在相应的pH值条件下,H2Gly+和Mg(Gly)+两个物种均一直未显现,说明两点:其一是在pH值5~14研究范围内,Gly-二级加质子作用可以基本忽略;其二也通过计算结果发现配合物Mg(Gly)+在体系中的占比小于0.8%。证明即使存在过量的游离Gly-,但由于Gly-与Mg2+配合能力较弱,最终仅有微量Gly-与Mg2+配位形成配离子,显然表明在碱性Gly--H2O体系中,MgCO3仍然不可能被大量溶出。 通过以上热力学计算结果可以证明以下两点,为氨基乙酸盐体系对镁的选择性理论基础上提供了充分依据。 1)MgCO3可以在酸性Gly--H2O体系中被大量溶出,但不是通过Gly-与Mg2+的配合作用,其溶出的实质是酸浸作用; 2)MgCO3在碱性Gly--H2O体系的溶解主要是Gly-与Mg2+的配合作用,但又因为Gly-与Mg2+的配合能力较弱,导致MgCO3在碱性Gly--H2O体系中不可能被大量溶出。2.6 含Gly-物种分布

3 结论
