菠萝蜜低聚肽的免疫调节作用研究
2020-05-05郝云涛刘欣然毛瑞雪康家伟胡佳妮
郝云涛,珠 娜,刘欣然,毛瑞雪,刘 睿,康家伟,乌 兰,胡佳妮,李 勇
(北京大学公共卫生学院营养与食品卫生学系,北京 100191)
人体免疫系统可识别和清除外来病原微生物及体内的突变细胞、衰老死亡细胞或其它有害成分,以保持机体健康、避免各种疾病的发生[1]。但随着现代生活节奏加快,许多外界因素如工作压力和心理压力加大、空气污染及重金属暴露、肥胖等使人类免疫系统功能降低,各种疾病的发病率呈增长趋势[2-6]。随着现代医学及细胞分子生物学的发展,人们意识到机体免疫系统缺陷及功能失调与很多疾病的发生、发展关系密切。因此,从调节免疫功能入手,防治机体疾病已得到广泛重视。
免疫调节剂可调节机体免疫功能,对免疫功能低下、继发性免疫功能缺陷和某些肿瘤等疾病具有防治作用;目前国内外关于免疫调节剂的研究主要集中在中药、化学性药物及生物制剂,近年来从食物中提取的生物活性肽对免疫功能的调节作用成为研究热点[7-8]。据文献报道,人参低聚肽、海参寡肽、乌鸡肽等均具有免疫调节的作用[9-11]。菠萝蜜引进我国已有上千年历史,营养成分丰富,具有多种保健功效[12-14]。有研究指出,菠萝蜜果肉及种子蛋白含量丰富,远高于其他常见水果[15-16]。菠萝蜜低聚肽(jackfruit oligopeptides,JOPs)是利用生物酶解技术从菠萝蜜果肉及种子中制取得到的小分子生物活性肽,主要成分是活性小分子寡肽,具有高于蛋白质和多肽的生物活性[17]。但目前未见有关JOPs功能的研究报道,JOPs在免疫调节功能领域的研究更是处于空白。本研究通过JOPs长期干预BALB/c小鼠,系统探究了JOPs的免疫调节作用,为其作为增强机体免疫功能的新型保健食品的开发及应用提供研究基础。
1 材料与方法
1.1 材料与仪器
160只SPF级BALB/c雌性健康小鼠 6~8周,体重18~22 g,由北京大学医学部实验动物中心提供,许可证号:SYXK(京)2016-0041;JOPs 淡黄色固体粉末,主要成分为分子量<1000 Da的寡肽,具体分子量分布为71~110 Da(7.4%)、150~379 Da(80%)、515~1 113 Da(12.6%),海南盛美诺生物技术有限公司;刀豆蛋白A(ConA) 西格玛奥德里奇(上海)贸易有限公司;胎牛血清 索莱宝公司;RPMI1640培养基 Hyclone公司;小鼠淋巴瘤细胞(YAC-1细胞) 北京爱特蒙科技有限公司;噻唑蓝(MTT) 西格玛奥德里奇(上海)贸易有限公司;姬姆萨染液 北京宝瑞杰科技有限公司;印度墨水 北京宝瑞杰科技有限公司;鸡红细胞、绵羊红细胞(SRBC) 北京大学医学部实验动物中心。
Eppendorf高速冷冻离心机(Eppendorf AG)、Bio-Rad550型酶标仪 美国伯乐公司;Sanyo二氧化碳培养箱 日本三洋公司;CK40-SL倒置显微镜 OCI公司;FACSCalibur流式细胞仪 北京大学医学部中心实验楼提供。
1.2 实验方法
1.2.1 实验动物 160只SPF级BALB/c雌性健康小鼠分笼饲养,4只/笼,自由饮水、饮食,饲喂普通饲料。小鼠饲养于动物房屏障环境,温度24~26 ℃,相对湿度50%~60%,保持12 h/12 h光暗周期节律室内照明,照明时间7:00~19:00。
1.2.2 实验动物分组与用药 160只BALB/c小鼠,适应1周后依据体重随机分成5组:空白对照组、乳清蛋白组(0.40 g/kg·bw),及低、中、高3个JOPs干预组(0.20、0.40、0.80 g/kg·bw),各组再依据体重随机分成4个亚组(8只/组)。灌胃干预,空白对照组灌蒸馏水,其余各组灌规定浓度的乳清蛋白、JOPs水溶液。灌胃1次/d,连续30 d,干预结束行小鼠碳廓清实验、迟发型变态反应实验、血清溶血素水平测定、抗体生成细胞检测、腹腔巨噬细胞吞噬鸡红细胞实验、小鼠体重及免疫器官相对重量检测、ConA诱导的脾淋巴细胞转化实验、NK细胞活性检测及流式细胞术检测脾脏T淋巴细胞亚群比例。
1.2.3 小鼠体重及免疫器官相对重量检测 取同一亚组小鼠共40只,称重后颈椎脱臼处死小鼠,分离胸腺及肝脏并称重,计算脏器指数[9]。
1.2.4 迟发型变态反应实验、血清溶血素水平测定、抗体生成细胞检测 取同一亚组小鼠共40只,实验第26 d腹腔注射2%(v/v)SRBC 0.2 mL免疫小鼠,4 d后相同时间测量小鼠左后足跖部厚度,然后同一部位皮下注射20%(v/v)SRBC 20 μL,24 h后测量同一部位足跖部厚度,均测量3次,取平均值,观察足跖增厚度[18]。摘眼球法采血,放置1 h后离心收集血清,进行血清溶血素水平测定[9]。颈椎脱臼处死小鼠,剖取脾脏,进行抗体生成细胞检测(Jerne改良玻片法)[19]。
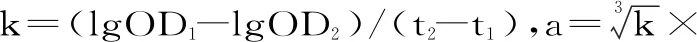
1.2.6 腹腔巨噬细胞吞噬鸡红细胞实验 取同一亚组小鼠共40只,均腹腔注射20%(v/v)鸡红细胞1 mL。30 min后,颈椎脱臼处死小鼠,腹腔注射2 mL生理盐水,轻揉腹部20次后剪开腹壁,移液枪吸取1 mL腹腔洗液,平均滴加至载玻片上2个琼脂圈内,放于内垫温湿纱布的搪瓷盘内,移至37 ℃ CO2培养箱温育30 min。之后用生理盐水漂洗,洗去未贴片的细胞。晾干后,以丙酮甲醇(1∶1)溶液进行固定,然后4%(v/v)Giemsa-PBS染色30 min,再用双蒸水进行漂洗晾干。油镜下观察鸡红细胞被巨噬细胞吞噬情况,每张片均计数100个巨噬细胞,计算吞噬率及吞噬指数[9]。
1.2.7 小鼠ConA诱导的脾淋巴细胞转化实验与NK细胞活性检测 取同一亚组小鼠共40只,称重后颈椎脱臼处死小鼠,分离胸腺及肝脏并称重,计算脏器指数;无菌条件下取脾,于400目筛网上轻轻研磨,适量Hank’s液过滤,用Hank’s液洗2次(每次1000 r/min离心10 min)。再用RPMI 1640完全培养液1 mL悬浮细胞,1%冰醋酸稀释并计数。RPMI1640完全培养液将细胞浓度调至2×107个/mL,采用LDH法进行NK细胞活性测定;细胞浓度调至3×106个/mL,采用MTT法检测脾淋巴细胞增殖能力[20]。
1.2.8 流式细胞术检测脾脏T淋巴细胞亚群比例 取同一亚组共40只小鼠脾脏,制备1×106个/mL的脾细胞悬液(方法同1.2.6)。各小鼠编2支对应试管,加细胞悬液100 μL/管,然后分别加入不同荧光素标记的CD3ε、CD4、CD25、CD8a抗小鼠单克隆抗体,并以各单克隆抗体的同型对照作阴性对照,消除因抗体非特异性结合至细胞表面所产生的背景。室温避光孵育15~20 min。每管加800 μL Cell staining buffer细胞染色缓冲液(cell staining buffer)洗涤2次,加入250 μL cell staining buffer重悬细胞,用BD FACSCalibur流式细胞仪检测CD3+T细胞及CD4+、CD8+、CD4+CD25+T细胞亚群百分比,以未加抗体的对照管进行空白定标,各管收集1×105个细胞,使用BD CellQuest软件包收集并分析数据[10]。
1.3 统计方法
2 结果与分析
2.1 JOPs对小鼠体重及免疫器官相对重量的影响
各组间初始体重、终末体重均无统计学差异(P>0.05);JOPs中、高剂量组小鼠脾脏指数显著大于空白对照组(P<0.05),并且中剂量组小鼠脾脏指数显著大于乳清蛋白组(P<0.05);各组小鼠胸腺指数无显著差异(P>0.05),见表1。

表1 JOPs对小鼠体重和免疫器官相对重量的影响Table 1 Effect of JOPs on body weight and relative weight of immune organs in mice
2.2 JOPs对小鼠细胞免疫功能的影响
与空白对照组及乳清蛋白组比较,JOPs中、高剂量组小鼠反映脾淋巴细胞增殖能力的血清光密度差值,及足跖增厚度均显著提高(P<0.05);而JOPs低剂量组与空白对照组及乳清蛋白组相比,小鼠血清光密度差值及足跖增厚度无显著差异(P>0.05),见表2。
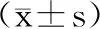
表2 JOPs对小鼠细胞免疫功能的影响Table 2 Effect of JOPs on cellular immune function in mice
2.3 JOPs对小鼠体液免疫功能的影响
JOPs中、高剂量组小鼠溶血空斑数显著高于空白对照组及乳清蛋白组(P<0.05)。JOPs高剂量组小鼠血清溶血素水平显著高于空白对照组(P<0.05),且JOPs低、高剂量组小鼠血清溶血素水平显著高于乳清蛋白组(P<0.05),见表3。

表3 JOPs对小鼠体液免疫功能的影响Table 3 Effect of JOPs on humoral immune function in mice
2.4 JOPs对小鼠单核-巨噬细胞吞噬功能的影响
相对于空白对照组,JOPs各剂量组小鼠碳廓清吞噬指数a、巨噬细胞吞噬指数和吞噬率(P<0.05)均显著提高;相对于乳清蛋白组,JOPs中、高剂量组小鼠碳廓清吞噬指数a、巨噬细胞吞噬率及吞噬指数显著提高(P<0.05),见表4。

表4 JOPs对小鼠单核-巨噬细胞吞噬功能的影响Table 4 Effect of JOPs on phagocytosis of monocyte-macrophages in mice
2.5 JOPs对小鼠NK细胞活性的影响
相比空白对照组与乳清蛋白组,JOPs 中、高剂量组小鼠NK细胞活性均显著升高(P<0.05);而JOPs低剂量组与空白对照组及乳清蛋白组相比,小鼠NK细胞活性差异不显著(P>0.05),见表5。

表5 JOPs对小鼠NK细胞活性的影响Table 5 Effect of JOPs on the activity of NK cells in mice
2.6 JOPs对小鼠脾脏T淋巴细胞亚群的影响
JOPs高剂量组小鼠脾脏CD3+T细胞、CD3+CD4+T细胞亚群比例与CD4+CD25+/CD4+T细胞比值显著高于空白对照组及乳清蛋白组(P<0.05);此外,JOPs低、高剂量组小鼠脾脏CD4+/CD8+比值显著高于乳清蛋白组(P<0.05);相比空白对照组,JOPs低剂量组小鼠脾脏CD4+/CD8+比值显著增高(P<0.05),JOPs高剂量组小鼠脾脏CD4+/CD8+比值有增高的趋势(P=0.062),见表6。

表6 JOPs对小鼠脾脏T淋巴细胞亚群的影响Table 6 Effect of JOPs on T lymphocyte subsets of spleen in mice
3 讨论
机体免疫系统的功能分为适应性免疫与固有免疫,其中适应性免疫包括细胞免疫及体液免疫,固有免疫包括单核-巨噬细胞、NK细胞的作用。T淋巴细胞在机体免疫系统中起着极为重要的作用,它与某些特异性抗原或细胞相互接触时,发挥免疫功能,在机体的固有免疫及适应性免疫中均具有重要作用[21]。ConA诱导的脾淋巴细胞转化实验采用ConA诱导T淋巴细胞,使其发生母细胞增殖反应,增殖细胞中线粒体水解酶将MTT分解成蓝紫色结晶,通过检测OD值变化,间接反映T淋巴细胞增殖能力;DTH实验通过二次绵羊红细胞干预24 h后小鼠足跖部增厚程度反映T淋巴细胞反应程度。实验结果显示JOPs干预对小鼠体重变化及胸腺指数无显著性影响(P>0.05);JOPs中、高剂量组小鼠脾脏指数显著高于空白对照组,且中剂量组脾脏指数显著高于乳清蛋白组(P<0.05),提示JOPs对增加小鼠脾脏指数具有一定作用。相比空白对照组及乳清蛋白组,JOPs中、高剂量干预组小鼠ConA诱导的脾淋巴细胞增殖能力与迟发型变态反应能力显著增高(P<0.05),表明JOPs可以促进小鼠细胞免疫功能,与Yang等[22]的研究结果相似。
抗体是B淋巴细胞经抗原刺激增殖分化成浆细胞后,合成的能够与对应抗原发生特异性结合的免疫球蛋白,主要分布于血清或体内外分泌物中,在体液免疫中发挥重要作用,是衡量机体体液免疫功能的重要指标[23-24]。抗体生成细胞检测采用SRBC免疫小鼠,在补体参与下,分泌抗体的脾细胞将周围SRBC溶解,出现肉眼可见空斑,空斑数即等同抗体生成细胞数;血清溶血素检测利用SRBC免疫后小鼠血清中出现的溶血素(SRBC抗体),在补体参与下使SRBC发生溶血反应释放血红蛋白,通过检测血红蛋白含量间接反映溶血素水平。与HE等[10]的研究结果类似,本实验中JOPs 中、高剂量组小鼠的抗体生成细胞数显著高于空白对照与乳清蛋白组;JOPs高剂量组小鼠血清溶血素水平显著高于空白对照组,且JOPs低、高剂量组血清溶血素水平明显高于乳清蛋白组(P<0.05)。由此可推断,JOPs能够明显增强小鼠体液免疫功能。
单核-巨噬细胞是固有免疫的重要组成部分,是炎性反应中主要的调节细胞,还对适应性免疫反应起关键性作用[25]。小鼠碳廓清实验利用体内碳颗粒清除速率和血碳浓度,在一定范围内呈指函数关系,校正肝脾重量的影响,通过吞噬指数a反映机体单核-巨噬细胞吞噬能力;腹腔巨噬细胞吞噬鸡红细胞实验利用机体内腹腔巨噬细胞能直接吞噬鸡红细胞的特性,根据显微镜下观察到的鸡红细胞吞噬情况计算吞噬率及吞噬指数,推断单核-巨噬细胞的吞噬功能。本研究发现,相对于空白对照组,JOPs各剂量干预组小鼠碳廓清能力、腹腔巨噬细胞吞噬率及吞噬指数显著增高,且JOPs中、高剂量组小鼠碳廓清吞噬指数a、巨噬细胞吞噬率与吞噬指数显著高于乳清蛋白组(P<0.05),表明JOPs可明显提高小鼠单核-巨噬细胞吞噬功能,与朱振平等[26]的研究结果类似。NK细胞是有别于T细胞与B细胞的一类淋巴细胞,它可直接杀伤靶细胞,在免疫监视、抗肿瘤和抗感染的早期过程中起着重要作用[27]。NK细胞活性检测利用YAC-1细胞被NK细胞杀伤后释放的LDH使乳酸锂脱氢,进而使NAD还原为NADH,后者经递氢体使碘硝基氯化四氮唑(INT)被还原为紫红色甲臜类化合物,通过比色测定OD值间接反映NK细胞活性。本研究表明,对比空白对照组及乳清蛋白组,JOPs 中、高剂量组均具有较高的NK细胞活性,说明JOPs可以增强小鼠NK细胞活性。
细胞免疫中最为重要的T淋巴细胞包含多种功能各异的T淋巴细胞亚群,共同发挥免疫调控作用,其中CD3+细胞代表成熟T淋巴细胞,是细胞免疫中主要的活性细胞,它按CD表型又分Th细胞(CD4+辅助/诱导性T细胞)与Tc细胞(CD8+抑制性/细胞毒T细胞)。CD4+T细胞能够协助B细胞分泌抗体及调节其它T细胞的免疫应答,CD8+T细胞常表现为细胞毒活性及免疫抑制性,是主要的细胞毒效应细胞;CD4+T细胞与CD8+T细胞数量和比值变化能够反映机体免疫功能状态,CD4+T细胞数量降低、CD8+T细胞数量增加、CD4+/CD8+比值降低表明机体处于免疫抑制状态,临床上预示着疾病恶化[28]。CD4+CD25+T细胞可高表达IL-2受体的α链(CD25分子)和转录因子Foxp3,抑制自身反应性T细胞所介导的病理性免疫应答[1]。本研究JOPs高剂量干预组小鼠脾脏CD3+T细胞、CD3+CD4+T细胞亚群比例,及CD4+CD25+/CD4+T细胞比值均高于空白对照组及乳清蛋白组,JOPs低、高剂量干预组小鼠脾脏CD4+/CD8+比值显著高于空白对照组及乳清蛋白组或有高于的趋势(P<0.05)。CD4+T细胞可活化为Th细胞,其中Th1细胞可分泌IFN-γ、TNF、IL-2、GM-CSF等,发挥细胞免疫效应,并激活巨噬细胞、NK细胞;Th2细胞分泌IL-4、IL-5、IL-10、IL-13等,介导体液免疫。因此,可推断JOPs增强小鼠细胞与体液免疫功能的可能机制,即JOPs提高CD3+T细胞、CD4+T细胞百分比及CD4+/CD8+比值,Th1、Th2细胞增加,进而增大相应细胞因子的释放量,增强细胞及体液免疫功能、单核-巨噬细胞吞噬功能与NK细胞活性。此外JOPs增强小鼠免疫功能的作用优于乳清蛋白,表明其功效并非单纯由小鼠蛋白质摄入增加所引起。本研究为JOPs作为一种有效增强机体免疫功能的新型功能性保健食品及药品的开发与应用提供了实验依据,但其具体作用机制仍需进一步的实验探究。
4 结论
本研究结果表明长期服用JOPs可显著增强机体细胞免疫、体液免疫、单核-巨噬细胞吞噬功能及NK细胞活性(P<0.05),机制可能与其提高CD3+T细胞、CD4+T细胞百分比及CD4+/CD8+比值有关。本研究为JOPs在增强机体免疫功能方面的应用提供了科学依据,但其具体作用机制仍需进一步的实验去探究和验证。
