脑靶向硫化银量子点的构建及体外跨血脑屏障作用
2020-04-30徐毅闫美玲马继飞赵芳菲孙艳红王丽华高基民
徐毅,闫美玲,马继飞,赵芳菲,孙艳红,王丽华,高基民
(1.温州医科大学 检验医学院 生命科学学院,浙江 温州 325035;2.中国科学院上海应用物理研究所微观界面物理与探测重点实验室 物理生物学研究室,上海 201800)
光学成像探针的发展为疾病的早期诊断和治疗提供了有效的手段,相比可见光成像探针,近红外(near infrared,NIR)荧光探针具有更高的组织穿透深度和更低的组织散射[1],在活体动物成像中具有独特的优势。NIR荧光发射的波长可分为NIR一区(NIR-I,750~900 nm)、NIR二区(NIR-II,900~1 400 nm),NIR二区波长更长,可显著降低光在穿透生物组织中的散射现象,加上其光子自身组织吸收少,引起自发荧光效应低等特点,在体内成像中可以穿透深部组织,具有更高的空间分辨率[2]。ANTARIS等[3]用NIR二区荧光探针CH1055和一区的ICG对比发现,NIR二区荧光探针在活体成像中,可达到微米级的空间分辨率,约4 mm的组织穿透深度,较NIR一区的0.2 mm的穿透深度、毫米级的空间分辨有非常显著的提升。YI等[4]用NIR二区的荧光探针CH1055-WL对小鼠体内的关节缺损部位成像,可动态监测由关节炎病变成关节缺损的过程。硫化银量子点(Ag2S QDs)是近年来新发现的NIR二区量子点,DU等[5]于2010年首次报道了Ag2S QDs的荧光性质,它不仅具有较高的量子效率和荧光强度,而且具有非常好的生物相容性[6-7]。LI等[8]用NIR二区量子点Ag2S实时监测裸鼠体内肿瘤部位血管生及淋巴引流的过程。基于Ag2S QDs作为成像探针的优势,我们前期已经用脑靶向肽ANG修饰Ag2S QDs得到NIR二区的荧光探针[9],该探针具有一定靶向实体瘤的能力,本研究我们进一步比较分析其体外跨血脑屏障情况,为后续的脑部原位瘤成像奠定基础。
1 材料和方法
1.1 材料
1.1.1 主要试剂:Angiopep-2多肽,其序列为TFFY GGSRGKRNNFKTEEY,相对分子质量为2 301.5,等电点10.0,购于上海强耀生物科技有限公司;Ag2S、Ag2S-PEG量子点购于苏州纳米所;普通碳支持膜购于北京中镜科仪技术有限公司;交联剂EDC/NHS、琼脂糖、多聚甲醛、十二烷基磺酸钠(SDS)购于上海国药集团化学试剂有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑嗅盐(MTT)购于西格玛奥德里齐(上海)贸易有限公司公司;Transwell培养板购于上海百赛生物科技有限公司;MEM、DMEM培养、Gibco胎牛血清购于美国Life Tech公司;青链霉素购于上海碧云天生物技术有限公司;细胞培养皿、培养板购于西格玛奥德里齐(上海)贸易有限公司。
1.1.2 细胞株:bEnd.3细胞系(小鼠脑微血管内皮细胞)购于美国ATCC公司。U87 MG细胞系(人源胶质瘤细胞)购于中国科学院典型培养物保藏委员会细胞库。
1.1.3 主要仪器:纳米粒径电位分析仪购于英国Malvern公司,电泳装置购于美国Bio-Rad公司,场发射透射电镜购于美国FET公司,超纯水仪购于美国Millipore公司,控温振荡器、低温高速离心机购于德国Eppendorf公司,二氧化碳细胞培养箱购于美国Nuair公司,超净工作台购于苏州净化设备有限公司,酶标仪购于美国Gene公司,二氧化碳细胞培养箱购于美国Nuair公司,X系列质谱仪购于美国赛默飞世尔科技有限公司。
1.2 方法
1.2.1 Ag2S、Ag2S-PEG QDs表面修饰ANG多肽:在交联剂EDC/NHS介导下,Ag2S、Ag2S-PEG量子点的-COOH和脑靶向肽Angiopep-2(ANG)的-NH2发生缩合反应进行连接,加入少量NH3·H2O,使溶液由浑浊变澄清,之所以用EDC和NHS交联剂,是因为它们的反应要优于醛类交联剂,EDC只是帮助分子的羧基和氨基之间形成酰胺键,而本身并没有成为实际交联的一部分,EDC首先是和羧基形成一个O-异酰基脲结构,这一活化中间物并不稳定,而NHS通过形成更稳定的酯而增强该活化中间物的稳定性可以消除并被清洗掉[10]。整个过程分为3步:首先,称量EDC 8.21 mg、NHS 15.60 mg、ANG 0.32 mg,根据相对分子质量将EDC和NHS配制成2 mmol/L溶液,将ANG配制成200 μmol/L的溶液;然后,取15 μL Ag2S-COOH(10 μmol/L)和Ag2S-PEG-COOH(10 μmol/L)量子点,加入等体积的ANG,再加入等体积的EDC/NHS,此时溶液变浑浊,再慢慢加入稀释过的氨水,待溶液变澄清后,再将混合液在控温振荡器(300 r/min)震荡30 min,再加入三倍体积的EDC/NHS在控温振荡器(300 r/min)震荡8 h;最后,将溶液转移至超滤管,在3 000×g条件下离心15 min,然后倒置超滤管在1 000×g条件下离心10 min,收集溶液。
1.2.2 琼脂糖凝胶电泳表征:取0.3 g的琼脂糖粉末溶于30 mL的0.5×TBE中,在微波炉中加热使琼脂糖全部溶解,配成1%的琼脂糖凝胶,然后倒入电泳槽中,胶凝固后进行电泳。将Ag2S、Ag2S-ANG和Ag2SPEG、Ag2S-PEG-ANG稀释到同一浓度(1 mg/mL),分别在不同的上样孔中上样10 μL,100 V电泳20 min,取出胶置于NIR二区成像仪中进行成像,同时拍摄白光照片。
1.2.3 Zeta电位及动态光散射(dynamic light scattering,DLS)表征:将Ag2S、Ag2S-ANG、Ag2SPEG、Ag2S-PEG-ANG稀释到同一浓度(20 μg/mL),然后将稀释后的溶液放入比色皿中,分别置于纳米粒度及电位分析仪中进行动态光散射和ξ电位分析,每个样品设3管重复样,进行检测。
1.2.4 透射电子显微镜(transmission electron microscope,TEM)表征:TEM表征要事先制样,将Ag2S、Ag2S-ANG、Ag2S-PEG、Ag2S-PEG-ANG稀释到相同的浓度,每个样品取10 μL,滴在2个铜网上,让其自然风干,然后置于TEM下进行粒径分析。
1.2.5 细胞毒性分析:采用MTT方法,具体实验步骤如下:①将对数生长期的U87 MG细胞用胰酶消化,制成单细胞悬液,以每孔100 μL(1×104个细胞)的体积将单个细胞悬液接种于96孔板中,置于37 ℃、5% CO2的恒温培养箱中培养24 h。②培养24 h后,弃去96孔板中旧的培养基,加入不同浓度的ANG多肽修饰的Ag2S、Ag2S-PEG量子点(终浓度分别为100、10、1、0.1 μg/mL),与细胞共培养24 h。③共培养至20 h,向96孔板中加入10 μL MTT溶液(5 mg/mL),其终浓度是0.5 mg/mL,继续培养至24 h。④共培养至24 h,每孔加入110 μL酸化的SDS(pH 3.0~4.0),孵育过夜,充分溶解。⑤过夜后,吸出96孔板中的溶液至1.5 mL离心管中,14 000 r/min离心15 min,离心后,取200 μL上清于新的96孔板中,酶标仪570 nm检测各孔吸收值,计算细胞存活率。
1.2.6 体外血脑屏障建立:采用小鼠的bEnd.3细胞建立体外血脑屏障模型,bEnd.3细胞是小鼠脑微血管内皮细胞。在该模型使用的细胞培养板是专用的transwell培养板(见图1),这种培养板主体是24孔板,在其中的12孔上悬挂有小室(transwell),小室底部是一层聚碳酸酯膜(孔径0.3 μm),小室内称为上室,培养板内称为下室,上室内用于培养bEnd.3细胞,下室用于培养U87 MG细胞,等上层的bEnd.3细胞的电阻达到300 Ω时即可作为体外血脑屏障使用。
方法如下:①将处于对数生长期的bEnd.3细胞用胰酶消化,制成单细胞悬液,然后将bEnd.3细胞铺到上室,每孔1×105个细胞,体积为200 μL,将培养板置于37 ℃、5% CO2的恒温培养箱中培养。②培养过程中要不断地测量上室细胞的电阻,并且经常换液,以免细胞因为营养不够而死亡,当电阻到达300 Ω时,说明bEnd.3细胞已经形成致密连接,可以开始试验。③在上室细胞电阻快要符合要求时,提前在下室铺满U87 MG细胞,每孔细胞数1×104个,体系为500 μL,铺5组共15个孔,Ag2S、Ag2S-ANG、Ag2S-PEG、Ag2S-PEG-ANG四种量子点各3个孔,空白对照3个孔。④电阻达到300 Ω时,将上室转移到铺有U87 MG细胞的24孔板中,并换液,加入终浓度为20 μg/mL的Ag2S、Ag2S-ANG、Ag2S-PEG、Ag2S-PEG-ANG四种量子点,体系为200 μL不变,孵育过夜。⑤孵育完毕,用胰酶消化上室和下室的bEnd.3细胞和U87 MG细胞,然后收集上室和下室的细胞,并且收集下室的培养基,然后通过ICP-MS分别测量上室bEnd.3细胞Ag含量、下室U87 MG细胞Ag的含量以及下室培养基中Ag的含量。

图1 Transwell培养板示意图
1.3 统计学处理方法 采用SPSS19.0软件进行统计学分析。计量资料以表示,多组间比较采用单因素方差分析,2组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Ag2S、Ag2S-PEG QDs修饰前后表征结果
2.1.1 琼脂糖电泳表征结果:Ag2S、Ag2S-PEG QDs经过ANG多肽修饰后,溶液的颜色和荧光性质没有明显的变化,从琼脂糖凝胶电泳可以看出,修饰ANG多肽的Ag2S、Ag2S-PEG量子点的条带位置要比未修饰ANG多肽的Ag2S、Ag2S-PEG量子点迁移距离短(见图2),琼脂糖电泳是根据相对分子质量进行分离的,也就是说Ag2S-ANG、Ag2S-PEG-ANG量子点的相对分子质量增加。

图2 Ag2S、Ag2S-PEG经ANG多肽修饰前后的量子点白光图、荧光图及琼脂糖凝胶电泳图
2.1.2 Zeta电位和DLS表征结果:Zeta电位检测结果表明,Ag2S、Ag2S-PEG量子点表面呈负电性,而修饰了ANG多肽的Ag2S、Ag2S-PEG量子点带正电(见表1),这是因为ANG多肽的等电点是10,所以在该溶液中带正电,导致修饰了ANG多肽的Ag2S、Ag2SPEG量子点带正电。DLS的结果表明修饰了ANG多肽的Ag2S量子点的水合粒径增大,差异有统计学意义(P<0.05),见图3。
表1 Ag2S、Ag2S-PEG量子点经ANG修饰前后Zeta电位变化(每组n=3

表1 Ag2S、Ag2S-PEG量子点经ANG修饰前后Zeta电位变化(每组n=3
量子点 Zeta电位(mV)Ag2S -11.5±1.6 Ag2S-ANG +28.7±1.4 Ag2S-PEG -5.3±1.6 Ag2S-PEG-ANG +2.8±1.0

图3 Ag2S、Ag2S-PEG量子点经ANG修饰前后水合粒径变化
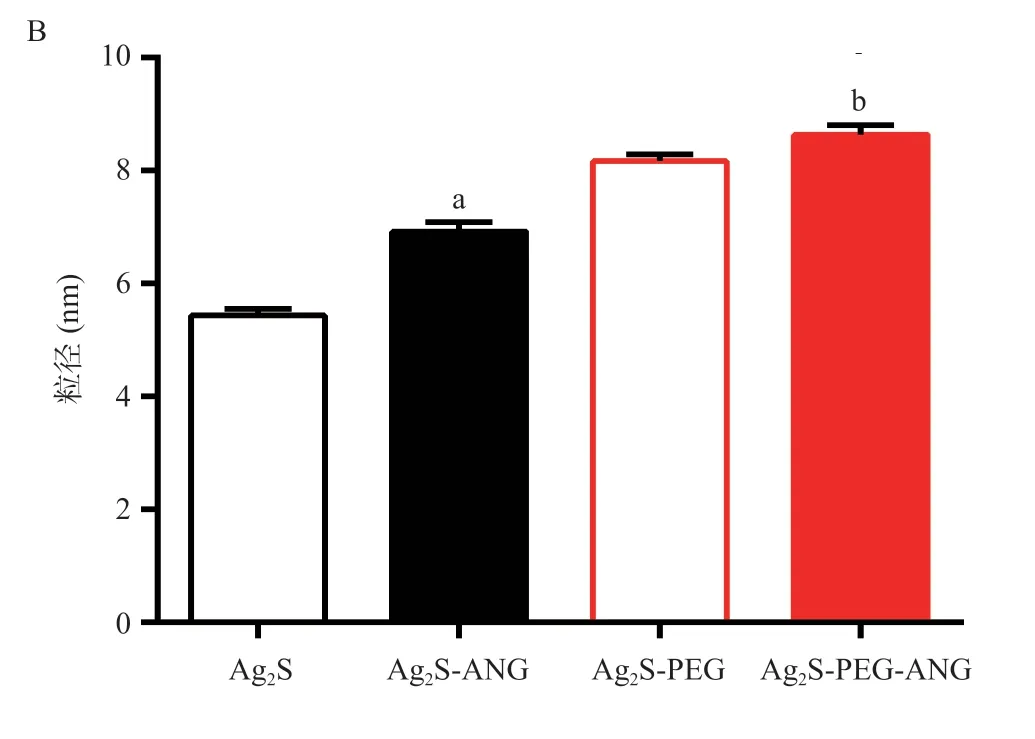
图4 Ag2S、Ag2S-PEG量子点经ANG修饰前后的TEM表征
2.1.3 TEM表征结果:利用TEM对Ag2S和Ag2S-PEG量子点修饰前后的粒径进行表征(见图4A),随机选取50个量子点,用Gatan Digital Micrograph软件分别统计Ag2S和Ag2S-PEG量子点修饰前后的大小。TEM结果表明,Ag2S量子点的粒径约5 nm,Ag2S-ANG量子点的粒径约为7 nm,Ag2S-PEG的粒径约8 nm,Ag2S-PEG-ANG的粒径约8.5 nm,经过修饰后粒径增大,差异有统计学意义(P<0.05),见图4B。结合电泳和DLS及Zeta电位结果,表明ANG短肽成功修饰在Ag2S量子点上。
2.2 细胞毒性 MTT法检测结果显示,Ag2S和Ag2SANG量子点与U87 MG细胞共孵育24 h后,在100 μg/mL时,细胞存活率接近100%,修饰前后对bEnd.3细胞未显示明显的毒性,各组间差异无统计学意义(P>0.05),对U87 MG细胞也未显示明显的毒性,各组间差异无统计学意义(P>0.05),见图5。

图5 Ag2S、Ag2S-PEG量子点经ANG修饰前后对U87 MG细胞和bEnd.3细胞的细胞毒性
2.3 Ag2S、Ag2S-PEG QDs修饰前后穿过体外血脑屏障情况 在所建立的体外模型中,多肽修饰的Ag2SANG、Ag2S-PEG-ANG和带PEG的Ag2S-PEG三种量子点均能穿过bEnd.3细胞层,到达下室的培养基中,而Ag2S量子点基本不能穿过bEnd.3细胞层,在下层培养基中只检测到极少量的Ag2S量子点,差异有统计学意义(P<0.05),见图6A。Ag2S-ANG量子点被下层U87 MG细胞摄取的含量约是Ag2S的6倍,差异有统计学意义(P<0.01),U87 MG细胞对Ag2S-PEG-ANG量子点的摄取量比Ag2S-PEG也有升高,差异有统计学意义(P<0.05),但摄取量远不及Ag2S-ANG多,见图6B。结果表明,Ag2S-ANG、Ag2S-PEG和Ag2S-PEG-ANG量子点都可以穿过体外血脑屏障系统,但是穿过后Ag2S-ANG对U87 MG细胞的靶向能力较其他两种量子点更强。
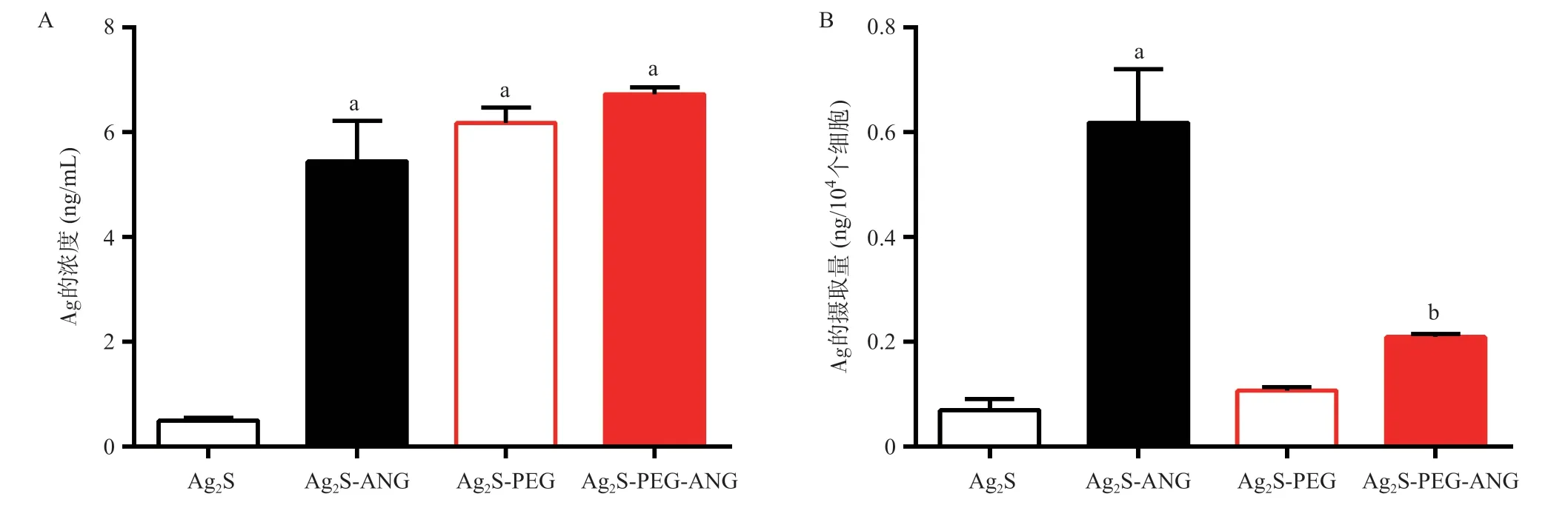
图6 4种量子点在体外血脑屏障穿透情况及摄取情况
3 讨论
近年来,虽然疾病的诊断和治疗技术发展迅速,但是传统的脑部疾病的诊断和治疗还存在一些局限。在诊断方面,成像技术的缺陷(如分辨率低、穿透深度低、循环时间短等)使得诊断不准确或难以诊断[11-12]。在治疗方面,由于血脑屏障复杂的结构[13-14]以及丰富的酶系统,治疗药物很难到达脑部发挥治疗作用[15-18]。
纳米颗粒具有量子尺寸效应,较大的比表面积和较高的吸附活性,这使得它可以在生物体内自由移动,特定的光吸收,低浓度没有毒性,若修饰一些脑靶向性的分子使其具有一定的脑部靶向性,可广泛应用于脑成像探针[19-24]。纳米材料可以在脑靶向分子[25-27]的协助下穿过血脑屏障,到达脑部,这为脑部病变的诊断和药物的脑靶向输送带来了新的契机。如LIU等[27]利用超声波和磁场的协同作用,将有治疗效果的磁性纳米颗粒(magnetic nanoparticles,MNPs)带入脑部,成功跨越血脑屏障,并且利用MRI对MNPs进行监控。QIAN等[28]将纳米金包裹上PEG,并进行表面拉曼光谱增强,形成金纳米颗粒复合物,这种复合物在NIR区域的光学信号比有机染料强,当连接上靶向肿瘤的配体时,这复合物能够靶向肿瘤并进行成像。GAO等[29]用半导体量子点成功实现体内靶向肿瘤的成像,他们在量子点上修饰具有靶向肿瘤的生物分子,使得探针具有高的渗透性和长的肿瘤位点代谢,并且得到了清晰的体内肿瘤细胞的图像。在之前的研究中,我们设计合成了基于Ag2S量子点的NIR二区荧光成像探针Ag2S-ANG,对脑胶质瘤荷瘤鼠的实体瘤具有一定的靶向性[9],在此基础上,我们构建了2种脑靶向的Ag2S-ANG和Ag2S-PEG-ANG荧光成像探针,利用体外血脑屏障模型进一步比较研究了修饰前后穿透体外血脑屏障情况,发现Ag2S-ANG、Ag2S-PEG和Ag2S-PEGANG均可穿过体外血脑屏障,并且Ag2S-ANG能被脑胶质瘤细胞大量摄取,这为进一步的脑原位肿瘤的NIR二区成像奠定了基础。
