貉源大肠杆菌四环素耐药基因的检测
2020-04-30刘竟雅侯晓昱吴金燕
刘竟雅 侯晓昱 吴金燕 姜 楠 冯 涛 薛 原
(东北林业大学野生动物与自然保护地学院,哈尔滨,150040)
貉(Nyctereutesprocyonoides)是一种经济动物,目前它的经济价值主要体现在毛皮的用途上,除了能够制成轻便、耐寒、美观的衣物以外。还能制成书写刷和化妆刷一类的产品。此外,根据近期研究发现貉的胆汁有望代替熊胆入药[1]。
在貉的各种疾病中,细菌病占了很大比例,大肠杆菌(Escherichiacoli)病常对肠道和神经系统造成严重损害,四环素被广泛用作治疗和预防貉细菌病的广谱抗生素,它作为一种选择机制[2],让具有四环素抗性基因的大肠杆菌存活下来。这逐渐增加了大肠杆菌抗性基因频率,并改变了种群动态。同时拥有抗性基因的大肠杆菌不断排入到生态系统,抗性基因在种群中不断转移,使得该病治疗的难度很大。不同的四环素类药物的使用,令不同地区、不同农场的大肠杆菌耐药性存在一些差异[3]
四环素药物作为一种广谱抗菌药,效果好,毒性低,廉价易得,因此被广泛用于人畜疾病预防和治疗中。然而,其长期的过度使用也导致其抗性菌株的出现和增长。到目前为止,世界上许多发达国家,仍然把含有大量广谱和高效的四环素抗生素的生长促进剂用于畜牧业,同时四环素类药物在治疗人和动物的细菌感染等方面已经使用了很长时间,导致近几年来耐药菌株不断出现在我们的生态环境中[4]。
在这项研究中,我们从不同地区不同饲养场健康貉体内分离大肠杆菌,并测试其四环素耐药基因,为将来四环素的临床使用提供理论依据,据报道,tetA、tetB、tetC和tetM是大肠杆菌对四环素的主要耐药基因[5]。在这个结论的指导下,我们对它进行了验证和探索,得出两者之间的关系,对于今后科学、有效使用四环素具有很大的意义,还可以减少貉养殖场的经济损失,并指导合理使用药物。
1 材料
1.1 菌株
试验用大肠杆菌56株,分离自黑龙江省和吉林省貉养殖场。
1.2 主要试剂
10×Buffer、Dntp、Taq酶、DL-2000 Marker、6×Loading Buffer,均由TaKaRa公司提供。
2 实验方法
2.1 PCR扩增模板的制备
将56株貉源大肠杆菌接种于LB琼脂培养基过夜。挑取单个菌落置于LB肉汤中,37 ℃摇床培育3 h获得一定浓度的菌液。
2.2 四环素基因的检测
根据文献[6-7],由吉林省库美生物科技有限公司合成TetA、TetB、TetC、TetD、TetE、TetM这6种四环素基因的引物,其序列见表1。PCR产物在1%琼脂凝胶中电泳。电泳结束后用凝胶成像仪成像分析。
表1 引物序列信息

Tab.1 Primer sequences information
3 结果
电泳出样获得了与预期长度一致的目标条带,结果显示本批貉大肠杆菌样品中,四环素耐药基因tetA、tetB、tetC、tetM均有检出,其中以tetM检出率最高为82.14%,tetA、tetB、tetC的检出率依次为16.07%、28.57%、5.35%,tetE检出率为零。

图1 tetA的PCR扩增结果Fig.1 PCR amplified results of tetA gene 注:M:DNA marker;2—6:tetA耐药基因的PCR扩增结果 Note:M:DNA marker.2-6:PCR products of tetA gene

图2 tetB的PCR扩增结果Fig.2 PCR amplified results of tetB genes 注:M:DNA marker;1—6:tetB耐药基因的PCR扩增结果 Note:M:DNA marker.1-6:PCR products of tetB gene
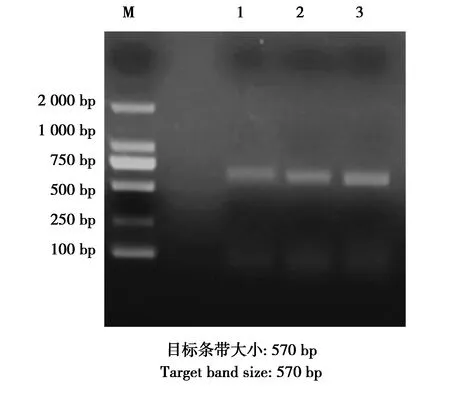
图3 tetC的PCR扩增结果Fig.3 PCR amplified results of tetC genes 注:M:DNA marker;1—3:tetC耐药基因的PCR扩增结果 Note:M:DNA marker.1-3:PCR products of tetC gene

图4 tetM的PCR扩增结果Fig.4 PCR amplified results of tetM genes 注:M:DNA marker;1—6:tetM耐药基因的PCR扩增结果 Note:M:DNA marker.1-6:PCR products of tetM gene
4 讨论
细菌耐药性的出现与其耐药基因的存在及数量密切相关。根据先前黑龙江省和吉林省貉源大肠杆菌耐药性的检测,可以得知貉源大肠杆菌对四环素表现出较高的耐药性,其耐药率超过60%[8]。因此,基于该结论,本实验进一步在分子水平检测了大肠杆菌四环素抗性基因。本实验结果表明,四环素耐药性的确与四环素耐药基因的存在密切相关,尤其是tetM。
一般认为,细菌对四环素产生耐药性的机制包括4种:外排泵机制,核糖体保护机制,钝化酶机制,核糖体靶位修饰机制[9]。Tet基因广泛存在于人源、动物源、共生菌和和环境条件致病菌的不同菌种[9]。大肠杆菌的耐药性主要基于主动外排机制,也伴有其他耐药机制,例如tetM基因则是本实验中核糖体保护机制(四环素类药物作用的主要作用机制是抑制细菌蛋白质合成,而许多对四环素耐药的微生物能够合成一种核蛋白体保护蛋白[9]。从而保证细菌中蛋白质的正常合成,临床表现为耐药性。而tetM基因正是这种蛋白的一种编码基因)。被研究较多的主动外排基因主要是tetA、tetB、tetC等[10]。其中,tetA、tetB、tetC3种基因在本实验中均有较高的检出率。但本实验貉源大肠杆菌中以携带tetM基因为主,检出率高达82.14%。在表明不同来源大肠杆菌中各种抗性基因携带状态有较大的差异。此外,貉的四环素耐药性可能由tetM基因支配。
研究表明,禽大肠杆菌中,tetA、tetB、tetC、tetM基因也广泛存在[10],与本实验大肠杆菌中抗性基因的携带状态一致。此外,在相关的鱼类和家禽育种的调查中发现,环境标本中tetM基因检出率极高,几乎接近100%。
tetM基因在对四环素耐药的革兰氏阳性菌中比较常见。而革兰氏阴性菌中tetA和tetB较多[11-12](一般认为主动外排机制和核糖体保护机制为四环素产生抗性的主要机制,其中革兰氏阴性菌主要是主动外排作用,革兰氏阳性菌以核糖体保护机制为主[13])。2004年Bryan等[14]从鸡和猪体内分离的大肠杆菌中克隆得到了tetM基因。而食物源标本的tetM检出率中,鱼类高于猪肉类,猪肉类高于禽类[14]。这也表明了tetM基因宿主具有多种类型和广泛的范围。过往研究认为,核糖体保护类抗性基因具有较强的迁移转化能力,能和可移动元件结合,从而在不同的微生物之间传播[15]。由于其广泛的的宿主菌群范围和强大的迁移转化能力,tetM基因可以通过宿主细菌为食物链和畜群中轻松运输。含有tetM的基因可以残存在饲料和食物中,从而进入动物体和人体,因此含有tetM抗性基因的菌群广泛存在于动物体和人体中。可以推测,吉林省和黑龙江省健康貉中大肠杆菌中检出tetM最高的原因可能是其饲料中存在着含有tetM的微生物。此外,tetM基因能够通转导接合作用在某些病原菌的群体中转移。该机制的研究对于防止病原菌抗药性的出现以及扩散具有重要的意义。
同时本试验检测出的tetA和tetB基因主要通过主动外排机制介导四环素的抗性[10]。根据先前实验,在不同地域、物种等检测出的主动外排基因中,主要以tetA和tetB基因检出最多,尤其是tetB,并且多重耐药菌株中tetB基因的检出率更高。这表明tetB基因在介导多重耐药有重要的作用[10],也符合本实验中健康貉大肠杆菌四环素多重耐药的事实。近年来,国内外大量的报道显示,tetA、tetB等的遗传环境中含有许多可自由移动的转座子[11]。抗性基因可以通过转座子与其他的一些基因连接。而这些基因可以通过质粒接合而传递,在该过程中传递抗药性。可移动元件质粒、整合子[9]、转座子等有效的介导了耐药基因的存在和转移。因此这些流动成分的研究对于四环素乃至很多其他抗生素有着深远意义,此外,对中国大量细菌耐药基因的研究也仅止步于基因表型的测定,对于转座子等移动成分的研究和报道很少。在这方面仍有很多未知的知识需要探索。一旦实现了新的突破,预防耐药性的出现和预防转移就可以发挥重要的作用,降低临床用药治疗和预防的难度。
貉作为经济动物,其毛皮和胆汁均有着十分广泛的用途。为了更好地发展养殖业,及时准确地进行流行病学调查非常重要。目前为止,最有效的方法仍然是减少抗生素的使用以避免耐药的出现。另外饲养环境的卫生检查也应该符合相应标准,避免由于饲料及畜舍的卫生问题而导致耐药菌群的扩散。
