扁蒴藤素对肺纤维化模型小鼠肺组织形态及转化生长因子-β1、α-平滑肌肌动蛋白表达的影响
2020-04-29蒋金桃崔国良冯小可甘可谈文峰张前德
蒋金桃 崔国良 冯小可 甘可 谈文峰 张前德


摘要:目的 观察扁蒴藤素对肺纤维化模型小鼠肺组织形态及转化生长因子(TGF)-β1、α-平滑肌肌动蛋白(α-SMA)表达的影响,探讨其作用机制。方法 采用氣管内注射博来霉素溶液制备小鼠肺纤维化模型。将32只雄性C57BL/6J小鼠随机分为正常组、模型组、扁蒴藤素组及吡非尼酮组,每组8只。正常组和模型组给予等量生理盐水腹腔注射,扁蒴藤素组给予1 mg/kg扁蒴藤素溶液腹腔注射,吡非尼酮组给予50 mg/kg吡非尼酮溶液腹腔注射。给药体积10 mL/kg,每日1次,连续28 d。取肺组织行HE及Masson染色,评估小鼠肺组织病理学变化及胶原沉积;免疫组化和Western bot检测小鼠肺组织TGF-β1及α-SMA蛋白的表达。结果 HE及Masson染色显示,扁蒴藤素组小鼠肺泡炎及肺纤维化评分低于模型组(P<0.05,P<0.01);免疫组化及Western blot结果显示,与正常组比较,模型组小鼠TGF-β1及α-SMA蛋白表达明显升高;与模型组比较,扁蒴藤素组和吡非尼酮组小鼠肺组织TGF-β1及α-SMA蛋白表达显著下降(P<0.05,P<0.01)。结论 扁蒴藤素可改善模型小鼠肺纤维化,其机制可能与抑制TGF-β1及α-SMA蛋白表达有关。
关键词:扁蒴藤素;肺纤维化;转化生长因子-β1;α-平滑肌肌动蛋白;小鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2020)04-0041-05
DOI:10.3969/j.issn.1005-5304.201910238
Effects of Pristimerin on Morphology of Lung Tissue and Expressions of TGF-β1
and α-SMA of Pulmonary Fibrosis Model Mice
JIANG Jintao1,2, CUI Guoliang1,2, FENG Xiaoke1,2, GAN Ke3, TAN Wenfeng1,2, ZHANG Qiande1,2
1. Institute of Integrated Medicine, Nanjing Medical University, Nanjing 210029, China;
2. The First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China;
3. Nanjing University of Chinese Medicine, Nanjing 210023, China
Abstract: Objective To explore the effects of pristimerin on Morphology of lung tissue and the expressions of TGF-β1 and α-SMA of pulmonary fibrosis model mice; To explore the action mechanism. Methods A mouse lung fibrosis model was prepared by intratracheal injection of bleomycin solution. 32 male C57BL/6J mice were randomly divided into control group, model group, pristimerin group and pirfenidone group, with 8 mice in each group. The control and model groups were given the same amount of saline by intraperitoneal injection; the pristimerin group was given 1 mg/kg pristimerin by intraperitoneal injection, and the pirfenidone group was given 50 mg/kg pirfenidone by intraperitoneal injection. The administration volume was 10 mL/kg once a day for 28 consecutive days. Lung tissues were obtained by HE and Masson staining to evaluate the pathological changes and collagen deposition in the lung tissues of mice. Immunohistochemistry and Western blot were used to determine the expressions of TGF-β1 and α-SMA proteins in the lung tissues of mice. Results HE staining and Masson staining showed that alveolar inflammation and pulmonary fiber score in mice of pristimerin group were significantly lower than the model group (P<0.05, P<0.01). The results of immunohistochemistry and Western blot showed that compared with the control group, the protein expressions of TGF-β1 and α-SMA in the model group significantly increased; Compared with the model group, the protein expressions of TGF-β1 and α-SMA in the lung tissues of mice in the pristimerin group and pirfenidone group were significantly reduced (P<0.05, P<0.01). Conclusion Pristimerin can relieve bleomycin- induced pulmonary fibrosis in mice, and the mechanism may be related to the down-regulation of protein expressions of TGF-β1 and α-SMA.
Keywords: pristimerin; pulmonary fibrosis; TGF-β1; α-SMA; mice
肺间质纤维化是硬皮病等多种结缔组织病的常见并发症[1],患者通常伴有进行性呼吸困难和肺功能恶化,目前临床上对肺纤维化治疗手段匮乏,预后较差,死亡率高。转化生长因子(TGF)-β1是目前研究最为广泛的促纤维化因子之一,被认为在肺纤维化进程中起到至关重要的作用[2]。TGF-β1会导致肌成纤维细胞的异常活化、过度表达α-平滑肌肌动蛋白(α-SMA)并导致细胞外基质(ECM)过量产生,最终导致肺组织结构重塑、肺功能受损[3]。靶向抑制TGF-β1信号传导途径是改善肺纤维化的有效治疗策略[4]。尽管美国食品药品管理局批准的吡非尼酮和尼达尼布可减缓肺纤维化病程进展[5],但其治疗成本较高、不良反应大[6],不能从根本上解决问题。因此,寻找新的治疗药物并证明其功效是肺纤维化患者的首要需求。
扁蒴藤素(Pristimerin)是卫矛科南蛇藤的主要活性成分,属醌甲基三萜类化合物,具有广谱抗肿瘤、抗炎、抗氧化等药理活性[7]。最新研究显示,扁蒴藤素可通过抑制相关纤维化基因阻断多柔比星诱导的心肌纤维化[8]。为验证扁蒴藤素在肺纤维化中的作用,本实验观察扁蒴藤素对博来霉素诱导的肺纤维化模型小鼠肺组织形态及TGF-β1、α-SMA表达的影响,并初步探讨其可能的作用机制。
1 实验材料
1.1 动物
SPF级雄性C57BL/6J小鼠32只,20~25 g,8~10周龄,购于南京市江宁区青龙山动物繁殖中心,动物许可证号SCXK(苏)2017-0001。饲养于南京医科大学峨眉岭实验动物中心SPF级动物房,温度20~24 ℃,相对湿度(50±5)%,常规自由饮食。动物实验均在南京医科大学峨眉岭实验动物中心完成。所有实验研究均遵循实验动物护理指南原则,并通过南京医科大学动物实验伦理审查委员会审查批准(IACUC-1708005-1)。
1.2 药物
扁蒴藤素,美国Sigma公司,批号066M4623V;注射用盐酸博来霉素,日本化药株式会社,批号2019460;吡非尼酮,大连美仑生物技术有限公司,批号J1001A。
1.3 主要試剂及仪器
生理盐水(美国HyClone公司,批号AD23987292),水合氯醛(国药集团化学有限公司,批号20150630),TGF-β1一抗(Affinity Biosciences,批号20r6523),α-SMA一抗(武汉三鹰,批号00075696),HRP标记的羊抗兔二抗(Jackson,批号128689),改良Masson三色染色液试剂盒(北京索莱宝科技有限公司,批号20190117),多聚甲醛(Servicebio公司,批号XS190206),BCA蛋白测定试剂盒(Thermo公司,批号SF249044)。高速冷冻离心机(德国Eppendorf公司),-80 ℃超低温冰箱(日本SANYO公司),AE240型电子分析天平(苏州市三丰剂量科技有限公司),脱水机(武汉俊杰电子有限公司),包埋机(武汉俊杰电子有限公司),病理切片机(上海徕卡仪器有限公司),载玻片及盖玻片(江苏世泰实验器材有限公司),正置光学显微镜(日本尼康公司),成像系统(日本尼康公司),电泳仪(美国Bio-RAD公司),7号腰穿针(扬州市江洲医疗器械有限公司),1 mL无菌注射器(美国BD公司)。
2 实验方法
2.1 分组
小鼠适应性喂养1周后,随机分为正常组、模型组、扁蒴藤素组和吡非尼酮组,每组8只。
2.2 造模及给药
参照文献[9]方法造模。小鼠给予4%水合氯醛(100 U/10 g)腹腔注射麻醉,仰卧固定于操作台,颈部脱毛膏脱毛后酒精消毒,沿颈正中纵行切开皮肤,钝性分离暴露气管,用磨钝后7号腰穿针紧贴舌根中央部缓慢插入气管中,进针深度约2.5 cm,缓慢注入博来霉素溶液(5 U/kg,约0.05 mL)。正常组在相同条件下注入等体积无菌生理盐水,随后迅速将小鼠直立前后左右轻轻摆动,使药液均匀分布肺组织,缝合颈部伤口,酒精消毒手术切口及周围皮肤。造模后次日,扁蒴藤素组腹腔注射1 mg/kg扁蒴藤素溶液进行干预处理,吡非尼酮组腹腔注射50 mg/kg吡非尼酮溶液,模型组腹腔注射注射等体积生理盐水。给药体积10 mL/kg,每日1次,连续28 d。第29日小鼠麻醉处死,所有小鼠均取右肺下叶,置于4%多聚甲醛中固定。其余肺组织置2 mL冻存管中,于液氮快速冷冻后移至-80 ℃超低温冰箱保存备用。
2.3 肺组织病理学评估
小鼠肺组织置于4%多聚甲醛固定24 h后常规脱水、石蜡包埋、切片后行HE染色;严格按照改良Masson三色染色液试剂盒说明书进行Masson染色。根据文献[10]方法,肺组织病理切片HE染色,镜下观察并进行肺泡炎症评分,0分:无肺泡炎;1分:轻度肺泡炎,受累面积小于全肺面积20%;2分:中度肺泡炎,受累面积占全肺面积20%~50%;3分:重度肺泡炎,受累面积超过全肺50%。参照文献[11]方法,肺组织病理切片Masson染色,镜下观察并进行纤维化评分。0分:肺组织结构特征正常;1分:肺泡部分扩大,肺泡间隔轻度增厚(≤正常3倍),受累面积小于全肺面积20%;2分:肺泡间隔中度增厚(>正常3倍),但无肺结构损毁;3分:肺泡间隔中度增厚(>正常3倍),纤维组织增多;4分:纤维组织团块形成面积小于镜下视野10%,伴有轻度肺结构损害;5分:纤维组织团块形成面积占镜下视野的10%~50%,伴有肺结构损害;6分:纤维组织团块形成面积大于镜下视野的50%,伴有明显肺结构损害;7分:严重肺结构损毁,大片纤维化区域,蜂窝肺;8分:满视野纤维组织。
2.4 免疫组化检测肺组织转化生长因子-β1和α-平滑肌肌动蛋白表达
取肺组织切片,二甲苯和梯度乙醇常规脱蜡,PBS冲洗,滴加H2O2阻断内源性过氧化氢酶,柠檬酸盐缓冲液进行抗原修复,滴加山羊血清覆盖组织,分别滴加一抗TGF-β1(1∶200)及α-SMA(1∶500),放入湿盒,4 ℃过夜。PBS冲洗后分别滴加反应增强液、二抗,DAB染色,苏木精复染,饱和碳酸锂返蓝,中性树脂封片。于正置显微镜200倍镜下观察TGF-β1及α-SMA表达,拍照并记录。使用全自动ImagePro- Plus 6.0计算软件对免疫组化染色结果进行分析。
2.5 Western blot检测转化生长因子-β1和α-平滑肌肌动蛋白表达
称取肺组织20 mg,加入300 μg蛋白裂解液,匀浆后抽提总蛋白,BCA法测定蛋白浓度,按30 μg/孔上样,进行SDS-PAGE电泳,电泳结束后将凝胶移至PVDF膜上。5%脱脂奶粉40 mL室温封闭2 h,TBST洗膜3次×10 min。按抗体说明书分别配制TGF-β1一抗(1∶1000)及α-SMA一抗(1∶1000),4 ℃孵育过夜。TBST洗膜3次×10 min。加入HRP标记二抗,室温慢摇孵育2 h。TBST洗膜3次×10 min。化学发光试剂曝光蛋白印迹条带,Image Lab软件分析实验结果,以GAPDH为内参,计算蛋白相对表达量。
3 统计学方法
采用GraphPad Prism 5.0统计软件进行分析。实验数据以—x±s表示,多组比较用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 HE染色结果
正常组小鼠肺组织结构清晰,肺泡形态正常,肺泡壁纤细,肺间质无炎症细胞浸润;模型组小鼠肺泡结构破坏严重,肺泡大量塌陷融合坏死,实变区肺泡壁增厚,有大量炎性细胞浸润;扁蒴藤素组和吡非尼酮组小鼠肺泡结构基本完整,较少见肺泡塌陷或实变,肺泡腔可见少量炎性细胞浸润。见图1。肺泡炎评分结果显示,与正常组比较,模型组小鼠肺泡炎评分明显增加,差异有统计学意义(P<0.01);与模型组比较,扁蒴藤素组和吡非尼酮组小鼠肺泡炎评分均明显下降,差异有统计学意义(P<0.01)。见图2。
4.2 Masson染色結果
正常组小鼠肺组织肺泡结构规则、整齐,有极少淡蓝色细丝状纤维沉积;模型组小鼠肺组织可见大量蓝色胶原沉积于肺泡间隔及肺间质;扁蒴藤素组和吡非尼酮组较模型组小鼠肺组织蓝色胶原沉积均明显减轻。见图3。肺纤维化评分结果显示:与正常组比较,模型组小鼠肺组织纤维化评分明显增加,差异有统计学意义(P<0.01);与模型组比较,扁蒴藤素组和吡非尼酮组小鼠肺组织纤维化评分均明显下降,差异有统计学意义(P<0.01)。见图4。
4.3 免疫组化检测结果
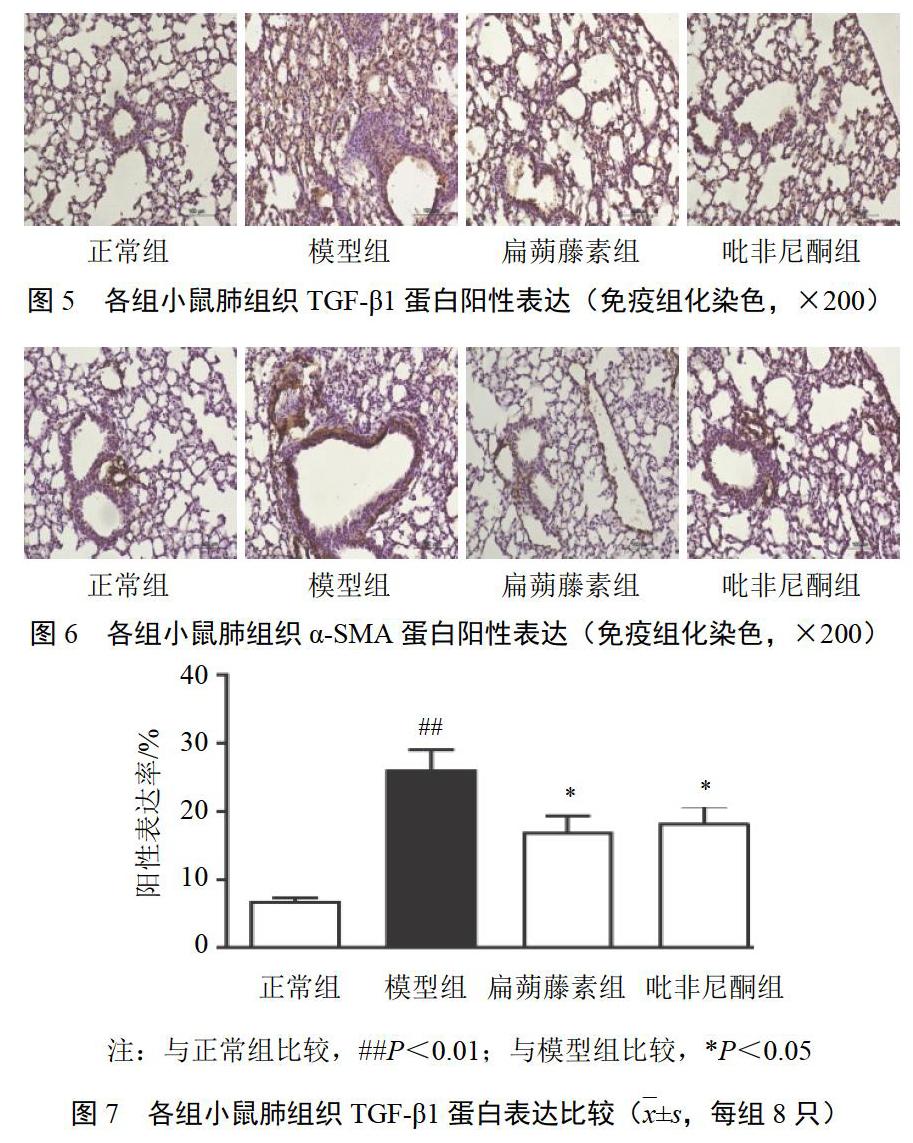
正常组小鼠仅支气管黏膜上皮细胞和成纤维细胞有少量TGF-β1呈弱阳性表达,模型组小鼠肺泡上皮细胞、成纤维细胞、支气管黏膜上皮细胞广泛表达TGF-β1;与模型组比较,扁蒴藤素组和吡非尼酮组小鼠肺组织TGF-β1表达明显降低(P<0.05)。α-SMA蛋白主要表达于气管周围,以棕黄色染色为阳性表达。与正常组比较,模型组小鼠肺组织α-SMA蛋白表达明显升高(P<0.01);与模型组比较,扁蒴藤素组和吡非尼酮组小鼠肺组织α-SMA蛋白表达明显降低(P<0.05)。见图5~图8。
4.4 Western blot检测结果
与正常组比较,模型组小鼠肺组织TGF-β1和α-SMA蛋白表达显著升高(P<0.01);与模型组比较,扁蒴藤素组和吡非尼酮组小鼠肺组织TGF-β1和α-SMA蛋白表达明显降低(P<0.05,P<0.01)。见图9、图10。
5 讨论
肺间质纤维化是结缔组织病的常见并发症,其主要临床表现为剌激性干咳和呼吸困难,发病机制目前尚不明确,最关键的病理特征被认为在于成纤维细胞的异常增殖、成纤维细胞转分化为肌成纤维细胞失调以及ECM大量沉积,最终导致肺功能衰竭[12-13]。近年来对肺纤维化机制的深入研究表明,TGF-β1在肺纤维化动物模型及肺纤维化患者中的表达显著升高[14],被认为是肺纤维化发病及治疗中的关键分子。TGF-β1作为促纤维化因子,可引起成纤维细胞过度增殖活化,大量肌成纤维细胞产生,ECM过度沉积,最终导致肺部组织结构重塑、肺功能受损[15]。研究表明,α-SMA是肌成纤维细胞活化的标记,胞浆中α-SMA表达使其具有收缩性,其与组织纤维化密切相关,同时其表达强度与肺纤维化程度呈正相关[16-17]。因此,α-SMA的表达水平可作为判定纤维化程度的一个间接指标,抑制TGF-β1和α-SMA的表达,可改善肺纤维化的程度[18]。
扁蒴藤素目前已成为治疗肿瘤、自身免疫及炎症性疾病的有效药物[19]。同时有文献报道,扁蒴藤素可通过下调TGF-β1等相关纤维化基因改善心肌纤维化[8]。鉴于其在心肌纤维化中的作用,本实验采用小鼠气管内注射博来霉素方法模拟具有肺纤维化病理特点的动物模型,观察并探讨扁蒴藤素对肺纤维化小鼠的干预作用及其可能的作用机制。病理结果显示,模型小鼠肺组织结构破坏严重,肺泡间隔增厚,伴有大量炎性细胞浸润和胶原纤维增生,表明小鼠肺纤维化模型构建成功。经扁蒴藤素或吡非尼酮干预后,肺泡炎和纤维化评分均明显下降,提示扁蒴藤素可在一定程度上改善博来霉素诱导的小鼠肺纤维化,其作用效果与吡非尼酮相似。免疫组化及Western blot结果显示,与正常组比较,模型组小鼠TGF-β1和α-SMA蛋白表达明显升高,这与既往研究报道[20]相一致,提示肺纤维化小鼠模型成功建立。经扁蒴藤素及吡非尼酮干预后,TGF-β1和α-SMA蛋白表达较模型组均不同程度降低,且差异有统计学意义,提示扁蒴藤素改善博来霉素诱导的小鼠肺纤维化可能是通过抑制TGF-β1和α-SMA蛋白表达实现的。
目前临床应用吡非尼酮治疗肺纤维化虽具有一定的疗效,但尚未普遍推广。本研究发现扁蒴藤素与吡非尼酮具有相似的抗纤维化作用,但具体机制及相关不良反应还有待进一步研究。
参考文献:
[1] ATZENNI F, GERARDI M C, BARILARO G, et al. Interstitial lung disease in systemic autoimmune rheumatic diseases:a comprehensive review[J]. Expert Rev Clin Immunol,2018,14(1):69-82.
[2] SIBINSKA, TIAN X, KOERFEI M. Amplified canonical transforming growth factor-β signalling via heat shock protein 90 in pulmonary fibrosis[J]. Eur Respir J,2017,49(2):1501941.
[3] AMO A I, GAUGLITZ G G, BARRET J P, et al. New molecular medicine- based scar management strategies[J]. Burns,2014,40(4):539.
[4] FISCHER A, BALJULS A, REINDERS J, et al. Regulation of RAF activity by 14-3-3 proteins[J]. Journal of Biological Chemistry, 2008,284(5):3183-3194.
[5] RAGHU G, ROCHWERG B, ZHANG Y, et al. An official ATS/ERS/JRS/ALAT clinical practice guideline:treatment of idiopathic pulmonary fibrosis. an update of the 2011 clinical practice guideline[J]. Am J Respir Crit Care Med,2015,192(2):e3-e19.
[6] BLAAUBOER M E, BOEIJEN F R, EMSON C L, et al. Extracellular matrix proteins:a positive feedback loop in lung fibrosis?[J]. Matrix Biol,2014,34:170-178.
[7] 白殊同,佟麗,王琴,等.过山枫活性成分扁蒴藤素药理作用研究进展[J].中国药理学通报,2019,35(3):318-321.
[8] EI-AGAMY D S, EI-HARBI K M, KHOSHHAL S, et al. Pristimerin protects against doxorubicin-induced cardiotoxicity and fibrosis through modulation of Nrf2 and MAPK/NF-κB signaling pathways[J]. Cancer Manag Res,2019,11:47-61.
[9] CABRERA S, MACIEL M, HERRERA I, et al. Essential role for the ATG4B protease and autophagy in bleomycin-induced pulmonary fibrosis[J]. Autophagy,2015,11(4):670-694.
[10] SZAPIEL S V, ELSON N A, FULMER J D, et al. Bleomycin-induced interstitial pulmonary disease in the nude athymic mouse[J]. Am Rev Respir Dis,1979,120(4):893-899.
[11] ASHCROFT T, SIMOSON J M, TIMBRELL V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J]. J Clin Pathol,1988,41(4):467-470.
[12] SAKAI N, TAGER A M. Fibrosis of two:epithelial cell-fibroblast interactions in pulmonary fibrosis[J]. Biochim Biophys Acta, 2013,1832(7):911-921.
[13] CHIOMA O S, DRAKE W P. Role of microbial agents in pulmonary fibrosis[J]. Yale J Biol Med,2017,90(2):219-227.
[14] 崔园园.特发性肺纤维化患者血清TGF-β1、STAT1表达水平及临床意义[D].济南:山东大学,2019.
[15] SAITO A, HORIE M, MICKE P, et al. The role of TGF-beta signaling in lung cancer associated with idiopathic pulmonary fibrosis[J]. Int J Mol Sci,2018,19(1):147.
[16] BAGALAD B S, MOHAN KUMAR K P. Myofibroblasts:Master of disguise[J]. J Oral Maxillofac Pathol,2017,21(3):462-463.
[17] DERBY I A, ZAKUAN N, BILLET F. The myofibroblast, a key cell in normal and pathological tissue repair[J]. Cell Mol Life Sci, 2016,73(6):1145-1157.
[18] 孙林清,周倩文,王发选.转化生长因子β1对肺成纤维细胞中平滑肌肌动蛋白表达的影响[J].宁夏医科大学学报,2019,41(5):461-464.
[19] TONG L, NANJUNDAIAH S M, VENKATESHA S H. Pristimerin,a naturally occurring triterpenoid, protects against autoimmune arthritis by modulating the cellular and soluble immune mediators of inflammation and tissue damage[J]. Clin Immunol,2014,155(2):220-230.
[20] HISHIKARI K, WATANABE R, OGAWA M, et al. Early treatment with clarithromycin attenuates rat autoimmune myocarditis via inhibition of matrix metalloproteinase activity[J]. Heart,2010, 96(7):523-527.
(收稿日期:2019-10-16)
(修回日期:2019-11-11;編辑:华强)
基金项目:国家自然科学基金面上项目(81774104、8197532);国家自然科学基金青年基金(81403240)
通讯作者:张前德,E-mail:zhangqiande@njmu.edu.cn
