骨化三醇对阿霉素肾病大鼠肾组织nephrin表达的影响
2020-04-29陈亚茹赵丹刘馨馨马国英杨晓萍罗星
陈亚茹 赵丹 刘馨馨 马国英 杨晓萍 罗星
(石河子大学医学院 1生化教研室,新疆 石河子 832002;2第一附属医院肾病科)
慢性肾脏病(CKD)是一种以进行性肾功能退化和不可逆转的肾脏损害为基本特征的慢性疾病,其病理机制多种多样,临床表现为尿蛋白的大量丢失。肾小球滤过屏障的破坏是造成大量蛋白尿的原因。构成滤过膜屏障的肾小球内皮细胞、肾小球基底膜和足细胞结构破坏均可导致蛋白尿的产生〔1〕。尤其是足细胞,被认为在肾小球血液滤过屏障中发挥主导优势,其独特足突的病变是导致 CKD 的关键。足突相互交错的细胞间连接被称为裂隙隔膜(SD)。足细胞裂隙隔膜分子(nephrin)作为 SD 滤过网络的核心成分,不仅影响足细胞极性、细胞存活,还是细胞内区域相互作用的的信号支架〔2〕。
骨化三醇,即活性维生素D3〔1,25-(OH)2D3〕,是维生素D3的生物活性分子,在一些神经炎症性疾病(神经性脊髓炎视神经病变)、代谢性疾病(高血压、糖尿病)及各类慢性肾脏疾病中发挥重要作用〔3,4〕。研究发现,维生素 D 水平的缺乏不仅对骨骼的正常矿化、肌肉收缩、神经传导产生有害影响,还促进蛋白尿的产生,加重CKD的病程〔3〕。本实验通过研究1,25-(OH)2D3对阿霉素(ADR)肾病大鼠肾损伤及足细胞 nephrin 表达的影响,探讨其发挥重要的肾保护作用。
1 材料与方法
1.1材料
1.1.1动物来源 90 只6周龄雄性 SPF 级 Sprague Dawley(SD) 大鼠,体重 180~220 g,购自新疆医科大学,动物许可证号:SCXK(新)2013-0001,所有实验动物饲养在石河子大学转化医学动物实验室。
1.1.2药物与试剂 注射用盐酸多柔比星(ADR)(深圳万乐药业有限公司,批号:H44024360);1,25-(OH)2D3胶丸(上海罗氏制药有限公司,批号:J20150011);Anti-nephrin antibody(美国 Abcam 公司,批号:ab183099);抗 GAPDH 鼠单克隆抗体(北京康为世纪公司生物科技有限公司,批号:201509);罗丹明标记山羊抗兔IgG(H+L)(北京中杉金桥生物技术有限公司,批号:ZF-0316)
1.1.3仪器设备 荧光显微镜、光学显微镜(日本Olympus公司);低温高速离心机(美国 Thermo Fisher 公司);蒸汽灭菌高压锅(美国 Thermo Scientific 公司);电泳仪、电转膜仪(美国 Bio-Rad有限公司);手掌型离心机(海门市其林贝尔仪器制造有限公司)。
1.2方法
1.2.1动物模型建立 随机选取60只大鼠,采用单次尾静脉注射ADR造模。将ADR溶于生理盐水至2 mg/ml,大鼠称重后固定,酒精棉球擦拭尾部使血管充盈,以 7.5 mg/kg ADR 行单次尾静脉注射。由于ADR外渗易造成烂尾现象,故注射完毕后,干棉球按压5 min止血。余30只大鼠作为对照接受等量的0.9%氯化钠注射液。
1.2.2分组与给药 注射ADR 1 w后检测造模效果,24 h UP 水平>30 mg/(100 g·d)的大鼠为模型成功。将造模大鼠随机均分为ADR肾病组、1,25-(OH)2D3治疗组(ADR+VD组)及对照大鼠作Control组;每粒1,25-(OH)2D3胶丸溶于3 ml的金龙鱼花生油,ADR+VD组每天给予 0.25 μg /kg 1,25-(OH)2D3灌胃治疗;Control 组及ADR 肾病组接受等量的花生油灌胃。实验长达10 w。
1.2.3肾功能指标检测 每治疗2 w末,留尿检测24 h UP、腹主静脉采血全自动生化分析仪检测Alb、BUN、Cre指标;称体重及双肾重,双肾重与体重的比值为肾脏系数。
1.2.4肾病理学观察 4 μm 的石蜡切片经组织化学染色〔苏木素-伊红(HE)染色、马松三色染色(Masson)〕,以400倍图像下每张切片随机选取10个肾小球视野,Image pro plus 6.0 图像分析,以系膜基质面积占肾小球面积百分比表示肾小球系膜基质增生指数,以胶原纤维在肾组织含量的百分比表示肾脏组织的纤维化程度。1 mm3肾皮质,经预冷的 2.5% 戊二醛固定,1% 锇酸再固定,用乙醇和环氧丙烷分级脱水,将脱水后的样品嵌入环氧丙烷和环氧树脂混合物,乙酸铀酰和柠檬酸铅进行双重染色观察超微结构。
1.2.5免疫荧光染色 4 μm石蜡切片脱蜡脱二甲苯后,3% 过氧化氢(H2O2) 避光孵育20 min以阻断内源性过氧化物酶,0.25% 聚乙二醇辛基苯基醚(Triton X-100)室温透膜30 min,5%胎牛血清白蛋白(BSA)37℃ 封闭50 min,nephrin抗体(1∶300)4℃孵育过夜;次日复温 30 min,PBS 浸洗5 min×3次后加入罗丹明标记山羊抗兔二抗(1∶200),避光湿盒37℃孵育1 h,PBS 洗后,加一滴(50 μl)含4',6-二脒基-2-苯基吲哚(DAPI)抗荧光衰减封片剂,暗室荧光显微镜观察。
1.2.6免疫组织化学检测nephrin表达 4 μm肾组织石蜡切片经脱蜡,抗原修复,内源性过氧化物酶封闭后,nephrin 一抗(1∶1 000) 4℃孵育过夜;次日复温,免疫组化通用二抗孵育半小时;免疫原复合物用二氨基联苯胺(DAB)标记 2 min,HE复染15 s,自来水浸洗玻片3遍,经梯度酒精和二甲苯脱水透明,晾干覆盖盖玻片。400倍视野下,每张切片随机选取10个肾小球视野,Image pro plus 6.0 软件处理数据,以阳性区积分光密度(IOD)与其面积(Area)比代表相对表达量。
1.2.7Western印迹法检测 nephrin 蛋白表达以组织/细胞裂解液(RIPA) 与苯甲基磺酰氟(PMSF)比为100∶1的比例裂解肾皮质,提取总蛋白,加入蛋白上样缓冲液后行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白转移至硝酸纤维素(NC)膜上后,孵育在含有nephrin(1∶1 000)的 5% 的脱脂奶粉中,4℃摇床过夜;山羊抗兔二抗(1∶5 000)室温比例孵育2 h,增强型化学发光试剂显影。以 GAPDH 为内参,Image J 测量其灰度值。
1.3统计学处理 采用SPSS20.0软件进行方差分析,组间多重比较,采用LSD检验。
2 结 果
2.1大鼠一般状况 Control 组大鼠饮食、饮水量较佳,毛色顺滑有光泽,精力充沛,大便成形;ADR肾病组大鼠饮食、饮水量有所下降,毛色暗黄无光泽,四肢肌张力明显减弱,便不成形,垫料易潮湿。ADR+VD 组大鼠各不良症状有所改善,但较Control组略差。
2.2各组肾功能指标比较 1,25-(OH)2D3治疗8 w,各生化指标检测显示:与 Control 组比较,ADR 肾病组大鼠24 h UP、BUN、Cre、肾脏系数显著增高(均P<0.05),Alb 显著下降(均P<0.05);ADR+VD组24 h UP、BUN、Cre显著升高(P<0.05)。与ADR肾病组比,ADR+VD组24 h UP、BUN、Cre、肾脏系数显著降低(均P<0.05),而 Alb水平升高(均P<0.05)。可见,1,25-(OH)2D3能够减轻蛋白尿,改善ADR引起的肾功能降低。见表1。
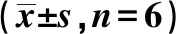
表1 各组肾功能指标的比较
与Control 组相比:1)P<0.05;与 ADR 肾病组相比:2)P<0.05,下表同
2.3各组肾组织结构的改变 肾病理学染色显示:与Control组比,ADR 肾病组大鼠肾组织出现炎性细胞浸润、基底膜增厚、系膜基质增多(P<0.05)、大量纤维增生(P<0.05)、超微结构进一步显示足细胞损伤,呈足突“熔蜡样”融合;ADR+VD 组较 ADR 肾病组病理学损伤减轻,系膜基质指数降低和纤维化面积均明显减少(均P<0.05),足细胞融合减轻。由此,1,25-(OH)2D3能够改善 ADR 引起的肾组织病理学和足细胞损伤。见表2,图1。
2.4各组nephrin定位比较 Control 组 nephrin主要分布在肾小球,并沿肾小球毛细血管袢连续细线样分布,在基底膜呈粗线样排布;ADR 肾病组肾小球 nephrin 随病程出现不连续分布;随疗程进展,ADR+VD 组不连续样分布有所改善。见图2。
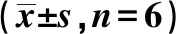
表2 各组肾组织损伤指标比较
2.5各组nephrin 蛋白分布及阳性表达比较 Control 组肾小球毛细血管壁可见棕色和黄褐色颗粒团块,连续粗线样附着于足细胞,nephrin 在Control组高表达,ADR肾病组造模2、4、6、8、10 w nephrin表达明显低于Control 组(均P<0.05),ADR+VD组造模6、8、10 w nephrin 表达与ADR组比较,有统计学差异(P<0.05),造模2~8 w与Control组比较,差异统计学意义(P<0.05),见图3,表3。

图1 各组大鼠肾组织结构的改变(HE、Masson,×400;TEM,×4 000)

图2 各组造模不同时间nephrin定位情况(IF,×400)

图3 各组造模不同时间nephrin 蛋白表达(IHC,×400)
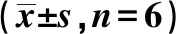
表3 各组造模不同时间nephrin 蛋白阳性表达比较
2.6各组nephrin 蛋白表达比较 与Control组比较,ADR肾病组nephrin蛋白表达显著降低(均P<0.05),ADR+VD组造模6、10 w nephrin 蛋白表达较ADR 肾病组显著升高(均P<0.05)。见表4、图4。

表4 各组造模不同时间nephrin 蛋白表达水平比较

1:Control组;2:ADR肾病组;3:ADR+VD组图4 各组造模不同时间肾组织 nephrin 蛋白表达的比较
3 讨 论
ADR 肾病是一种以初始足细胞损伤和蛋白尿及随后的肾炎症和纤维化为特征的模型,是目前模拟人类CKD较为完善且成熟的肾病模型〔5〕。1,25-(OH)2D3作为肾脏分泌的重要的内分泌激素,在不同阶段的CKD患者中存在不同程度的1,25-(OH)2D3水平的不足,早期补充1,25-(OH)2D3具有独立于钙磷调节之外的肾保护作用〔6,7〕。维生素 D 内分泌系统在钙平衡和骨代谢中承担着重要的角色,多种生物学行为的调控,如诱导细胞的分化,抑制细胞的增殖和免疫调节等都需要维生素 D 水平的调控〔8〕。已有研究表明,维生素 D/维生素 D 类似物疗法对CKD患者肾、心血管系统功能改善方面提供重要的支持〔9〕。
本研究证明了1,25-(OH)2D3显著降低 ADR 引起的 BUN、Cre、肾指数升高和大量蛋白尿,并升高 Alb 水平,同时1,25-(OH)2D3还能够改善 ADR 引起肾组织结构的损伤。此外,1,25-(OH)2D3已被证实具有抗炎、抑制系膜细胞增殖、降低蛋白尿和促纤维化细胞因子产生等多条途径发挥重要的肾保护功能〔10〕。本研究表明,1,25-(OH)2D3不仅能有效降低 ADR 肾病大鼠尿蛋白的排泄及修复肾功能障碍,减轻肾组织病理损伤、还与改善足细胞的损伤密切相关。
足细胞(或内脏上皮细胞)是排列在肾小球毛细血管外表面的终末分化细胞,是肾小球滤过柱的重要组成部分,足细胞损伤的严重程度和蛋白尿的产生密切相关,足细胞 SD 屏障的破坏是导致人体必需的血液蛋白、大分子和细胞进入尿液的原因〔11〕。足细胞是1,25-(OH)2D3发挥作用的重要靶点,足细胞的遗传或后天损伤可能导致足突消退(足细胞融合或退缩),这是蛋白尿性肾病的形态学特征。足细胞结构性损伤,如足突融合、脱落、SD断裂等,是CKD进展为肾小球硬化和终末期肾衰竭的前兆指标〔12〕。足细胞功能的维持得益于其结构的完整性,其特征性标志物 nephrin-podocin-CD2AP 复合体附着于 SD 表面,维持足细胞的动态平衡和功能的调控。
本研究中,ADR 诱导的肾病模型大鼠肾小球内 nephrin 蛋白表达降低。nephrin是狭缝隔膜主要相关蛋白,在维持 SD 的完整性和信号传输中发挥重要作用,其紊乱或缺失是遗传性和获得性蛋白尿的主要原因〔13〕。最近的研究发现,在实验动物模型和伴有蛋白尿的人类获得性肾病中 nephrin 表达降低,在一些 nephrin 基因敲除的实验鼠中发现大鼠出现严重的蛋白尿〔14,15〕。这些研究均表明,nephrin 表达缺失是蛋白尿发生发展的特征标志。本研究表明ADR 引起的肾组织结构破坏及大量蛋白尿的产生,依赖于 nephrin 蛋白表达水平的降低。虽然1,25-(OH)2D3在修复肾损伤和减少蛋白尿的过程中,与 nephrin 表达升高密切相关,但其具体的调节机制仍不明确,有待进一步研究。
综上,1,25-(OH)2D3对 ADR 诱导的肾病具有一定的保护作用,表现为降低蛋白尿,改善肾功能,修复肾组织病理学损伤,此外,1,25-(OH)2D3的作用可能是通过促进 nephrin 蛋白的表达来维持肾小球滤过膜功能的完整性,从而降低蛋白尿。目前 CKD 的治疗存在一定的局限性,随着 CKD 在全球范围内的负担加重,更好地了解肾脏损害的潜在机制具有重要的临床意义,本研究结果可以为临床CKD的治疗提供一定的药理基础,有望作为一种有前景的替代疗法用于CKD的治疗。
