Fe和N改性木质素的制备及其对水中重金属离子的高选择性吸附
2020-04-29黄纯德胡国胜
黄纯德,胡国胜
(1. 中北大学 材料科学与工程学院,山西 太原 030051;2. 国网山西省电力公司电力科学研究院,山西 太原 030001)
0 引 言
水中含氧阴离子,如硫酸盐(SO2-4)、 砷酸盐(HAsO2-4或AsO3-4)和磷酸盐(PO3-4)是毒性很高的阴离子,会严重污染湖泊海洋等水生态环境. 近年来,研究人员利用各种方法去除这些污染离子[1-3]. 其中,吸附技术因其成本低、 操作简便、 去除率高而被认为是最有前景的技术之一[4]. 在已经报道的吸附剂中,木质素及其衍生物由于其具有可再生、 可生物降解、 廉价、 易于提取等优点受到研究人员的重视,世界上木质素的年产量可达5×1014t[5]. 通过添加一些酸化剂,可以从造纸废液黑液中提取大量木质素[6]. 但木质素反应性低,所以活性位点很少. 其zeta(ζ)电位为负,故也不能通过静电作用吸附含氧阴离子. 因此,人们利用各种方法来对木质素进行改性以使木质素具备吸附能力[7-9]. 其中,木质素的电负性可以通过胺化改性而改变,使其对水中含氧阴离子具有一定的吸附性[10]. 目前,各种胺化改性木质素的制备及其对水中含氧阴离子的吸附研究较多,但大部分产品吸附能力较弱,且不具备对特定离子的选择吸附性,重复利用性能较低,这些都约束了木质素在水处理领域的应用.
本文利用三乙烯四胺和FeCl3共同对木质素进行改性,制备出一种对As(V)有很强的选择吸附性的活性木质素吸附剂(Fe/N-Lignin). 系统研究了Fe/N-Lignin对水溶液中SO2-4、 HAsO2-4和PO3-4的去除能力和选择吸附性. 同时,采用傅立叶变换红外光谱(FT-IR)、 X射线衍射(XRD)、 扫描电子显微镜(SEM)和X射线光电子能谱(XPS)等对改性后的Fe/N-Lignin进行了结构和形貌表征.
1 实验部分
1.1 材料与试剂
木质素由J&K化学公司提供,木质素主要由丁香基组成. Na2HAsO4·7H2O、 Na3PO3、 Na2SO4、 甲醛、 三乙烯四胺(TETA)、 NaOH、 HCl和乙醇由INNOCHEM公司提供.
1.2 Fe/N改性木质素的合成
取10 g木质素,加入20 ml 0.4 mol/L NaOH溶液,搅拌至完全溶解. 将3 mL TETA和1 mL甲醛加入上述溶液中,70 ℃搅拌4 h以上,直到形成均匀溶液. 将37%盐酸溶液连续添加到混合悬浮液中,直到棕色沉淀完全沉淀. 过滤、 干燥,得到中间产物N-Lignin. 将该中间产物N-Lignin加入到6 mol/L 的FeCl3溶液中,在60 ℃条件下进行络合反应4小时,然后将溶剂过滤、 利用水和乙醇反复清洗5次,得到最终产物Fe/N-Lignin.
1.3 重金属离子吸附
以Na2HAsO4·7H2O、 Na3PO3和Na2SO4为含氧阴离子盐,制备了不同浓度的S(VI)、 P(V) 和As(V)溶液. 采用电感耦合等离子体发射光谱法(Shimazu ICPE-9000)测定了吸附容量.
吸附剂的吸附量

(1)
式中:qeq为吸附剂的平衡吸附量(mg·g-1);C0为含氧阴离子的初始浓度(mg·L-1);Ce为溶液吸附平衡时含氧阴离子的浓度(mg·L-1);m为吸附剂质量(mg);V为溶液的体积(mL).
吸附剂的分布系数
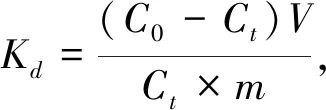
(2)
式中:C0为溶液的初始浓度(mg·L-1);Ct为达到吸附时间t时溶液的浓度(mg·L-1);m为吸附剂质量(g);V为溶液的体积(mL).
为了研究吸附剂的选择性吸附,将三种含氧阴离子共同混合于一种溶液中(混合溶液中三种离子的浓度均为50 mg·L-1,pH=6). 吸附剂对含氧阴离子的选择性可用分离系数(SFAB)表示.SF值越大,表示A和B的分离效果越好[11],说明吸附剂的选择吸附性越好.
(3)
为了说明吸附机理,以苯胺作为胺化木质素的模型化合物进行阴离子吸附的理论计算.
1.4 吸附模型拟合
研究了Fe/N-Lignin对As(V)的吸附等温线模型.
首先制备了浓度梯度为10~500 mg·L-1的溶液. 吸附时间为3 h. 吸附完成后,取上清液,过滤后,利用ICP测定溶液中As(V)的残留浓度. Langmuir等温线和Freundlich等温线分别按式(4) 和(5)拟合计算.

(4)
qeq=K×C1/ne,
(5)
式中:Ce为溶液吸附平衡时含氧阴离子的浓度(mg·L-1);qm为饱和吸附量(mg·g-1);qeq为吸附达到平衡时的吸附量(mg·g-1);K,1/n为Freundlich吸附平衡常数;b为Langmuir吸附平衡常数.
利用拟一阶(式(6))和拟二阶(式(7))动力学模型对三种含氧阴离子的吸附过程进行拟合.
拟一阶
log(qeq-qt)=logqeq=(K1/2.303)t.
(6)
拟二阶
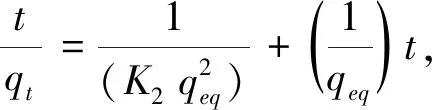
(7)
式中:qeq为吸附达到平衡时的吸附量(mg·g-1);qt为吸附时长达到t时的吸附量(mg·g-1);k1为拟一阶吸附的速率常数(min-1);k2为拟二阶吸附的速率常数(g·mg-1·min-1).
1.5 表征手段
利用扫描电子显微镜(SEM,JMS-6701F)对产品的形貌进行了表征. 利用XRD衍射仪对产品晶体结构进行了测试(试验条件: 仪器型号为Rigaku D/Max-2500; Cu Kα辐射;λ=0.154 18 nm; 40 kV; 30 mA). 利用XPS对产品化学元素组成进行了分析(测试条件: 仪器型号为Escalab220iXL; Al Kα辐射; 300 W). 利用FT-IR对产品化学结构和官能团进行了分析(仪器型号为Thermo Fisher Scientific). 溶液的pH值是利用pH计进行标定的(Thermo Scientific,型号为410P-13).
2 结果与讨论
2.1 SEM表征
图1 为木质素改性前后的扫描电镜照片.



图1 木质素改性前后的SEM图Fig.1 SEM image before and after lignin modification
从图1 中可以看出,未改性的木质素呈块状,大小约为3~5 μm. 胺化后,形貌变化不大,但有部分块状木质素分裂为很多小的片状结构. 经过Fe3+改性后,原来的块状结构已经全部转化成小粒径的片状结构. 这是由于合成过程中溶解和搅拌的作用,使得产品颗粒被分散得更细.
2.2 XRD表征
图2 是木质素改性前后的XRD衍射图,从图中可以看出,未改性前的木质素中出现许多尖峰,说明木质素本身存在晶体结构,在通过N改性和进一步通过Fe3+改性后,原来的尖峰全部消失,说明了木质素在胺化改性和金属改性后变为非晶态,且饱和吸附As(V)后仍为非晶态. 这是由于改性过程中的溶解和搅拌作用,使得改性木质素难以结晶.
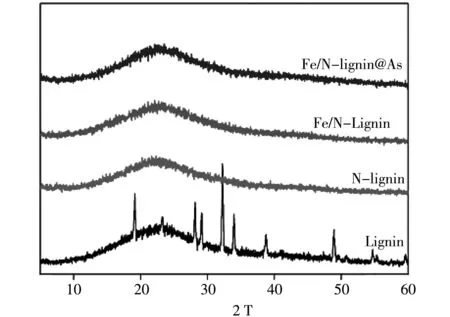
图2 木质素改性和吸附As(V)前后的XRD图谱Fig.2 XRD patterns before and after lignin modification and As(V) adsorption
2.3 FT-IR表征
与Lignin相比,N-Lignin在1 085.9 cm-1处多了一个N-O的振动峰,这是由于木质素改性后N元素的加入. 由于N元素的电负性很强,容易与Fe3+等共同形成氢键.

图3 木质素改性前后的红外光谱图Fig.3 FT-IR before and after lignin modification
当Fe/N-Lignin吸附As(V)后,873.7 cm-1处的振动峰消失,该振动峰为Fe-O的振动峰,这是因为As(V)与Fe3+结合后,使Fe-O的振动峰消失. 这从侧面说明了As(V)被吸附后,与Fe3+结合较为紧密[12].
2.4 XPS表征
通过X射线光电子能谱分析了木质素改性、 吸附前后表面的化学成分. 从图4 中可以看出,与其他三条能谱曲线相比,Lignin中少了一个N元素的结合能峰,而Fe/N Lignin与Fe/N-Lignin@As多了Fe元素的结合能峰,说明Lignin成功地利用N、 Fe元素改性. Fe/N-Lignin@As中又多了一个As元素的结合能峰,这是由于 Fe/N-Lignin 对As(V)的吸附.
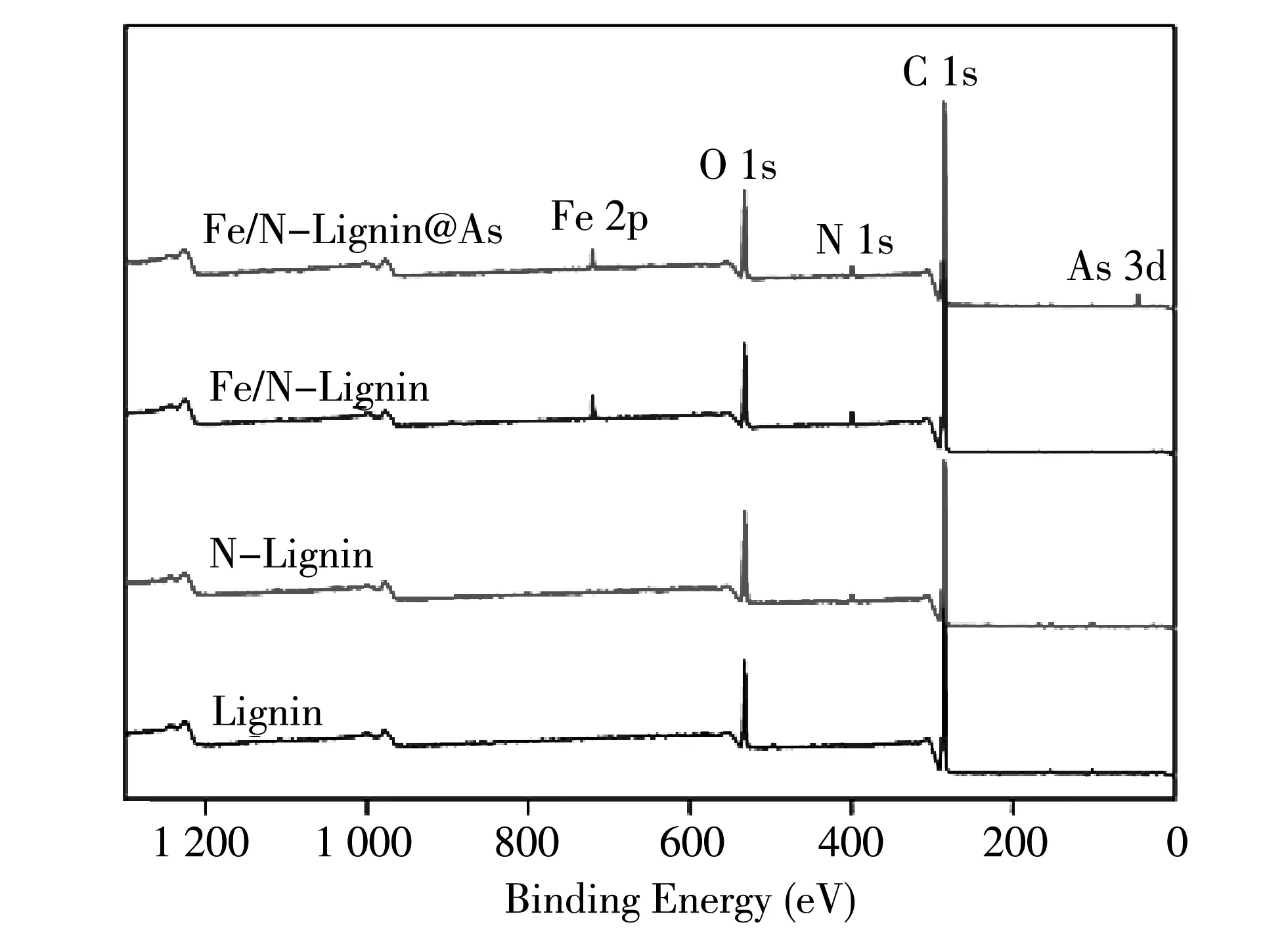
图4 木质素改性、 吸附前后的X射线能谱图Fig.4 XPS of lignin before and after modification and adsorption
2.5 吸附能力测试
溶液的pH值对含氧阴离子的吸附有很大的影响. 因此,用HCl和NaOH溶液(2 mol·L-1)调节溶液的pH值,并测试不同pH值对吸附效果的影响,结果如图5 所示.
图5(a) 显示了不同pH值下吸附剂对As(V)吸附的影响,结果表明pH值对溶液的吸附能力有显著影响. 当pH<7时,N-Lignin和Fe/N-Lignin对As(V)的吸附量较高. 随着pH值继续增加,吸附能力呈降低趋势,这是因为木质素在碱性条件下会有部分溶解,导致吸附剂被破坏. 如图5(b)所示,在pH为3-13的范围内,N-Lignin混合液的Zeta电位为负,而Fe/N-Lignin的Zeta电位为正,这说明Fe3+的改性可有效地改变吸附剂原有的带电性质,使其能够更有效地吸附水中阴离子.


图5 不同pH值对吸附剂吸附效果及Zeta电位的影响Fig.5 Effects of different pH values on adsorption efficiency and zeta potential of adsorbents
为了研究木质素改性后对三种阴离子的选择吸附性,同时利用Fe/N-Lignin、 N-Lignin和Lignin对三种阴离子混合溶液进行吸附(浓度均为50 mg·L-1),结果见表1.
如表1 所示,未经改性的木质素对三种阴离子均没有吸附作用,经过N改性后,N-Lignin对HAsO2-4有一定的吸附作用,对其他两种阴离子没有吸附作用,这是由于在HAsO2-4与N-Lignin之间的相互作用中 -OH 与N原子起到了一定的作用,这主要依赖于N改性后,木质素表面的N活性位点与HAsO2-4上的-OH基团形成氢键,即N-Lignin通过氢键对As(V)离子进行吸附. 经Fe3+、 N改性后,Fe/N-Lignin对三种含氧阴离子均有一定的吸附能力,且对HAsO2-4有很强的选择性吸附. 这是由于Fe3+的加入改变了吸附剂的Zeta电性,所以Fe/N-Lignin可以通过静电吸附作用对三种阴离子均起到一定的吸附作用,另外,Fe元素与As(V)之间也有一定的亲和作用,使得其选择性更强.
一般来讲,当两种物质分离系数大于100时,我们认为吸附剂对这两种物质具有高选择性. 根据式(2)计算得到的Fe/N-Lignin对不同含氧阴离子的Kd值,可按式(3)分别计算SFPAs、 SFSAs和SFSP的值为1.45×102,1.05×102和0.73. 所以Fe/N-Lignin对As(V)具有优异的选择吸附性.

表1 不同吸附剂对三种含氧阴离子的选择吸附性结果

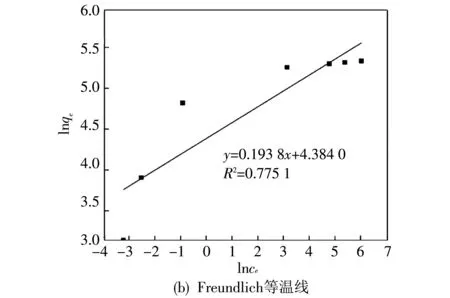
图6 Fe/N-Lignin吸附As(V)的Langmuir等温线和Freundlich等温线Fig.6 Langmuir isotherms and Freundlich isotherms of As(V) adsorption by Fe/N-Lignin
在pH=5的条件下,利用Langmuir等温线模型和Freundlich等温线模型(方程(4),(5))研究了Fe/N-Lignin对As(V)的吸附. 其中,Langmuir模型是指吸附剂中所有吸附位点都是均匀分布的,说明吸附是在吸附基表面均匀进行的. Freundlich模型是指吸附过程为非均相吸附. 从图6可以看出,Fe/N-Lignin对As(V)的吸附更符合Langmuir等温线模型(R2=0.995 6),说明了Fe/N-Lignin对As(V)的吸附为均相吸附. 同时得出,Fe/N-Lignin对As(V)的最大吸附量为207.3 mg·g-1.
利用拟一阶和二阶动力学模型研究了Fe/N-Lignin对As(V)的吸附动力学. 如图7 所示,Fe/N-Lignin对As(V)的吸附更符合拟二阶动力学模型(R2=0.999 3). 因此,Fe/N-Lignin对As(V)的吸附属于化学吸附.
吸附剂的重复利用性能对其实际应用具有重要意义. 利用Fe/N-Lignin对As(V)的吸附/脱附过程,研究了Fe/N-Lignin重复利用性能,如图8 所示,经过5个吸附/脱附循环后,Fe/N-Lignin对As(V)的吸附能力由207.3 mg/g下降到183.7 mg/g,仍保持较高的吸附性能. 因此,Fe/N-Lignin对As(V)既有较高的吸附能力,又有较高的循环吸附性能.

图8 Fe/N-Lignin的吸附/脱附循环吸附量Fig.8 Adsorption/desorption cycle capacity of Fe/N-Lignin
3 结 论
利用三乙烯四胺(TETA)和Fe3+对木质素进行了改性,制备出了一种对As(V)具有高效高选择性的吸附剂,产品具有成本低、 易制备等特点. 研究了Fe/N-Lignin对3种不同含氧阴离子的选择吸附性,发现Fe/N-Lignin对As(V)的选择性更好,对As(V)的最大吸附量达到207.3 mg·g-1. 通过吸附等温线和吸附动力学曲线拟合,发现Fe/N-Lignin对As(V)的吸附更符合Langmuir等温线模型和拟二阶动力学模型. 本研究为造纸工业废弃物的二次利用和木质素改性利用提供了一种技术手段,为水中As(V)的高选择性吸附提供了技术支持.
