构建酶敏感型嵌合肽用于肿瘤光动力学治疗*
2020-04-28程崟家张爱清
田 翔,程崟家,张爱清
(中南民族大学 化学与材料科学学院,武汉 4330074)
0 引 言
癌症是当今世界上大多数国家非常棘手的一大难题。目前传统的癌症治疗方法有化疗、放疗、和手术切除法。但是以上方法各有利弊,例如:在传统的化疗过程中,由于抗癌药物本身缺乏对癌细胞的治疗特异性,因此在治疗肿瘤细胞的同时会对正常细胞造成损伤;放疗的治疗设备昂贵,其中的射线对病人的身体往往会造成很大的伤害;手术切除法虽然能够去掉比较大的肿瘤,但是对于头部肿瘤和心脏肿瘤等,手术难度极大,风险太高。随着科技的发展,出现许多新型的癌症治疗方式,如光动力治疗(PDT)[1]、光热治疗、基因治疗和免疫治疗等。其中,PDT主要利用特定光诱导光敏剂产生活性氧簇(ROS),通过ROS诱导细胞凋亡或坏死,这种新型癌症治疗手段相较于传统的癌症治疗手段,具有一系列优势,包括对表面皮肤肿瘤的高效性和无创性,利用光控制的对肿瘤区域和时间的可选择性,以及可以重复治疗的特性,因此在肿瘤高效治疗方面获得巨大优势。据文献报道[2-5],单线态氧作为ROS家族中的成员,能够破坏肿瘤血管,激活针对肿瘤的免疫反应,最终诱导肿瘤细胞凋亡。但是单线态氧的半衰期短(<40 ns),作用范围有限(<20 nm)[6-7]。此外,常用的光敏剂如原卟啉(PpIX)、二氢卟吩等,虽然在特定波长的光照下能够产生大量的单线态氧(1O2),从而发挥PDT效应,但是其在水中的溶解性较差,不能有效靶向到肿瘤区域,因此严重影响其在生物体内进一步发挥PDT治疗的效果。针对以上问题,如何将光敏剂运输到细胞及其亚细胞器内,进而有效提高PDT的治疗效果的策略正在被广泛研究[6,8-11]。
本文设计并合成了一种能够靶向进入癌细胞线粒体的两亲性嵌合肽 PpIX-GGK(TPP)G-GFLG-R8GD(PTGR),利用其在水溶液中能够发生自组装行为,从而得到以疏水性光敏剂为内核,亲水性多肽为外壳的两亲性前药胶束,实现对疏水性光敏剂PpIX的有效负载。该前药胶束主要利用靶向肽RGD特异性识别整合素αvβ3受体过度表达的HeLa细胞,并在R8肽的协助下快速穿膜进入细胞。在癌细胞质内过度表达的组织蛋白酶B的作用下,GFLG肽能够发生特异性酶解断裂[12],从而导致胶束结构遭到破坏。在特定光照下,修饰在多肽侧链上的三苯基膦(TPP)能协助光敏剂PpIX有效富集在癌细胞线粒体周围,并产生大量活性氧,从而破坏癌细胞线粒体,诱导癌细胞凋亡或坏死。本文设计的嵌合肽具有较好的生物相容性和生物降解性,能够避免不良的免疫反应。此外,该两亲性嵌合肽可以提高将光敏剂靶向运输到癌细胞及其亚细胞器的能力,进而有效提高肿瘤的PDT治疗效果。
1 实验部分
1.1 试剂与仪器
二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、二氯甲烷、甲醇、哌啶、二异丙基乙胺(DIEA)、三异丙基硅烷(TIS)、乙醚、水合肼、三氟乙酸、氢氧化钠、无水硫酸镁,国药基团化学试剂公司;Fmoc-Lys(Dde)-OH(K)、Fmoc-Gly-OH(G)、Fmoc-Arg(Pbf)-OH(R)、Fmoc-Leu-OH(L)、Fmoc-Phe-OH(F)、Fmoc-Lys(Dde)-OH(K)、Fmoc-Asp(OtBu)-OH(D)、1-羟基苯并三氮唑(HOBt)、苯并三氮唑-N,N,N’N’-四甲基脲六氟磷酸盐(HBTU)、2-氯-三苯甲基氯树脂(2-Chlorotrityl chloride resin),上海吉尔生化公司;2,7-二氯荧光素二乙酯(DCFH-DA),碧云天生物科技有限公司;DMEM培养基、青霉素-链霉素、胎牛血清(FBS),Gibco公司;噻唑蓝(MTT), Geneview公司;4-羧丁基三苯基溴化膦(TPP)、原卟啉(PpIX),阿拉丁试剂有限公司。
荧光分光光度计(RF-5301 PC,日本岛津公司);紫外分光光度计(Lambda Bio 40,美国铂金埃尔默公司);超分辨显微镜(德国徕卡公司);纳米粒度电位仪(Nano ZS ZEN3600,英国马尔文公司);透射式电子显微镜(Tecnai G2 F20 S-TWIN,美国FEI公司);基质辅助激光解析飞行时间质谱仪(MALDI-TOF,美国布鲁克·道尔顿公司)。
1.2 合成与表征
1.2.1 PTGR的合成
PTGR的合成路线如图1所示。取三苯甲基氯树脂(0.8 g,0.97 mmol/g)于多肽固相合成柱中,加入适量DMF进行溶胀45 min,溶胀结束后进行抽滤。向多肽固相合成柱中加入Fmoc-Asp(OtBu)-OH(3当量)和DIEA(6当量)的DMF混合液,反应2h。反应结束后抽出滤液,并用DMF洗涤4次。然后向多肽固相合成柱中加入含有30%哌啶的DMF溶液反应10 min,抽取滤液,脱除FMOC保护基团。随后向多肽固相合成柱中加入Fmoc-Gly-OH(2当量),HBTU(2.4当量),HOBt(2.4当量)和DIEA(2 mL)的DMF混合液,反应2 h,进行抽滤,并用DMF洗涤数次。重复以上脱保护、洗涤和缩合步骤,至合成的嵌合肽序列为PpIX-GGK(Dde)G-GFLG-R8GD。接着向固相合成柱中加入含有20%水合肼的DMF溶液反应5 min,抽取滤液,重复反应8次,脱去Dde保护基团,用DMF洗涤数次至水合肼被完全洗掉。加入4-羧丁基三苯基溴化膦(4当量),HBTU(4.8当量),HOBt(4.8当量)和DIEA(2 mL)的DMF混合液,反应2 h后抽滤。然后用DMF、甲醇、二氯甲烷洗涤数次,真空干燥。干燥后,向反应器中加入切落剂(体积占比为95% TFA、2.5% H2O、2.5% TIS)反应100 min后,收集滤液,经过旋蒸浓缩后,用冷乙醚沉淀后离心,真空干燥24 h,得到嵌合肽分子。多肽酶解前后的分子量均通过MALDI-TOF测得。
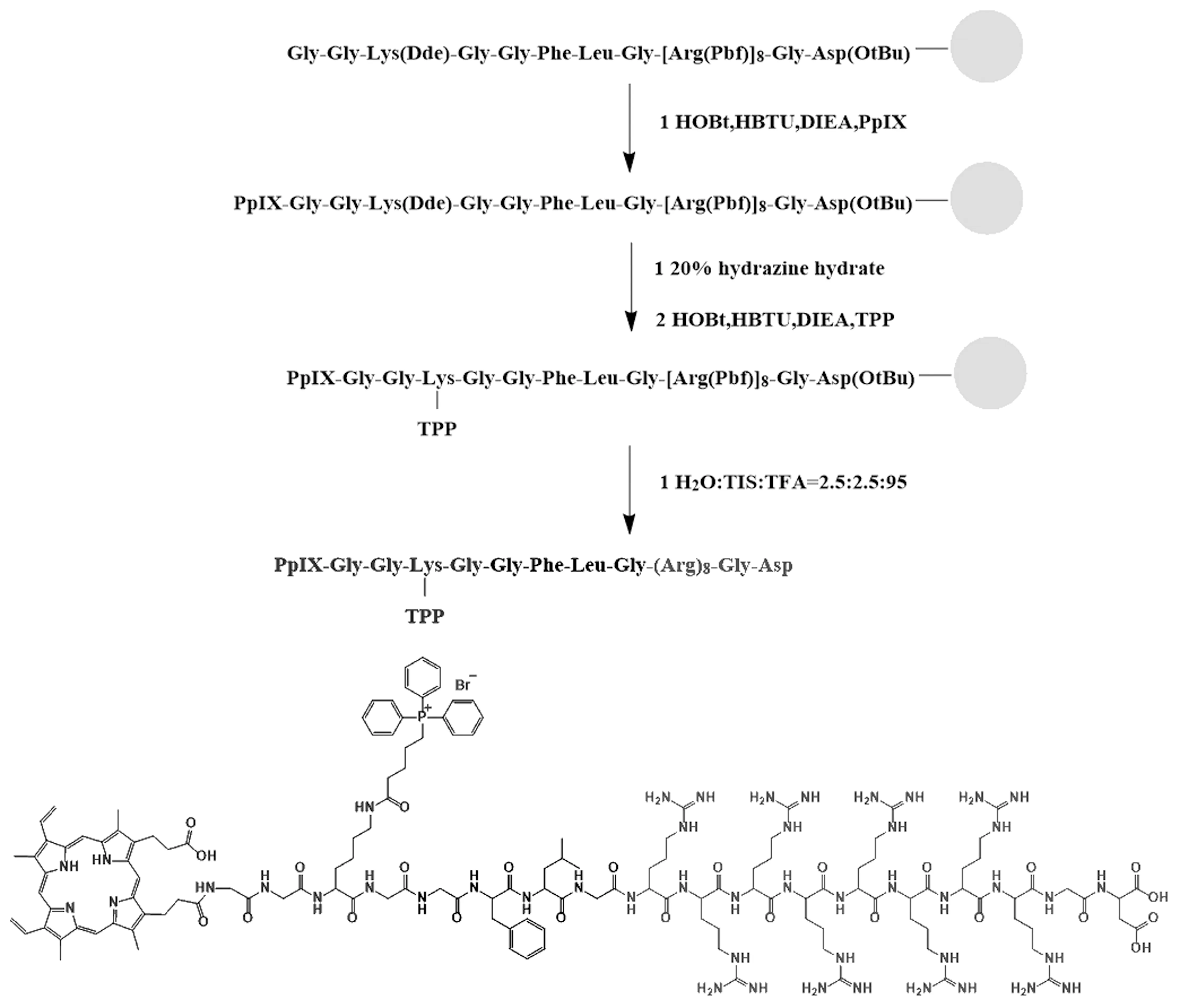
图1 PTGR的合成路线
1.2.2 PTGR电势和粒径的测定
配置100 μg/mL的PTGR水溶液,取1 mL PTGR溶液装入测试池内,使用纳米粒度电位仪检测其电势和粒径。
1.2.3 PTGR形貌的观测
配置150 μg/mL的PTGR水溶液,取10 μL的PTGR溶液滴到铜网上,静置一段时间后,用新配好的3%的磷钨酸水溶液进行负染,用TEM观测其形貌。
1.2.4 PTGR临界胶束溶度(CMC)的测定
两亲性嵌合肽胶束的CMC[13-14]是以芘为疏水性荧光探针,由荧光分光光度计测得。精确称量9.7 mg芘,使其溶于10 mL丙酮,然后稀释至4.6×10-6mol/L。向已配好的一系列浓度的3.6 mL PTGR溶液加入45 μL已配好的芘的丙酮溶液。将配置好的样品放入摇床(150 r/min 37 ℃)震荡24 h,让丙酮完全挥发。利用荧光分光光度计测定溶液在360~400 nm范围内的激发光谱,设定激发波长为342 nm,发射光和激发光的狭缝狭缝宽度均为5 nm。记录一系列浓度的溶液在393 nm与374 nm处的荧光强度。以两个位置的荧光强度比值作为纵坐标,以溶液浓度的对数为横坐标作图,找出两条直线的交点对应的横坐标值,从而计算得到该胶束的临界胶束浓度(CMC)。
1.2.5 PpIX紫外标曲的测定
配置一系列不同浓度的PpIX的混合溶液(体积占比为1% DMSO、99% H2O),以纯水的紫外可见光吸收光谱为基线,利用紫外分光光度计检测PpIX溶液在300~650 nm波长范围内的吸收光谱。记录一系列浓度梯度的溶液在400 nm处的吸光度,以吸光度的强度作为纵坐标,PpIX溶液的质量浓度作为横坐标,从而得到PpIX的紫外标曲。
1.2.6 PTGR单线态氧产生性能表征
通过DCFH-DA检测混合溶液在光照下525 nm处的荧光值的升高来表征单线态氧的产生,将DCFH-DA用0.01 mol/L NaOH处理0.5 h使其转化成DCFH。配置两组100 μg/mL的PTGR水溶液,随后加入提前处理好的探针DCFH,使DCFH的最终溶度为20 μmol/L。将第一组材料溶液置于680 nm激光(30 mW/cm2)下照射,每隔一定时间用荧光分光光度计测定在488 nm激发波长下,PTGR溶液在525 nm处的荧光强度值。第二组材料在避光条件下重复上述荧光检测的方法。
1.2.7 细胞实验
(1)共聚焦观测细胞对材料的内吞
将人宫颈癌细胞(HeLa)、非洲绿猴肾细胞(COS 7)分别接种到共聚焦培养皿中培养24 h,加入相当于5 μg/mL的PpIX的PTGR溶液。培养4 h后,向培养皿中加入Hoechst33324染色30 min,用PBS洗涤培养皿3次,并通过超分辨显微镜观测(激发波长:488 nm,PpIX接收通道:(630±10)nm。
(2)共聚焦光测材料靶向细胞线粒体
将人宫颈癌细胞(HeLa)接种于共聚焦培养皿中培养24 h,加入相当于5 μg/mL的PpIX的PTGR 溶液。培养4 h后,向培养皿中加入线粒体染料Mito Tracker Green染色30 min,用PBS洗涤3次,并通过超分辨显微镜观测(激发波长488 nm,PpIX接收通道(630±10)nm,Mito Tracker Green接收通道(540±10)nm)。
(3)共聚焦观测细胞内的ROS生成
将HeLa细胞接种于共聚焦培养皿中培养24 h,加入含有5 μg/mL的PpIX的PTGR溶液。培养4 h后,加入DCFH,使DCFH在培养皿内的最终浓为20 μmol/L。继续培养30 min后,在680 nm激光(30 mW/cm2)下照射1 min,用PBS洗涤三次培养皿,并立即通过超分辨显微镜观测(激发波长488 nm,接收通道(525±10)nm)。
(4)共聚焦光测细胞线粒体损伤
将HeLa细胞接种于共聚焦培养皿中培养24 h,加入相当于5 μg/mL的PpIX的PTGR 溶液。培养4 h后,加入染料JC-1染色30min,在680 nm激光(30 mW/cm2)下照射1 min,用PBS洗涤3次,并通过超分辨显微镜观测(激发波长488 nm,monomeric JC-1接收通道(520±10)nm,aggregated JC-1接收通道(580±10)nm)。
2 结果与讨论
2.1 PTGR的结构与性质表征
如图2(a),利用MALDI-TOF对合成的PTGR进行了表征。PTGR的理论分子量是3081,MALDI-TOF结果显示该材料的分子量为3081,此分子量和理论分子量一致,证明了PTGR的成功合成。如图2(b),利用MALDI-TOF对酶解24 h后的PTGR 进行表征,与酶解前的相比,新出现了分子量为500、1 284和1 498的3个峰与PTGR含有的多肽片段LGRR、R7GD和GR8GD分子量相吻合,表明了PTGR 能够被组织蛋白酶B瓦解。利用TEM观测PTGR在水溶液中的自组装形貌,由图3(a)所示,不难发现,PTGR通过自组装形成了尺寸在60 nm左右的球形纳米颗粒,分布比较均匀,表明键接上PpIX的多肽自组装结构比较稳定,具有较好的分散性。此外,利用纳米粒度电位仪分别检测PTGR材料的电势和粒径。实验结果(表1)进一步表明PTGR在水中能够有效组装成尺寸为140 nm左右的纳米粒子,而且表面电势为+21.1 mV,有助于PTGR快速穿过细胞膜进入癌细胞。其中,TEM观测到的纳米颗粒尺寸比纳米粒度电位仪检测出的粒径小,是由于PTGR在TEM测的是其干态下的纳米粒径,而纳米粒度电位仪表征的是其水合粒径[15]。据报道[16],具有两亲性结构的纳米材料在一定浓度的条件下会自组装形成胶束,同时将芘包埋在其疏水性内核中,从而引起芘的荧光发生变化。因此,用疏水性的芘做为荧光探针,对PTGR的CMC进行测定,如图3(b)所示,PTGR的CMC值是1.5 μg/mL,表明PTGR在极低的浓度下能够自组装形成胶束,且纳米胶束的结构紧凑。如图3(c)所示,利用紫外分光光度计对PpIX的浓度进行标定,得到PpIX的紫外标准曲线,从而标定PTGR中的PpIX含量。
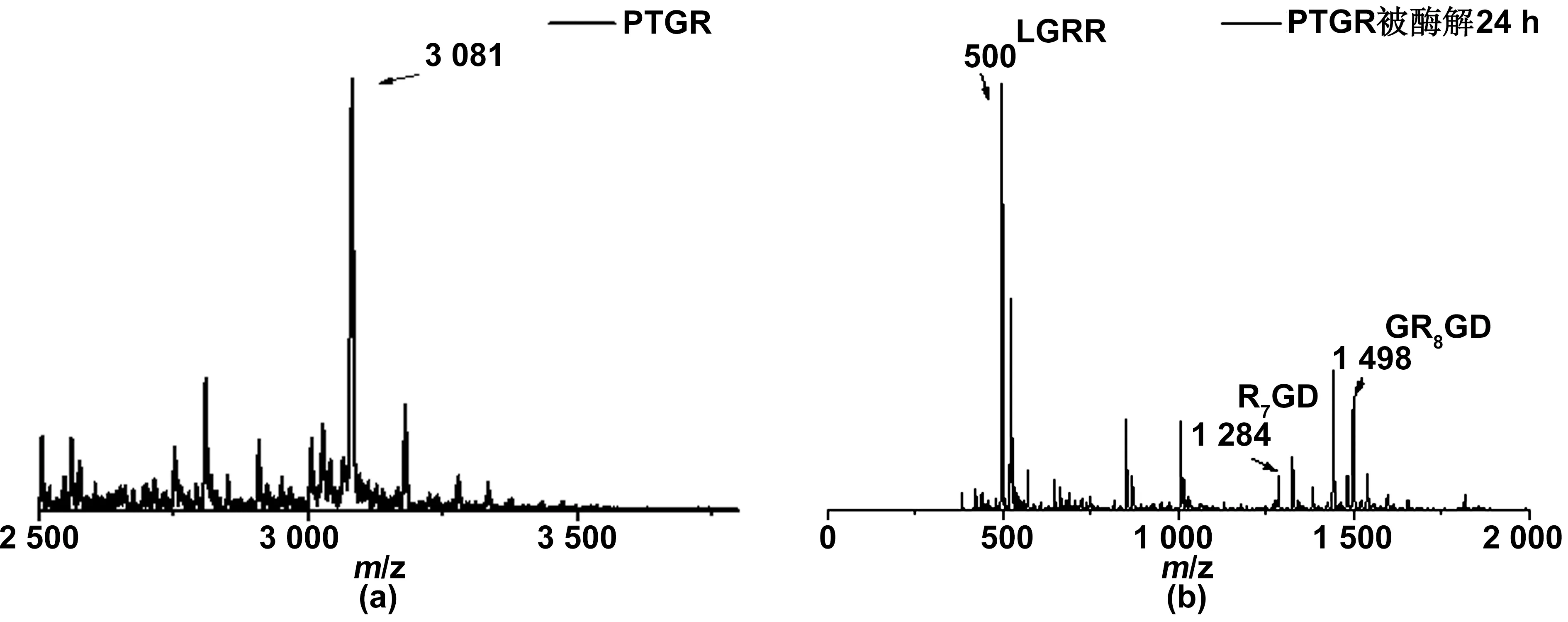
图2 (a)PTGR及(b)PTGR酶解后的质谱

表1 PTGR的粒径和电势
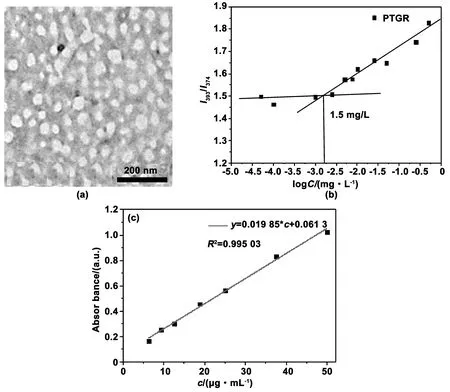
图3 PTGR的(a)透射式电子显微镜图像,(b)临界胶束浓度(CMC)和(c)PpIX 的紫外标准曲线
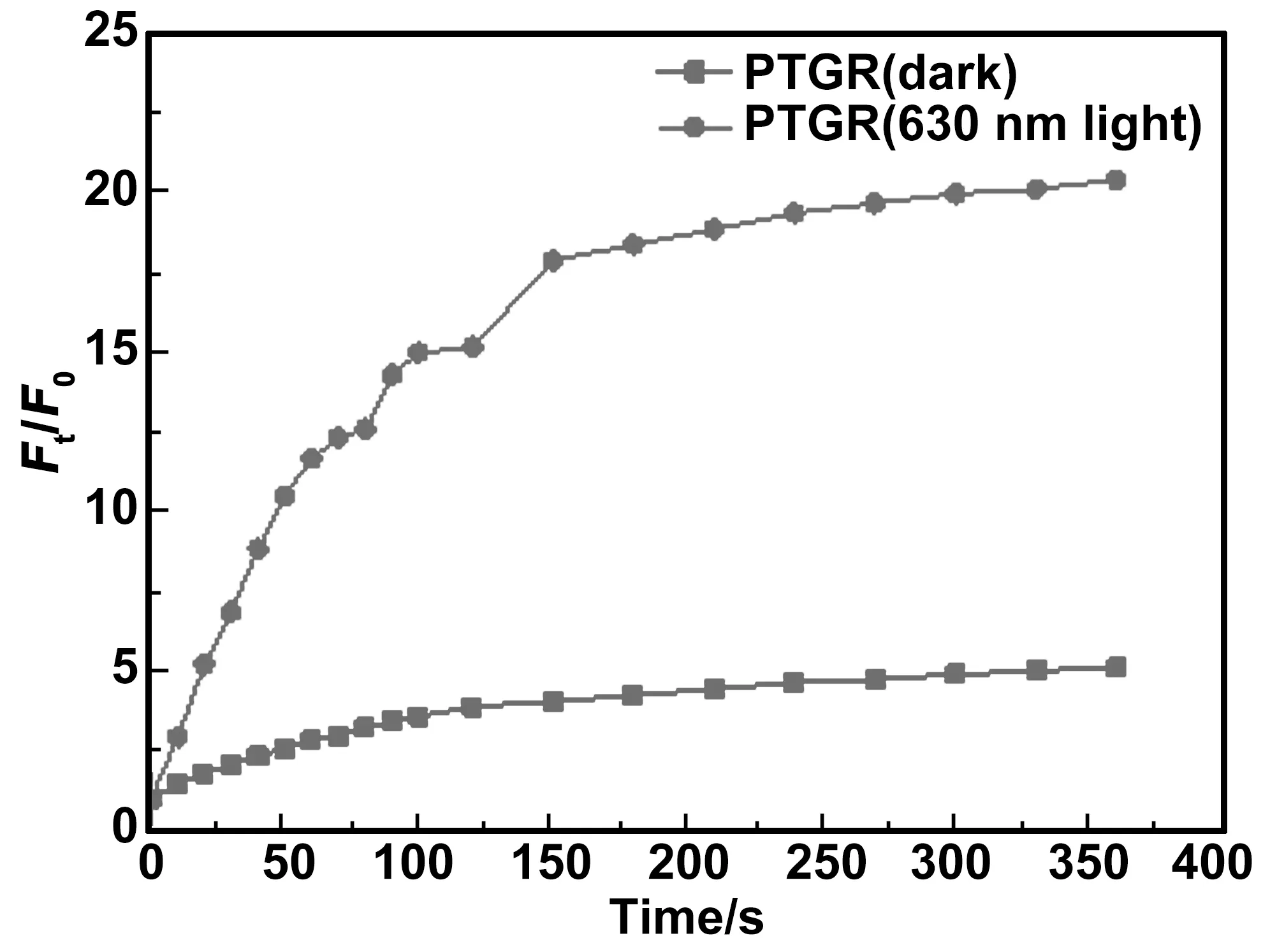
图4 PTGR溶液分别在避光和680 nm激光(30 mW/cm2)诱导条件下,DCF在525 nm处的荧光强度随光照时间的变化
最后对PTGR产生ROS的性能进行了探究,如图4所示,通过荧光分光光度计检测,发现在360 s内,在680 nm激光的诱导下,PTGR溶液在525 nm处的荧光强度比初始的荧光强度高了20倍,而避光条件下的PTGR溶液在525 nm处的荧光强度变化较小。表明PTGR在特定波长的激光诱导下,能够在短时间内产生大量的ROS,从而具备杀死细胞的潜力。而在避光的情况下,产生的ROS较少,则对细胞的毒性较小。因而可以通过光照时间的长短和光照区域的不同,控制PTGR产生ROS的量和位置,从而发挥光动力治疗。
2.2 细胞实验
2.2.1 对癌细胞靶向能力的检测
由图5可知,HeLa细胞的细胞核周围出现了大量的PpIX的红色荧光,而COS 7细胞的细胞核周围的红色荧光较少。这是由于PTGR中含有靶向肽RGD,能够识别HeLa细胞表面过度表达的整合素αvβ3,在穿膜肽R8的引导下,光敏剂PpIX能够快速被运输到HeLa细胞内。由于HeLa细胞内过度表达的组织蛋白酶B能有效切断GFLG序列,最终导致PTGR胶束瓦解并释放出PpIX。但是,正常细胞COS 7表面表达整合素αvβ3较少,导致出现在COS 7细胞内的PpIX较少。该实验证明PTGR能够有效的被癌细胞内吞并释放出PpIX。
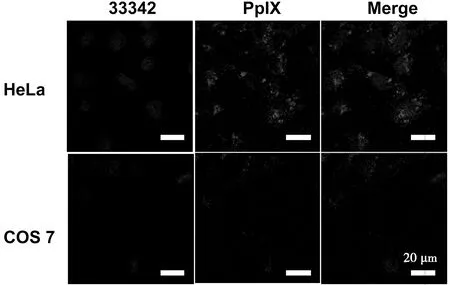
图5 PTGR分别与HeLa细胞和COS 7细胞共同培养4 h的共聚焦显微镜图像。比例尺:20 μm
2.2.2 对癌细胞线粒体靶向能力的检测
如图6所示,PpIX的红色荧光与Mito track green的绿色荧光能够很好的重合,这是由于PTGR材料经过HeLa细胞内吞后释放PpIX,随后在TPP的引导下,PpIX能有效到达HeLa细胞的线粒体周围。这为PTGR在亚细胞器周围发挥光动力治疗提供了可能。
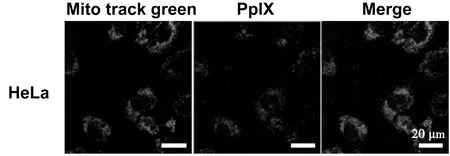
图6 PTGR靶向线粒体的能力,绿色荧光为Mito Tracker Green,红色荧光为PpIX。比例尺:20 μm
2.2.3 对PTGR在细胞内产生ROS性能的检测
如图7所示,实验组的HeLa细胞内产生强烈的DCF的绿色荧光,这是由于PTGR在680 nm波长的激光光照下产生大量的ROS,将不发光的DCFH氧化为发绿色荧光的DCF。而空白组和对照组培养的HeLa细胞中几乎没有绿色荧光区域,表明避光条件下的PTGR在细胞内基本没有产生ROS。上述实验表明,PTGR可以通过光诱导产生ROS,而ROS具有杀死癌细胞的能力。由此证明PTGR具有光动力治疗的潜能。
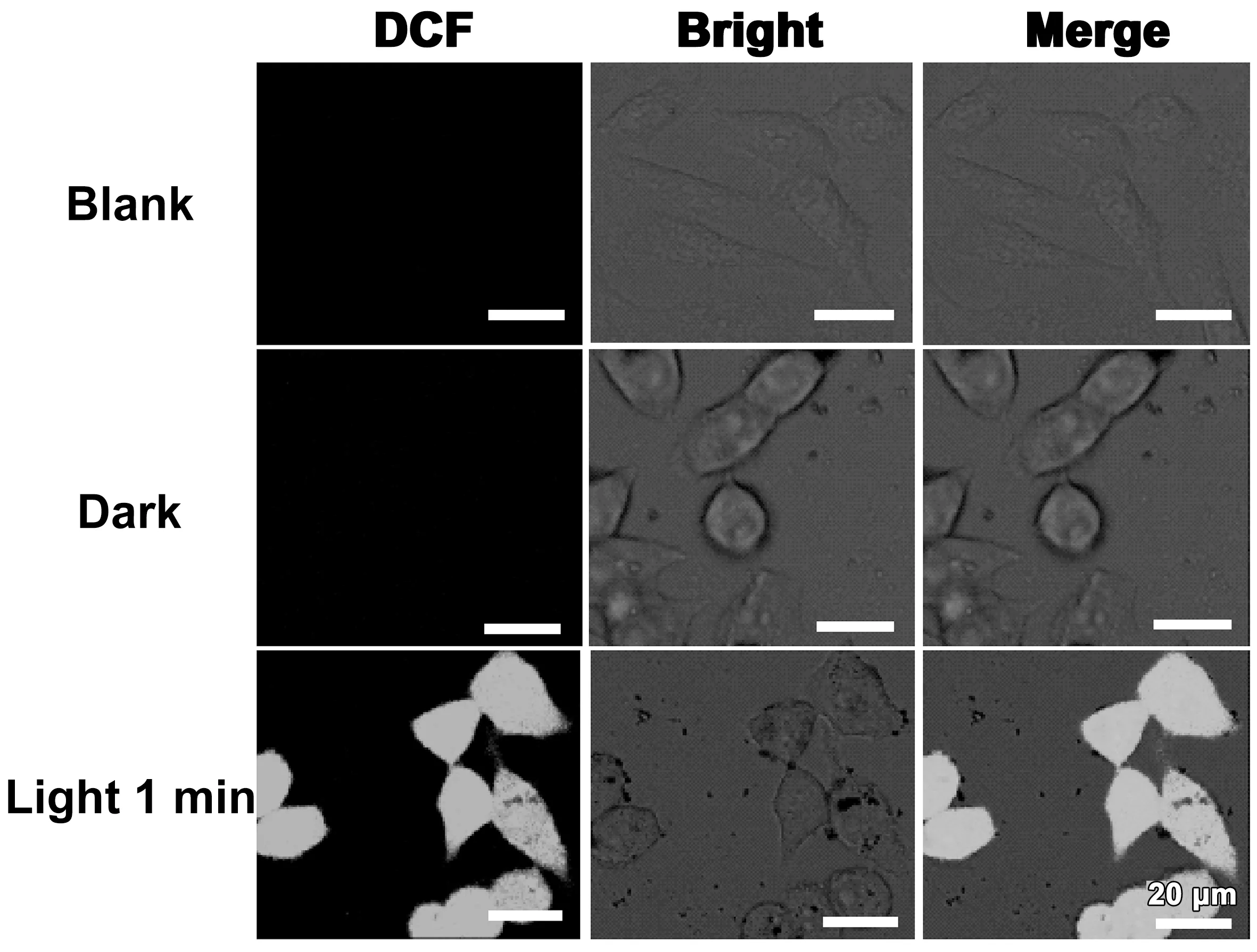
图7 PTGR分别在避光和光照(功率密度:30 mW cm-2)条件下,在HeLa细胞内产生ROS的情况。其中,blank为空白组。比例尺:20 μm
2.2.4 对癌细胞线粒体的损坏能力的检测
如图8所示,在避光条件下,HeLa细胞内的JC-1染料基本没有绿色荧光,随着光照时间的增加,绿色荧光越强,红色荧光越弱。这是因为PTGR释放的PpIX富集在HeLa细胞的线粒体周围,并通过激光诱导产生大量ROS,有效破坏 HeLa细胞的线粒体。此外,随着光照时间增加,PTGR对线粒体的破坏越大。以上实验表明PTGR能够在光照条件下,有效破坏癌细胞的线粒体,从而实现光动力治疗的目的。
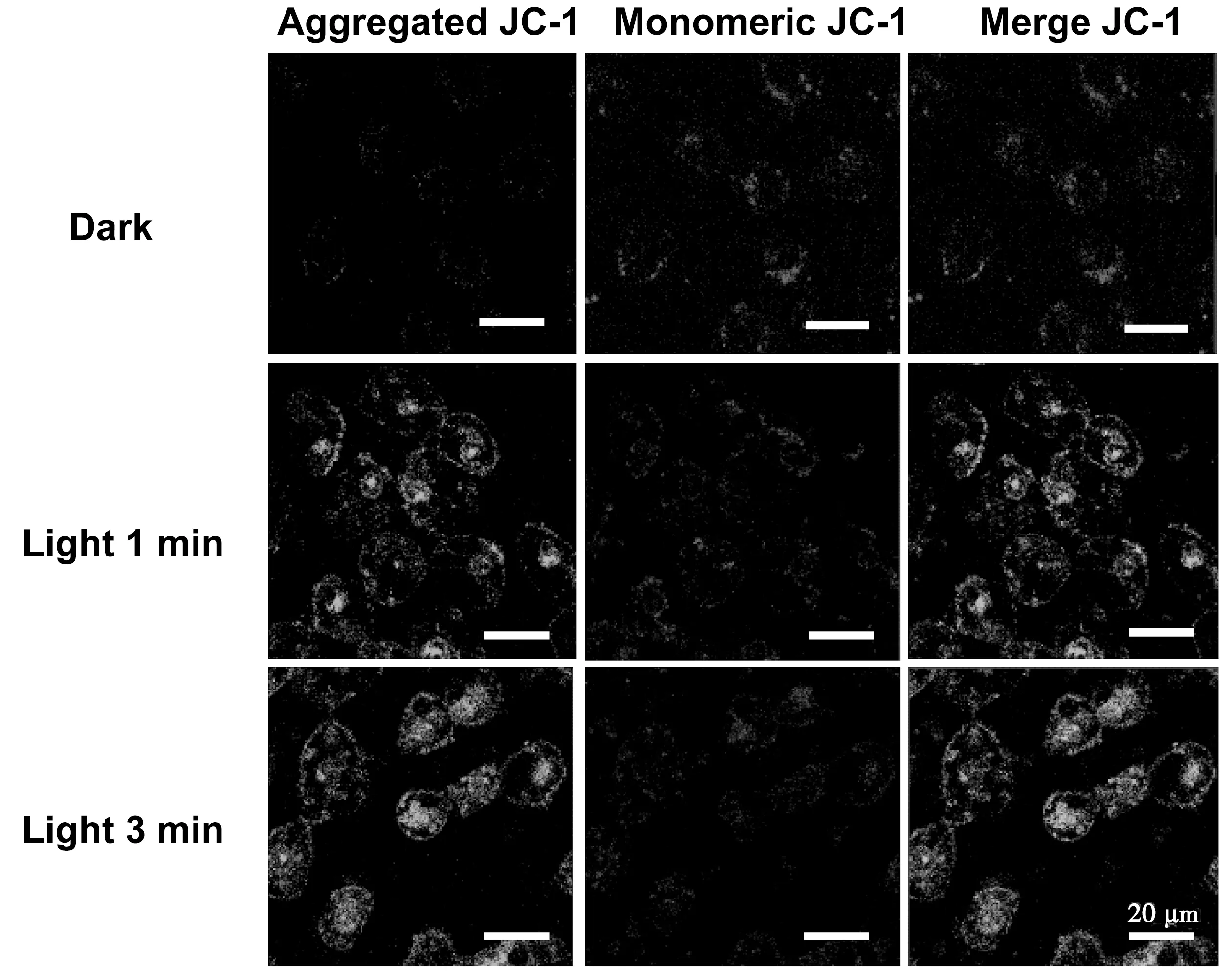
图8 PTGR随光照时间对线粒体的破坏,绿色荧光为Aggregated JC-1,红色荧光为Monomeric JC-1。比例尺:20 μm
3 结 论
(1)本文通过合理设计多肽序列,利用多肽的固相合成法,成功合成得到含有光敏剂PpIX的两亲性嵌合肽PTGR。PTGR在水中能够发生自组装,得到具有核壳结构的纳米前药胶束。
(2)胶束PTGR能主动靶向进入HeLa细胞,在细胞内有效释放出PpIX,并富集在癌细胞线粒体周围。
(3)胶束PTGR在特定波长光照下,产生大量ROS,从而有效破坏癌细胞线粒体,以实现光动力治疗的目的。
