回收方法对鲢鱼肌浆蛋白和功能特性的影响
2020-04-28陈梦迪杨梅马俪珍任小青
陈梦迪,杨梅,马俪珍,任小青
(天津农学院食品科学与生物工程学院,天津 300384)
鱼肉中肌浆蛋白占总蛋白含量的20%~50%[1],长期以来人们认为肌浆蛋白会干扰肌原纤维蛋白的凝胶化,因此,为了提高淡水鱼糜制品品质,通常采用漂洗的方式去除鱼糜中的肌浆蛋白,但这样做会导致大量的肌浆蛋白流失到漂洗水中,不仅造成蛋白质资源的大量浪费,而且使周边水环境富营养化,产生赤潮等环境问题[2-4]。因此,对大量的鱼糜漂洗水进行处理,有效回收其中的蛋白质,不仅可减少蛋白质资源浪费,提高水产品附加值,同时使废水循环利用成为可能,顺应了水产品清洁化、高值化生产的趋势。
近年来,越来越多的科研人员关注于如何将肌浆蛋白从鱼糜漂洗水中进行回收及其应用,徐律等[5]利用等电沉淀法回收鱼糜漂洗水中蛋白质,其回收率可高达83.33%;Huang 等[6]等究了间断性加热对鱼糜漂洗水中蛋白质的回收效果,发现70 ℃为蛋白质凝聚的最佳温度;Bourtoom 等[7]利用调节pH 值处理鱼糜漂洗水以达到高的蛋白质回收率。Yongsawatdigul 和Piyadhammaviboon 等[8]发现罗非鱼肌浆蛋白的添加破坏了蜥蜴鱼鱼糜的凝胶,Jafarpour 和Gorczyca 等[9]报道了鲤鱼肌浆蛋白能够增强鱼糜的质地。但有关肌浆蛋白的微观结构及功能特性研究报道相对较少。
本试验研究不同回收方法对肌浆蛋白微观结构和功能特性的影响,回收方法包括:35 ℃真空浓缩冷冻干燥、35 ℃真空浓缩-调节 pH 值冷冻干燥、65 ℃真空浓缩冷冻干燥、65 ℃真空浓缩-调节pH 值冷冻干燥和调节pH 值冷冻干燥5 种方法,以期根据回收蛋白质的功能特性不同,从而筛选出对应的回收方法,为鱼糜漂洗水中蛋白质回收及副产物利用提供支持。
1 材料与方法
1.1 材料与试剂
鲢鱼(2 kg~2.5 kg):天津市西青区红旗农贸市场,20 min 内运送至天津农学院食品加工车间。
溴酚蓝:天津市大茂化学试剂厂;甘油、Tris-HCl、甘氨酸:北京索莱宝科技有限公司;酒石酸钾钠:哈尔滨市万泰生物药品公司;2,4-二硝基苯肼:上海申翔化学试剂有限公司;尿素:天津光复科技发展有限公司;考马斯亮蓝G-250:上海蓝技科技发展有限公司;牛血清蛋白:上海生物生工有限公司;甲叉双丙烯酰胺、β-巯基乙醇、十二烷基硫酸钠:美国Sigma 公司。以上试剂均为分析纯。
1.2 仪器
酸度计(PB-10):赛多利斯科学仪器有限公司;高速剪切分散乳化机(FA25):德国弗鲁克公司;紫外分光光度计(UV-1800):日本岛津公司;差示扫描量热仪(DSC200F3):德国耐驰公司;冷冻离心机(ST40R):德国 Theromo Scientific 公司;旋转蒸发仪(RE-2000A):上海亚荣生化仪器厂;低温泵(DW-5/20):上海振捷实验设备有限公司;飞纳台式扫描电子显微镜(Phenom G2 pro):荷兰飞纳公司;傅立叶变换红外光谱仪(Spectrum65):美国 Perkin Elmer 公司;电泳仪(MINI 4):美国伯乐公司。
1.3 试验方法
1.3.1 鱼糜漂洗水制备
将新鲜鲢鱼宰杀后采肉、搅碎,添加4 ℃的蒸馏水漂洗,且鱼肉与水的质量比为1∶3,用高速剪切分散乳化机在 15 000 r/min 匀浆 2min,4 ℃下 10 000×g 离心后过滤,得到的滤液为鱼糜漂洗水,用于回收肌浆蛋白。

1.3.2 试验方案设计
1.3.2.1 指标测定方法
1.3.2.2 傅里叶红外光谱的测定
参考喻亚丽等[10]的方法。在干燥的条件下,取冻干的肌浆蛋白样品1 mg,经KBr 压片,用Spectrum65 红外光谱仪对样品进行红外扫描。扫描范围为1 700 cm-1~1 000 cm-1。
1.3.2.3 扫描电镜的测定
将不同处理方法得到的肌浆蛋白样品冻干,随后取样品均匀涂抹在试样盘上,通风橱风干,进行喷金镀膜处理,喷射仪工作距离50 mm,喷射时间3 min~5 min,镀膜厚度大约20 nm。然后将试样盘从镀膜机中取出、放在扫描电镜仪内,调整束斑位置和放大倍数、聚焦清晰后获取微观结构图像。
1.3.2.4 总巯基含量的测定
总巯基含量的测定参考李鹏的方法[11],吸取0.5 mL浓度为2 g/L 的蛋白质溶液置于2.5 mL 含8 mol/L 尿素的Tris-甘氨酸和0.02 mL 的Ellman’s 试剂(每1 mL Tris-甘氨酸中加 4 mg 5,5’-二硫基-2-对硝基苯甲酸)的离心管中。加入 20 μL 5,5’-二硫基-2-对硝基苯甲酸(5,5'-dithio bis-2-nitrobenzoic acid,DTNB)计时反应25 min 后,立即在412 nm 下进行吸光度的测定。总巯基浓度计算使用摩尔消光系数13600 cm/(mol/L),被溶解的蛋白质含量使用考马斯亮蓝法测定。公式如下:
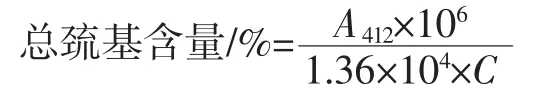
式中:A412为 412 nm 下的吸光度;1.36×104为摩尔吸光系数;106为摩尔基础单位到mmol/L 和蛋白质从mg 到g 的单位转换;C 为考马斯亮蓝法在595 nm 下测得的蛋白质浓度,mg/mL。
1.3.2.5 表面疏水性的测定
蛋白质表面疏水性的测定参照Chelh 等[12]的方法。将蛋白质溶于pH 为7.0,20 mmol/L 的磷酸缓冲液中得到蛋白质溶液浓度为5 mg/mL。准确吸取1 mL 的蛋白质溶液与 200 μL 的溴酚蓝(1 mg/mL)混匀,室温(25 ℃)下搅拌 10 min,然后 10 000×g 离心 15 min,将得到的上清液稀释10 倍后,于595 nm 下测定溶液的吸光值 A,以磷酸缓冲液(pH 7.0,20 mmol/L)加 200 μL的溴酚蓝(bromophenol blue,BPB)为空白样品。计算公式为:
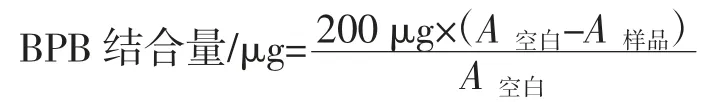
1.3.2.6 乳化性及乳化稳定性的测定
采用浊度法测定乳化性和乳化稳定性[13]使用0.5 mol/L NaCl、20 mmol/L Tris-HCl(pH7.5)缓冲液配制5 mg/mL 蛋白质溶液,2 mL 大豆油与8 mL 蛋白质溶液于高速剪切分散乳化机下10 000 r/min 均质2 min。分别于 0 min 和 10 min 从底部迅速取出 50 μL,用 0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)稀释一百倍后,于500 nm 下测定吸光值。乳化性计算公式如下:

式中:A500为样品吸光值;F 为样品稀释倍数,即100;C 为蛋白质浓度,即 0.005 g/mL;φ 为油相占体积比,即0.25。乳化稳定性计算公式如下:

式中:A0为 0min 吸光值;A10为静止 10min 吸光值。
1.3.2.7 差示扫描量热法(differential scanning calorimetry,DSC)测定
测定采用差示扫描量热法,称取10 mg~15 mg,密封在铝盒中并放入样品池,以空盒做参比,保护气为氮气,流量为20 mL/min,升温速率为10 ℃/min,温度范围 10 ℃~200 ℃。
2 结果与分析
2.1 不同回收方法得到的鱼糜漂洗水中肌浆蛋白的傅里叶红外光谱(fourier infrared spectroscopy,FT-IR)分析
不同回收方法得到的鱼糜漂洗水中肌浆蛋白的红外光谱图见图1。
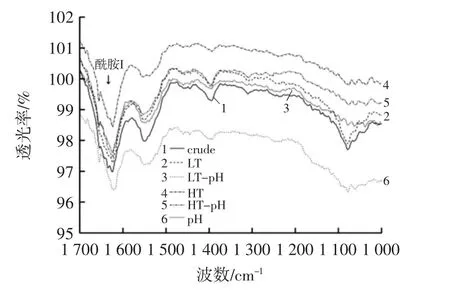
图1 不同回收方法得到的鱼糜漂洗水中肌浆蛋白的红外光谱Fig.1 Infrared spectra of sarcoplasmic proteins in fish mince wash water obtained by different recovery methods
酰胺Ⅰ带(1 600 cm-1~1 700 cm-1)主要来自 C=O的伸缩振动,并且通常提供关于蛋白质二级结构信息[14]。由图1 可知,不同回收方法都改变了肌浆蛋白的结构,只是不同回收方法导致肌浆蛋白的变性程度不同,从而导致FT-IR 在酰胺I 带表现出的强度不同。当鱼糜漂洗水经过35 ℃浓缩时,导致其轻微变性,因此LT 组在酰胺I 带表现出的强度低于crude 组;当鱼糜漂洗水仅经过65 ℃浓缩及调节pH 值处理后,变性程度增加,因此HT 组和pH 组在酰胺I 带表现出的强度低于Crude 组和LT 组,酰胺I 带强度的降低表明了肌浆蛋白二级结构的展开。Yongsawatdigu 等[15]在研究调节pH处理马鞭子肌浆蛋白时发现,调节pH 值使肌浆蛋白在酰胺I 带的强度降低与本试验结果一致。
Crude、LT、LT-pH、HT、HT-pH 以及 pH 组在酰胺Ⅰ带的吸收峰分别为 1 625、1 624、1 622、1 623、1 622、1 623 cm-1,其中经过加热浓缩结合调节pH 值处理的肌浆蛋白的酰胺I 带特征振动频率低于其他几组。可能是因为调节pH 值后,在极性环境中,受到氢键或者电子基团的作用,酰胺I 带特征振动频率会向低波数方向移动。
不同回收方法对鱼糜漂洗水中肌浆蛋白二级结构含量的影响见表1。
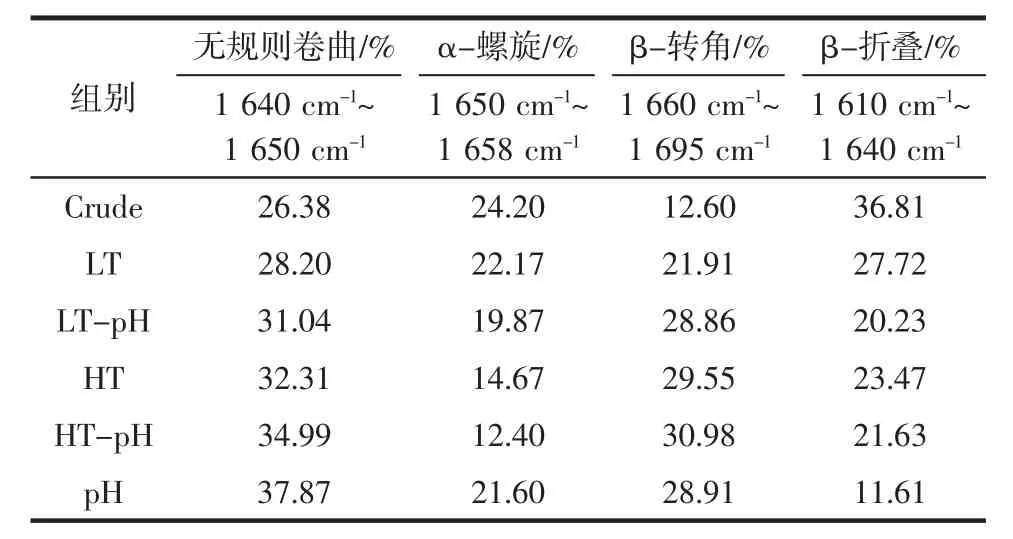
表1 不同回收方法对鱼糜漂洗水中肌浆蛋白二级结构含量的影响Table 1 Effects of different recovery methods on the secondary structure of sarcoplasmic protein infish mince wash water
酰胺I 带各处理组表现出的强度不同对应着其二级结构的变化。波数在1 650 cm-1~1 658 cm-1处峰面积代表α-螺旋的含量,波数在1 610 cm-1~1 640 cm-1处峰面积代表β-折叠的含量,波数在1 640 cm-1~650 cm-1处峰面积代表无规则卷曲的含量,波数在1 660 cm-1~1 695 cm-1处峰面积代表β-转角含量[16]。对不同回收方法得到的鱼糜漂洗水中肌浆蛋白的傅里叶红外光谱酰胺I 谱峰进行傅里叶自转积谱分析,得到自转积谱和相应的二级结构构象指认,结合Origin 里的Savitsk-Golay 函数得到各个峰区对应的面积,即为各结构的含量。由表1 可知,crude 组的肌浆蛋白中α-螺旋的结构含量为24.20%,β-折叠的结构含量为36.81%,LT 组和HT 组的α-螺旋以及β-折叠的结构含量均低于crude 组,加热条件下α-螺旋含量降低代表蛋白质分子展开程度增加。
crude 组无规则卷曲含量为26.38%,β-转角的结构含量为12.60%,其他几组无规则卷曲和β-转角的结构含量均高于crude 组,且经过调节pH 值处理过的肌浆蛋白的无规则卷曲和β-转角的结构含量均略高于未经调节pH 值处理过的肌浆蛋白。正如张红娟等[17]在研究pH 值对11S 球蛋白结构与凝胶性的影响时发现,pH 值为4.15 时11S 球蛋白的无规则卷曲含量比pH 值为7.5 时含量多,而α-螺旋的结构含量为0。
结合图1 和表1 可知,不同回收方法得到的肌浆蛋白结构均有所变化,蛋白质结构由正常的α-螺旋和β-折叠转变为无规则卷曲和β-转角,使得蛋白质结构越来越松散,疏水基团暴露从而使其表面活性增强,变性后的蛋白质有利于蛋白质的交联。
2.2 不同回收方法得到的鱼糜漂洗水中肌浆蛋白的扫描电镜分析
不同回收方法得到的肌浆蛋白的扫描电镜图像见图2。

图2 不同回收方法得到的鱼糜漂洗水中肌浆蛋白的微观结构图Fig.2 Microstructure diagram of sarcoplasmic protein in fish mince wash water obtained by different recovery methods
由图可以看出,crude 组蛋白质样品(图2 a~b)蛋白质表面比较平整,大部分呈块状稍有褶皱和微小的孔洞;LT 组蛋白质样品(图2 c~d)由大片的块状变成小块状,褶皱增加表面微小的孔洞增多,LT-pH 组蛋白质样品(图2 e~f)整体还是呈现块状结构,然而其表面结构与crude 组和LT 组样品相比变得粗糙,细小的孔洞增多;HT 组蛋白质样品(图2 g~h),与 crude 组和LT 组相比表面褶皱增加,结构粗糙,与LT-pH 相比细小孔洞减少,大缝隙变多;HT-pH 组蛋白质样品(图2 i~j),与HT 组相比表面褶皱变少,孔洞密集呈蜂窝状;pH 组蛋白样品(图2 k~l)表面结构已经被破坏,出现大的孔洞呈絮状。根据以上结果可知,加热浓缩导致蛋白质结构发生变化,浓缩温度由35 ℃增加到65 ℃,导致蛋白质聚集从而出现更多的褶皱;调节pH 值导致蛋白质白结构均出现不同程度的孔洞,说明热处理和pH 值处理可破坏蛋白质的结构,使其从有序的结构变为无序的结构,这也对应着前文表1 的结果,经过不同的处理,蛋白质结构由正常的α-螺旋和β-折叠转变为无规则卷曲和β-转角,使得蛋白质结构越来越松散。
2.3 不同回收方法对鱼糜漂洗水中肌浆蛋白总巯基含量的影响
不同回收方法对鱼糜漂洗水中蛋白质的总巯基含量的影响如见图3。
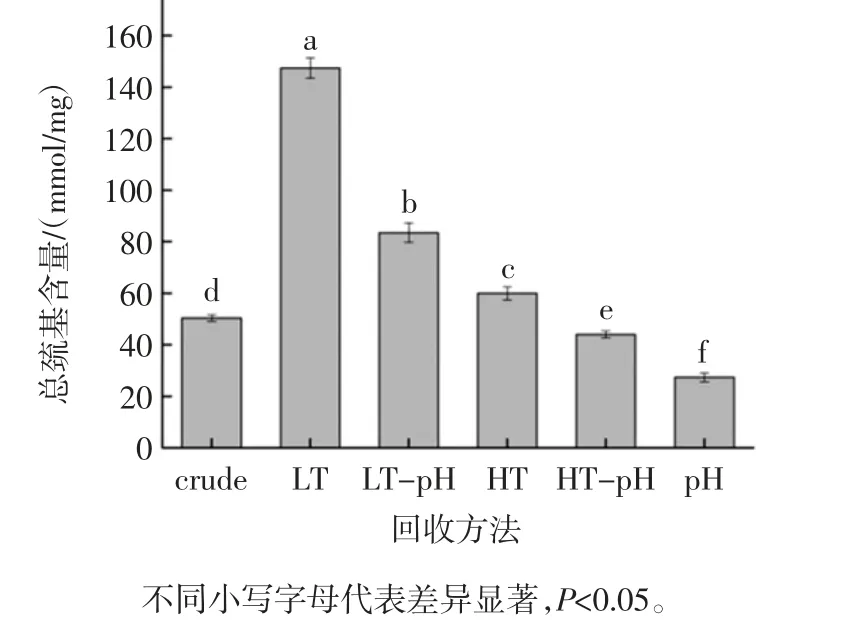
图3 不同回收方法对鱼糜漂洗水中蛋白总巯基含量的影响Fig.3 Effects of different recovery methods on the content of total sulfhydryl groups in fish mince wash water
巯基和二硫键是蛋白质中影响其功能特性的重要官能团。温度、压力以及pH 的改变都会引起二硫键的断裂和巯基的变化,从而引起蛋白质构象的变化。由图3 可知,与crude 组相比,LT 组的肌浆蛋白总巯基含量显著提高(P<0.5),由 50.36 nmol/mg 提升到147.36 nmol/mg;而当升高浓缩温度时,HT 组表现出的蛋白质总巯基含量低于LT 组,说明在35 ℃浓缩的状态下,漂洗水中肌浆蛋白总巯基含量增加,而当浓缩温度为65 ℃时,漂洗水中肌浆蛋白总巯基含量显著降低。这可能是因为经受较高温度的肌浆蛋白的构象变化导致SH 基团的暴露并通过氧化SH 基团或二硫化物交换形成二硫键,此结果与Sankar 等[18]的研究结果一致。
当鱼糜漂洗水经过调节极端pH 值处理时,肌浆蛋白的总巯基含量显著低于crude 组(P<0.5),而LT和HT 两组经过极端pH 值处理后,其对应的蛋白质总巯基含量也显著降低,说明经过调节极端pH 值处理后,可降低鱼糜漂洗水中肌浆蛋白总巯基含量,这可能是因为调节pH 值的过程中肌浆蛋白的结构发生了改变,导致巯基暴露氧化,从而使总巯基含量降低。Wang 等[19]等研究指出当蛋白质pH 酸性调回中性时,蛋白质不能完全重折叠使得其结构发生改变,巯基暴露从而使巯基更容易氧化成二硫键。
2.4 不同回收方法对鱼糜漂洗水中肌浆蛋白表面疏水性的影响
不同回收方法对鱼糜漂洗水中肌浆蛋白的表面疏水性的影响如见图4。
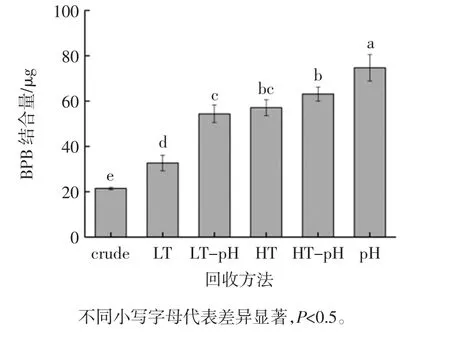
图4 不同回收方法对鱼糜漂洗水中肌浆蛋白表面疏水性的影响Fig.4 Effects of different recovery methods on the hydrophobicity of sarcoplasmic protein surface in fish mince wash water
蛋白质的表面疏水性反映的是蛋白质分子表面疏水性氨基酸的相对含量,以溴酚蓝可结合的疏水性氨基酸残基的量来表示[20]。由图4 可知,肌浆蛋白经过加热和调节pH 值处理都能增加其表面疏水性。LT 组蛋白质轻微变性,蛋白质结构展开,暴露疏水区域导致表面疏水性与crude 组相比显著增加(P<0.5),HT组比LT 组处理剧烈,从而使蛋白质变性程度增强,因此HT 组的表面疏水性显著高于LT 组和crude 组(P<0.5)。pH 组的表面疏水性为21.46 μg 显著高于crude组的表面疏水性 74.73 μg(P<0.5),这可能是由于表面带有净正电荷的蛋白质在静电排斥的作用下使蛋白质分子展开,从而导致包裹在其内部的疏水基团和疏水残基暴露在表面,进而使得表面疏水性增加,此结果与王伟等[21]的研究结果一致。HT 组的表面疏水性为57.15 μg 低于pH 组的表面疏水性,可是是因为在65 ℃浓缩在这一过程中,通过蛋白质-蛋白质的相互作用导致蛋白质不断聚集,使暴露的疏水区域减少,导致其表面疏水性低于pH 组。
2.5 不同回收方法对鱼糜漂洗水中肌浆蛋白乳化性和乳化稳定性的影响
不同回收方法对鱼糜漂洗水中肌浆蛋白乳化性和乳化稳定性的影响见图5。

图5 不同回收方法对鱼糜漂洗水中肌浆蛋白乳化性和乳化稳定性的影响Fig.5 Effects of different recovery methods on emulsification and emulsion stability of sarcoplasmic protein in fish mince wash water
当鱼糜漂洗水经过不同回收方法处理时,肌浆蛋白分别发生不同程度的变性,处理越剧烈变性程度越高,因此使其乳化性与乳化稳定性发生不同程度的升高。当鱼糜漂洗水经过35 ℃浓缩时,肌浆蛋白轻微变性,其乳化性为8.16 m2/g 与crude 组相比差异显著(P<0.05),HT 组乳化性为 11.49 m2/g,乳化性与 crude 组和LT 组相比乳化性差异显著(P<0.5)。热处理会改善蛋白质的乳化性可能是由蛋白质变性引起的,通过升高温度破坏改变蛋白质构象(范德华相互作用、氢键和静电力)从而暴露一些疏水残基,改变蛋白质分子的亲水亲油平衡从而提高乳化性与乳化稳定性。经pH值处理后,蛋白结构解折叠,疏水性氨基酸侧面暴露增加,从而使肌浆蛋白乳化性能大大提升,使LT-pH组和HT-pH 组的乳化性与LT 和HT 组的乳化性相比分别提升了 3.82 m2/g 和 2.61 m2/g,而 pH 组与 crude 组相比乳化性由5.19 m2/g 提升到17.65 m2/g,乳化稳定性由30.33%提升高53.59%。Jiang 等[22]发现大豆蛋白再经过pH 变换处理后,保持了原有的二级结构和整体的紧凑性,但失去了一些三级结构体,这些结构的改变导致乳化性的显著改善,与本试验结果一致。
2.6 不同回收方法对鱼糜漂洗水中肌浆蛋白热稳定性的影响
不同回收方法对鱼糜漂洗水中肌浆蛋白热变性温度的影响见图6。

图6 不同回收方法对鱼糜漂洗水中肌浆蛋白热稳定性的影响Fig.6 Effect of different recovery methods on thermal stability of sarcoplasmic protein in fish mince wash water
蛋白质的热变性过程可以看作是温度的动态函数。蛋白质在热变性过程中,吸收热量时由一个有序状态变为无序状态,破坏了分子内的相互作用,致使多肽链展开。当达到蛋白质的变性温度时,在热分析图谱上会出现一个吸热峰,由图6 可看出所有回收蛋白质都有一个主要的吸收峰,代表了各组回收蛋白质的热变性温度点。crude 组蛋白质热变性温度为37.41 ℃,表明该使蛋白质在较低的温度下就会发生热变性。LT 组蛋白质热变性温度为75.52 ℃,HT 组蛋白质热变性温度为77.81 ℃,鱼糜漂洗水在加热浓缩处理时,肌浆蛋白已经在35 ℃和65 ℃的条件下发生了结构的改变,在用差示量热扫描法测定其热变性温度时,比未经处理过的肌浆蛋白crude 组温度要有所升高。李晓龙等[23]也发现热处理会引起蛋白质分子二级结的等发生变化,导致蛋白质聚集交联最终引起功能特性的改变。肌浆蛋白经pH 值调节回收,表面携带了大量的净正电荷,需要更高的温度去克服静电作用,因此与LT 组相比,经过调节pH 值的肌浆蛋白过出现了热变性温度有所升高的现象,而HT 组回收蛋白质已经由于加热浓缩导致变性,从而使pH 组蛋白质变性温度低于HT 组蛋白质的变形温度。此结果与Tadpitchayangkoon 等[24]研究结果一致。
3 结论
5 种回收蛋白质与crude 相比均使肌浆蛋白在酰胺I 带的波数向短波移动,对其所对应的蛋白质二级结构也有所影响,使α-螺旋和β-折叠的含量呈下降趋势,而无规则卷曲的颔联呈上升趋势;对应着微观结构可发现,crude 组蛋白质表面结构平整,随着回收方法的不同其表面结构破坏程度不同,这与其无规则卷曲结构的相对含量是对应的,肌浆蛋白的无规则卷曲结构的相对含量越高,微观结构破坏越严重。
LT、LT-pH 和HT 回收可使肌浆蛋白的总巯基含量升高,其中LT 组升高的最多,从50.36 nmol/mg 提升到147.36 nmol/mg;这几种回收方法均可使肌浆蛋白的表面疏水性、乳化性及乳化稳定性有所提升,其中pH 组提升的最多,表面疏水性由21.46 μg 提升到74.73 μg,乳化性由 5.19 m2/g 提升到 17.65 m2/g,乳化稳定性由30.33%提升高53.59%;HT-pH 热变性温度提升了最多,由37.41 ℃提高到108.28 ℃。
