不同熟化处理方式及多酚类物质对马铃薯全粉消化特性的影响
2020-04-28李铁梅王玺段盛林闫晨苗苑鹏林静崔立柱夏凯刘美玉1
李铁梅,王玺,段盛林,,闫晨苗,苑鹏,林静,崔立柱,夏凯,刘美玉1,
(1.河北工程大学,河北 邯郸 056038;2.功能主食创制与慢病营养干预北京市重点实验室,北京 100015;3.中国食品发酵工业研究院有限公司,北京 100015)
马铃薯是全球公认的全营养食品,富含蛋白质、膳食纤维、维生素及矿物质等人体所需的营养成分,且产量较高[1]。2015年1月,我国农业部正式启动马铃薯主粮化战略,把马铃薯加工成馒头、面条、米粉等主食,马铃薯成为稻米、小麦、玉米外的第四大主粮[2]。推动马铃薯主食产业发展需要创新科技为引领,开发出适合我国居民消费习惯的马铃薯主食产品,能极大地丰富我国居民的膳食营养结构,满足人体对营养配比的需要[3-4]。
目前,我国马铃薯的食用方式以鲜食为主,马铃薯用于加工的比例仍很低,不仅加工产品的种类少,而且加工产品的深度不够,马铃薯的固有优势没有发挥出来,附加值有待提高[5]。马铃薯加工产品主要包括四大类:马铃薯食品(片、条、泥等)、粉条和粉丝、淀粉(包括变性淀粉)及全粉[6]。马铃薯全粉的生产制作过程主要包括清洗、去皮、切片、漂洗、预煮、冷却、蒸煮、捣泥等生产工艺,再经脱水干燥制得[7-8]。干燥方式主要有气流干燥、烘箱干燥、滚筒干燥、对撞流干燥等,较大程度地保持马铃薯果肉的组织细胞不被破损。马铃薯干燥制粉后,能够保留大部分营养物质,复水速度快且复水后具有鲜薯的风味和口感,具有营养全面和易于贮存的特点[9],更便于添加至冲调餐包、挤压工程米、面包等产品中,应用范围广范。马铃薯全粉中淀粉含量占65%~80%,且主要是支链淀粉,易糊化,且易于人体吸收[10],蛋白质含量高达10%,而且脂肪含量也很低,符合当今的时尚消费观-低脂肪、高蛋白。食物中的淀粉与血糖生成指数(glycemic index,GI)直接相关,GI 是主食营养干预的指标之一,其概念由加拿大学者Jenkins 等提出,主要指含50 g 可利用的碳水化合物的食物与葡萄糖或含等量碳水化合物的白面包在2 h 内人体血糖反应曲线下面积百分比值[11]。根据食物GI 值的高低,可将食物分为低GI(GI <55)、中GI(55 < GI < 70)和高 GI(GI > 70)[12]。食用低 GI 的食物可以在一定程度上辅助治疗心血管疾病、糖尿病等慢性病。根据淀粉在人体的消化快慢,可将淀粉分为快消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS) 和抗性淀粉(resistant starch,RS)。研究表明,SDS 和 RS 含量高的食物具有较低的GI 值,降低食物的GI 值的方法如增加食物中抗性淀粉含量、添加多酚等方式,从而可以应用于糖尿病患者的保健食品开发。RS 是淀粉糊化后在冷却或储存过程中部分重结晶而形成,其在小肠中不能被消化,但在结肠中可被大肠菌群发酵利用的淀粉及其降解物[13],存在于冷米饭、油炸土豆片、冷面包中。高RS饮食与低RS 饮食相比,具有较少的胰岛素反应,这对糖尿病患者餐后血糖值有很大影响,尤其对于非胰岛素依赖型病人,经常摄食高RS 食物,可延缓餐后血糖上升,将有效控制糖尿病病情[14],目前国内外RS 的制备以回生淀粉(RS3)的制备为多,制备方法主要有:热压处理法、脱支法(酸解-热液处理和酶法)、蒸汽加热法及各种方法的结合,如热压-脱支法。其基本原理都是通过改变淀粉颗粒、内部结晶、分子结构或改变颗粒内部淀粉链的排列状况,降低部分长链淀粉分子的链长,使淀粉的性能发生改变[15-16]。此外与淀粉消化密切相关的酶是ɑ-葡萄糖苷酶,主要参与体内淀粉等糖类物质的消化,抑制其活性可以减缓碳水化合物的降解速率[17-19]。多酚类化合物能够抑制α-淀粉酶和α-葡萄糖苷酶的活性,调节糖、脂代谢[20],从而达到控制血糖水平的作用。郭雅靖等[21]的研究表明,葡萄籽与高粱麸皮原花青素对α-淀粉酶和α-葡萄糖苷酶的抑制活性相对较强,能够减缓食物的酶解进程,避免餐后血糖急剧升高,从而实现糖尿病预防和辅助治疗的作用。
目前对淀粉的消化特性研究比较多,闫巧珍等发现马铃薯全粉相比于小麦粉和米粉具有较高的消化速度[22-24],在如何降低马铃薯全粉的消化特性方面研究的比较少。因此本文通过研究不同熟化处理方式对马铃薯全粉中抗性淀粉含量的影响,及其与多酚复合后对马铃薯熟全粉消化特性的影响,从而为低GI 原料粉的处理方式提供借鉴,同时为低GI 马铃薯产品的开发奠定基础。
1 材料与方法
1.1 材料与试剂
白面包:自制;马铃薯(中薯13 号):乐陵希森马铃薯产业集团有限公司;茶多酚、绿原酸、原花青素(纯度≥98%)、4-硝基苯-ɑ-D-吡喃葡萄糖苷(4-nitrophenyl-indole-D-glucopyranoside,pNPG):北京索莱宝科技有限公司;磷酸氢二钠、磷酸二氢钠、浓盐酸、氯化钠、氯化镁、氯化钙、碳酸钠、瓜尔豆胶:北京化工厂;胰酶(pancreatin P3292,300 U/mL)、淀粉葡萄糖苷酶(amyloglucosidase A7095,≥260 U/mL)、胃蛋白酶(pepsin P7000,≥250 U/mL):Sigma 公司;乙腈、甲醇(色谱纯):美国迈瑞达公司;95%乙醇:国产分析纯。
1.2 仪器与设备
PL203 分析天平:梅特勒-托利多仪器有限公司;DK-8D 三温三控水槽:上海博讯实业有限公司医疗设备厂;GL-20G-Ⅱ型高速冷冻离心机:上海安亭科学仪器厂;Spectra Maxi3 酶标仪:美国 MD 公司;LC-20AT高压液相色谱仪、RID-10A 示差折光检测器:日本岛津公司;KQ-250DE 数控超声波清洗器:昆山市超声仪器有限公司;SEC-P 发酵箱、SEC-1Y-S 电烤箱:江苏三麦机械有限公司;DCK202 搅拌机:广东顺德地一日用电器科技有限公司;CPC202C 电子天平:奥豪斯仪器(上海)有限公司;DHG-9145 型电热鼓风干燥箱:上海一恒科技有限公司。
1.3 试验方法
1.3.1 不同处理方式的马铃薯全粉中抗性淀粉含量测定
1.3.1.1 样品处理
对照组:马铃薯经过清洗、去皮,然后切片处理,沸水浴中漂烫2 min~3 min 后,放入蒸煮锅上层蒸煮15 min~20 min,于 60℃烘箱内热风干燥 6 h~7 h,粉碎过100 目筛,即得到成品马铃薯全粉。
样品组:
1)马铃薯经过清洗、去皮、切片处理后,沸水浴中漂烫2 min~3 min 后,放入蒸煮锅上层蒸煮15 min~20 min,之后将马铃薯片冷却到室温,分别置于4 ℃冷藏 12、24、48 h,于 60 ℃烘箱内热风干燥 6 h~7 h,粉碎过100 目筛,分别得到3 个样品粉。
2)超声处理:马铃薯经过切片处理后,放入蒸煮锅中蒸煮 15 min~20 min 后,冷却至室温(25 ℃)后,置于4 ℃冷藏 12 h,然后超声(250 W,80 min),将样品冷却到室温(25 ℃)后,再次置于 4 ℃冷藏 24 h,于 60 ℃烘箱内热风干燥6 h~7 h,粉碎过100 目筛,得到第4 个样品粉。
1.3.1.2 抗性淀粉含量测定
采用AOAC-DNS 法测定抗性淀粉含量,准确称取100 mg 样品于50 mL 离心管,每个试管中加入4 mL溶液2(溶液1:淀粉葡萄糖苷酶(amyloglucosidas,AMG) 稀释:2 mL 淀粉葡萄糖苷酶(amyloglucosidas,AMG)用顺丁烯二酸钠缓冲溶液稀释至22 mL。溶液2:100 mL 顺丁烯二酸钠缓冲液加上1 g 胰酶,搅拌5 min,加入 1 mL 溶液 1,混匀,1 500 r/min 离心 10 min,慢慢倒出上清液,盖紧试管盖,用振荡器混匀)。连续振荡,37 ℃孵育16 h,离心管中加入4 mL 无水乙醇(99%)1 500 r/min,离心 10 min,小心倒出上清,重复上述悬浮和离心。将离冰心管然后向每个试管中加入8 mL 1.2 mol/L 醋酸钠缓冲液(pH3.8),用磁力搅拌机搅拌,混匀,立即加入0.1 mLAMG(溶液1),混匀,并放入50 ℃水浴30 min。对于抗性淀粉含量<10%的样品,将处理后的溶液直接离心(1 500 r/min,10 min),对于抗性淀粉含量>10%的样品,根据抗性淀粉含量定容溶液,取少量溶液离心(1 500 r/min,10 min),用 DNS测定还原糖含量,从而求得抗性淀粉含量。取1 mL 上清液于15 mL 离心管,加入1 mL 蒸馏水和5 mL DNS,离心管摇匀,沸水浴5 min,冷却,蒸馏水定容15 mL,测其各溶液吸光度,利用标准曲线得出葡萄糖含量,根据下列公式计算抗性淀粉含量。

式中:M 为葡萄糖含量,g;W =分析样本的干质量=质量×(100-含水量)/100,g;V 为待测液体积,mL。
1.3.2 多酚-马铃薯复合粉对α-葡萄糖苷酶抑制率测定
1.3.2.1 多酚马铃薯复合粉样品制备
准确称取250 mg 马铃薯全粉分别于离心管,分别按照马铃薯全粉质量的2%称取原花青素、茶多酚、绿原酸3 种多酚各5 mg,加入5 mL 的去离子水,样品在 95 ℃下糊化 20 min,室温(25 ℃)放置 15 min,放入-80 ℃冰箱预冻后,冷冻干燥,样品磨碎过100 目筛,得到3 种多酚马铃薯复合粉样品。
1.3.2.2 α-葡萄糖苷酶抑制率测定
参考金吉淑等[25]方法,测定3 种食源多酚对α-葡萄糖苷酶活性的抑制率,将3 种多酚马铃薯复合粉制成5 mg/mL 溶液,试验步骤见表1,以4-硝基-α-D-吡喃葡萄糖苷(pNPG)为底物测定3 种多酚与马铃薯复合物对α-葡萄糖苷酶的抑制作用,反应体系由α-葡萄糖苷酶(40 U/mL,100 μL)、抑制剂 400 μL,混合后置于恒温振荡器中(37 ℃,150 r/min)反应 10 min,再加入 4-硝基-α-D-吡喃葡萄糖苷(pNPG)(100 μL,20 mmol/L),然后继续反应30 min,以5 mL 0.1 mol/L Na2CO3终止反应。使用酶标仪在405 nm 处测其吸光值 A1、A2、A3、A4,每个试验平行测定 3 次。按下列式计算多酚对α-葡萄糖苷酶抑制率。半抑制浓度(IC50)定义为抑制50%α-葡萄糖苷酶酶活性所需的样品量。
α-葡萄糖苷酶抑制率/%=[1-(A3-A4)/(A1-A2)]×100
式中:A1为空白管吸光度值;A2为空白对照管吸光度值;A3为抑制剂管吸光度值;A4为背景对照管吸光度值。
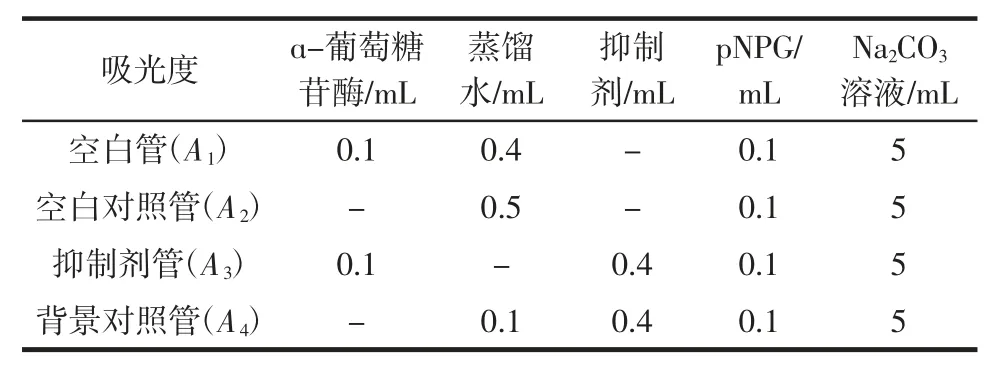
表1 α-葡萄糖苷酶抑制作用测定方案Table1 Determination of α-glucosidase inhibition by three polyphenols
1.3.3 原花青素-马铃薯全粉的体外消化性测定
1.3.3.1 样品制备
白面包基础配方:小麦粉200 g,黄油32 g,酵母3 g,食用盐 1.96 g,鸡蛋 21 g,水 98 g。
1.3.3.2 试验分组
试验分为5 组:白面包组,马铃薯全粉(未处理),马铃薯全粉(24 h 冷藏处理),马铃薯全粉(24 h 冷藏处理)+2 mg 原花青素,马铃薯全粉(未处理)+2 mg 原花青素。每组3 个平行,每个平行均称取含有1 g 可利用碳水化合物的样品,进行体外消化。
1.3.3.3 体外消化
1)口腔模拟
取含1 g 可利用的碳水化合物的各样品组放入一烧杯中,加入3 mL 0.1 mol/L 的磷酸缓冲液和1 mL 预先加热到37 ℃的淀粉酶,用研钵棒轻轻上下敲打15 次后(或 15 s)(保持在 37 ℃的环境中)[26]。
2)胃部模拟
用4 mL 0.1 mol/L 的磷酸缓冲液冲洗研钵棒,分别加入 2.4 g 浓度为 0.4 g/L 的 NaCl 溶液、0.05 g 胃蛋白酶和 0.05 g 瓜尔豆胶及 3.6 g 酸缓冲液(0.1 mol/L),利用2 mol/L HCl 溶液调到pH 1.5,放入3 颗~5 颗玻璃球,然后放在37 ℃摇床中保温30 min。
3)小肠模拟
将 10 mL 磷酸缓冲液(pH 6.9,0.5 mol/L)加入到上述溶液中,利用50%的NaOH 溶液调节pH 值为6.9;然后加入 125 μL MgCl2-CaCl2溶液、125 μL 胰酶溶液、400 μL 淀粉转葡萄糖苷酶,补充蒸馏水至50 mL,在37 ℃摇床中保温120 min。不同时间取1 mL 样品放入含有4 mL 95 %的乙醇溶液中(预热至60 ℃),沸水浴灭酶后自然冷却,10 000 r/min 离心10 min,上清过0.45 μm 微孔滤膜后进行高效液相色谱,进行葡萄糖含量测定。
1.3.3.4 HPLC 法测定葡萄糖的含量
色谱条件:Hypersil NH2S 氨基色谱柱(4.6 mm×250 mm,5 μm);柱温 40 ℃;流动相为乙腈∶水=70∶30(体积比);流速为1.0 mL/min;进样量为10 μL。
1.4 数据统计分析
每个试验重复3 次,结果表示为(平均值±标准差)。用SPSS20 和Excel2003 处理试验数据并作图,方差分析采用Duncan 检验进行分析,P<0.05 表示差异显著。
2 结果与分析
2.1 不同处理方式的马铃薯全粉对抗性淀粉含量影响
采用不同熟化处理方式制备马铃薯全粉,测定马铃薯切片蒸煮后,超声结合冷藏处理12 h 及直接冷藏处理 12、24、48 h 后的结果如图1所示。
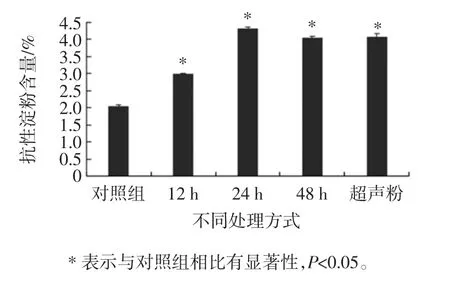
图1 不同处理方式对马铃薯全粉中抗性淀粉含量的影响Fig.1 Effect of different treatments on the content of resistant starch in potato
对照组抗性淀粉含量为(2.046±0.035)%,直接冷藏处理24 h 处理的马铃薯全粉淀粉含量最高,为(4.32±0.044)%。其它熟化处理方式与对照组相比,都具有显著性(P<0.05)。超声处理的马铃薯全粉与直接冷藏处理的48 h 相比变化不显著(P>0.05),因此最终选用直接冷藏处理24 h 处理得到的马铃薯全粉。抗性淀粉会进一步影响人体的脂肪代谢及糖类代谢,从而有效降低胆固醇、控制糖尿病。抗性淀粉主要是经过糊化、冷却以后重结晶形成。经过24 h 处理的马铃薯全粉抗性淀粉含量最高,再经过48 h 处理后,抗性淀粉含量变化不明显,与直接冷藏处理12 h 的马铃薯全粉相比变化不显著(P>0.05),可能是马铃薯全粉冷却一定时间,抗性淀粉含量达到顶峰,之后趋于饱和。
2.2 不同多酚-马铃薯复合粉对α-葡萄糖苷酶的抑制作用
3 种植物多酚和马铃薯全粉复合测其对α-葡萄糖苷酶抑制作用,并以未添加的马铃薯全粉为对照,如图2 所示。

图2 马铃薯与不同多酚复合对α-葡萄糖苷酶抑制作用Fig.2 Inhibition of α-glucosidase by potato and different polyphenols
原花青素-马铃薯复合粉组对α-葡萄糖苷酶抑制率显著高于其它组,其次为茶多酚-马铃薯复合粉组,最高为(43.01±2.24)%,显著高于对照组(23.87±2.54)%,而绿原酸-马铃薯复合粉具有一定抑制作用,与Karim等[27]发现绿原酸抑制α-淀粉酶的活性,从而抑制马铃薯淀粉的消化试验的结果相似。控制餐后血糖浓度是预防或治疗患者高血糖最有效的方法,而来自于天然产物提取液中的天然α-葡萄糖苷酶抑制剂在降低患者餐后血糖浓度中扮演重要的角色。研究表明,α-葡萄糖苷酶的活性与餐后血糖浓度呈正相关,其活性越高,餐后血糖浓度越高,寻找活性高、毒性低,来源于天然植物的α-葡萄糖苷酶抑制剂成为当前研究与治疗二型糖尿病药物的主要方向之一[28-29]。研究结果可知,原花青素-马铃薯复合粉对α-葡萄糖苷酶抑制效果显著,为糖尿病人群功能食品的研发提供依据。
原花青素-马铃薯复合粉和马铃薯全粉体外对ɑ-葡萄糖苷酶的半数抑制浓度(IC50)见图3。
由图3 测得马铃薯全粉对α-葡萄糖苷酶的IC50为34.35 mg/mL,马铃薯全粉与原花青素对α-葡萄糖苷酶的IC50为26.35 mg/mL,IC50值越小,抑制α-葡萄糖苷酶活性的能力越强,则原花青素-马铃薯复合粉对α-葡萄糖苷酶抑制能力明显高于马铃薯全粉。结果证实原花青素-马铃薯复合粉对α-葡萄糖苷酶抑制有一定作用。
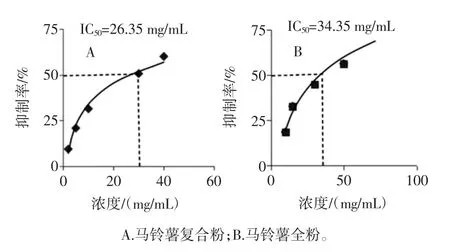
图3 原花青素-马铃薯复合粉和马铃薯全粉体外对ɑ-葡萄糖苷酶的半数抑制浓度(IC50)Fig.3 Half-inhibitory concentration(IC50)of proanthocyanidinpotato compound powder and potato whole powder against indoleglucosidase in vitro
2.3 原花青素-马铃薯全粉消化性能测定
2.3.1 葡萄糖标准曲线的绘制
绘制浓度与峰面积的标准曲线,结果显示,在0~10 mg/mL 的葡萄糖和对应的峰面积之间存在很好的线性关系,两者之间的标准曲线方程为:Y=60 702X-12 188(R2=0.999 6)。
2.3.2 不同处理方式的马铃薯全粉对GI 影响
以葡萄糖的标准曲线为基础,对24 h 冷藏处理的马铃薯全粉、原花青素-马铃薯(24 h 冷藏处理)复合粉、未处理的马铃薯全粉原花青素-马铃薯(未处理)复合粉体外消化过程中淀粉水解率的变化进行检测。根据淀粉水解率和酶解时间关系图,模拟方程,计算曲线面积。定义面包的水解率为100,计算样品的水解率,按照 GI 与 HI 的关系式:GI=0.862HI+8.189 计算样品的GI。分为未处理的马铃薯全粉、原花青素-马铃薯(未处理)复合粉、24 h 冷藏处理马铃薯全粉、原花青素-马铃薯(24 h 冷藏处理)复合粉4 个试验组,白面包为对照组。不同处理方式的马铃薯全粉的GI 值见图4。

图4 不同处理方式的马铃薯全粉的GI 值Fig.4 GI values for potato flour in different treatments
由图4 可得,其它处理方式的马铃薯全粉及复合粉与白面包组相比均具有显著性差异(P<0.05),原花青素-马铃薯(24 h 冷藏处理)复合粉的GI 值最低,经计算得知,白面包组GI 值为94.4,24 h 处理的马铃薯全粉GI=57.2,原花青素-马铃薯(24 h 冷藏处理)复合粉GI=52,未处理的马铃薯全粉GI=84.3,原花青素-马铃薯(未处理)复合粉GI=76.1,根据国际食品GI 的分类,则原花青素-马铃薯(24 h 冷藏处理)复合粉属于低GI 食品,未处理的马铃薯全粉和原花青素-马铃薯(未处理)复合粉属于高GI 食品,24 h 处理的马铃薯全粉属于中GI 食品。以上结果表明由于24 h 处理的马铃薯抗性淀粉含量偏高,其不被人体小肠消化吸收,因此其GI 值相比未处理的马铃薯全粉相比具有显著性差异(P<0.05),原花青素-马铃薯(24 h 冷藏处理)复合粉GI 值最低说明加入原花青素可以有效抑制因摄入可溶性碳水化合物而导致的血糖升高,十分适合糖尿病人食用。
3 结论
以未冷藏及超声处理的马铃薯全粉作为对照组,测定不同熟化处理方式(马铃薯切片蒸煮后,直接冷藏处理12、24、48 h 及超声结合冷藏处理12 h)制备的马铃薯全粉中抗性淀粉含量,结果从高到低为:24 h 处理的马铃薯全粉>超声处理>48 h 处理的马铃薯全粉>12 h 处理的马铃薯全粉>未处理的马铃薯全粉。将直接24 h 冷藏处理的马铃薯全粉分别与3 种多酚进行孵育,制得3 种多酚-马铃薯复合粉,测其对ɑ-葡萄糖苷酶抑制作用的影响,其中原花青素-马铃薯复合粉对ɑ-葡萄糖苷酶抑制作用最好,抑制率达(43.01±2.24)%,其次为茶多酚,抑制率为(32.22±4.98)%,显著高于对照组(23.87±2.54)%,而绿原酸抑制率反而低于对照组,提高了ɑ-葡萄糖苷酶活性。进一步对不同马铃薯全粉样品进行体外消化试验测定,确定不同样品GI 值之间的差异,结果表明原花青素-马铃薯(24 h 冷藏处理)复合粉的GI 值最低,为52,与对照组GI 值94.4(高GI 产品)相比,属于低GI 产品。综上所述,通过冷藏及与原花青素共孵育处理的方式,能够降低马铃薯全粉的GI 值,具有减缓血糖快速升高的作用,为开发适合糖尿病、肥胖等人群食用的低GI 马铃薯食品奠定了基础。
