一氧化氮影响植物不定根发生的研究进展
2020-04-28李维芳王春蕾邓雨正姚彦东魏丽娟廖伟彪
李维芳,王春蕾,王 妮,邓雨正,姚彦东,魏丽娟,廖伟彪
(甘肃农业大学 园艺学院,甘肃 兰州 730070)
一氧化氮(nitric oxide,NO)是一种水溶性和脂溶性的气体小分子,作为一种重要的信号分子,一直是生命科学领域研究的热点。NO在打破种子休眠[1]、抑制下胚轴伸长[2]、延缓叶片衰老[3]、缓解非生物胁迫[4]等方面发挥着重要的作用。
不定根是由非根组织形成的根,由分化的细胞发育而来[5]。不定根的发生主要有诱导阶段、启动阶段和表达阶段等三个阶段[6]。诱导阶段包括不定根起源细胞响应内外刺激,水解淀粉转化为葡萄糖为启动阶段提供能量,在该阶段PrSCL1和PrSHR基因表达显著上调,参与下胚轴不定根的诱导[7]。启动阶段包括起始细胞开始分裂形成分生组织及根原基,启动阶段划分5个部分:(1)建立不定根表皮-内皮层、中柱和根冠起始细胞;(2)起始细胞通过平周分裂形成不定根表皮、内皮层和中柱;(3)内皮层通过平周分裂形成皮层;(4)根冠起始细胞通过平周分裂形成柱细胞,不定根原基的穹顶状结构建成;(5)中柱基部的细胞伸长(图1)[8]。在拟南芥中,形成层及其周围薄壁细胞中积累的生长素诱导基因WOX11(WUSCHELRelatedHomeobox11)和WOX12的表达会上调LBD16(Lateralorganboundariesdomain16)和LBD29基因表达,从而介导形成层细胞转变为不定根起始细胞,之后再转变为不定根原基细胞[9]。表达阶段包括不定根原基生长突破表皮层,新形成的不定根与维管束相连。在表达阶段,OsCAND1通过参与不定根原基生长素信号维持G2/M细胞周期的转化来控制不定根的伸长[10]。OsWOX11与ERF3互作增强细胞分裂素信号通路,从而促进不定根的伸长[11]。在植物正常生长过程中,不定根的形成是植物正常发育的一部分,是自然发生的。对于大多数单子叶植物而言,不定根是植物主要的根系统,而在许多双子叶植物中,不定根的形成是通过生殖生长来完成的[5]。此外,植物茎或叶受到胁迫或激素等影响也可以产生不定根[12]。而且,不定根是植物吸收水分、营养元素以及存储同化物的重要器官[13]。在营养繁殖以及利用无性繁殖获取优良品种[14]等方面都有不定根的参与。因此,不定根的研究对调节植物生长发育有很重要的意义。
目前关于NO在植物(如万寿菊[15-16]、黄瓜[17-19]、绿豆[20]等)不定根发生中的作用已有较多报道。研究表明,NO对植物不定根发生起到了非常重要的作用。因此,本文主要对植物中NO的生物合成途径以及不定根形成过程中NO发挥的作用进行系统的回顾和总结,以期对NO的生物合成途径和NO在植物不定根中的作用有一个更深的理解。
1 NO在植物体中的产生
在植物体内NO的产生是一个相对复杂的过程,目前对NO产生途径的研究相当有限。现在普遍认为,在植物体内NO的合成途径主要有两种:酶促合成途径和非酶促合成途径[21](表1)。但是,目前这两个种途径中的一些酶的作用和氧化还原机理需要进一步验证和研究。本文结合最近几年有关NO在植物体中产生途径的研究进行阐述。
1.1 酶促合成途径
1.1.1 硝酸还原酶(nitrate reductase, NR)途径
NR途径是由硝酸还原酶催化的NO合成途径。硝酸还原酶存在于绿藻和种子植物的细胞溶胶[22],被认为是植物体中产生NO最主要的途径[23]。在拟南芥保卫细胞中首次发现NR是由NIA1和NIA2同源基因编码[24]。通过对个体和突变体的比较研究发现,在不同的植物组织中NO的合成量不同[25-26]。NR是以烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADH)为电子供体,主要催化硝酸盐还原为亚硝酸盐[27],也可以催化亚硝酸盐还原为NO。该反应需要少量的氧自由基、光照和高浓度的亚硝酸盐。但是,这种反应的效率很低[28],仅为硝酸盐还原的1%[23]。而且,在低氧环境中需要亚硝酸盐水平超过天然硝酸盐底物水平[29]。此外,NR可通过调节电子流直接调控催化亚硝酸盐生成NO的过程,或者通过影响亚硝酸盐浓度来间接控制NO产生[30]。
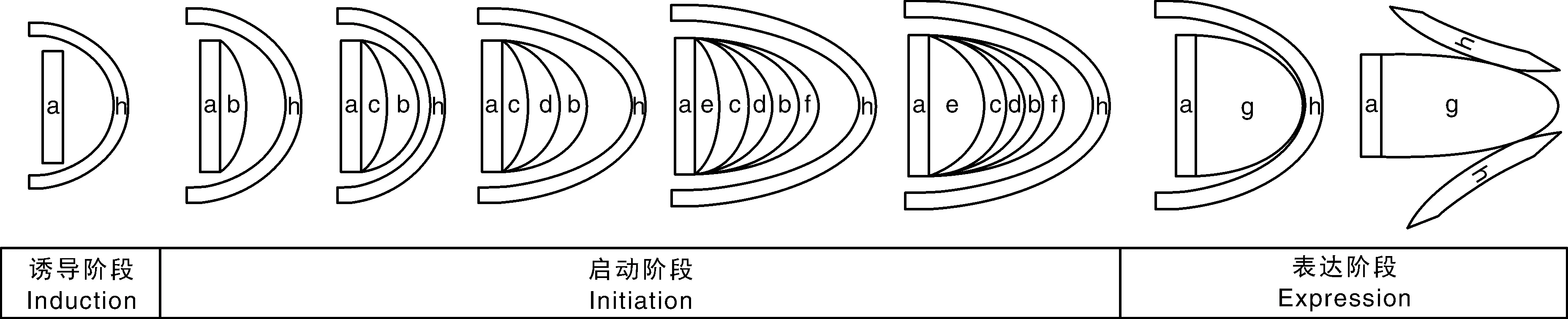
a,茎形成层;b,不定根表皮;c,内皮层;d,皮层;e,后生木质部;f,根冠分生组织;g,不定根原基;h,茎表皮。 a, Stem cambium; b, Adventitious root epidermis; c, Endodermis; d, Cortex; e, Metaxylem; f, Root cap meristem; g, Adventitious root primordium; h, Stem epidermis.图1 植物不定根的形成过程Fig.1 The formation of adventitious roots in plants
1.1.2 NO合酶(nitric oxide synthase, NOS)途径
NOS途径首先是在哺乳动物中发现的。在哺乳动物中,NO是通过NO合酶(NOS)的氧化机制合成的,NO合酶有内皮细胞NOS(endothelial eNOS)、神经细胞NOS(neuronal nNOS)和诱导型NOS(inducible NOS,iNOS)三种类型[31]。Crawford等[32]在拟南芥中发现了一种名为AtNOS1的NOS编码基因,AtNOS1可能与NO的合成或积累有直接或间接的关系,所以有研究者建议将AtNOS1改为AtNOA1[32]。通过检测发现AtNOS1似乎具有将L-精氨酸 (L-Arginine, L-Arg)转化为L-瓜氨酸的能力,但是后来的研究者无法检测到由L-Arg转化为L-瓜氨酸[33]。在高等植物中纯化的AtNOS1蛋白可与L-Arg产生NO和瓜氨酸(表1),且动物NOS抑制剂显著降低了这种蛋白的活性[33]。因此,目前植物体中是否存在与哺乳动物NOS在结构上类似的基因还存在争议。研究发现,在高等植物中可能存在L-Arg、多胺或羟胺等被氧化生成NO的氧化机制[23]。而且可能发生在整个细胞环境中,包括细胞质、线粒体、叶绿体、过氧化物酶体和质外体[32]。后来,研究者在绿色鞭毛藻(Ostreococcuslucimarinus)中发现一种蛋白,该蛋白与哺乳动物的NOS有45%的相似性,该酶在体外表现出NOS活性,与动物NOS蛋白具有相似的性质[34]。因此,该蛋白被称为NOS-like酶。
1.1.3 其他酶促合成途径
在植物体中还存在其他NO的合成途径,黄嘌呤氧化还原酶(xanthine oxidoreductase,XOR)途径是植物体合成NO的一个重要途径。XOR分为黄嘌呤氧化酶(xanthine oxidase,XOD)和黄嘌呤脱氢酶(xanthine dehydrogenase,XDH),其主要形式是XOD,XDH只有30%[35]。XOR含有钼原子、黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)和两个铁硫氧化还原中心[36],XOR作为一种含钼酶,拥有低氧条件下催化亚硝酸盐还原为NO的能力[37](表1)。叶绿体中,在亚硝酸盐和还原性底物存在的条件下,XOR催化亚硝酸盐和还原性底物生成NO[38]。此外,Maia等[39]研究发现,氧气浓度的变化会微调XOR催化NO的生成,在FAD和氧气充足的条件下,XOR可产生超氧阴离子自由基进行细胞间的信息交流。
在烟草中发现的一种根特异性质膜结合亚硝酸盐NO还原酶(nitrite NO reductase,Ni-NOR)也可以催化底物合成NO。该酶利用细胞色素c作为体外电子供体催化烟草中的亚硝酸盐还原为NO[40](表1)。而且,Ni-NOR活性可能会受到氧气浓度的调控,但是Ni-NOR活性仅限于植物的根部[41]。后来,也有研究者认为Ni-NOR可能参与植物根的生长过程[42]。但是Ni-NOR的身份需进一步研究确定。
1.2 非酶促合成途径
在植物体中除了上述生物酶促途径合成NO以外,还可以通过非酶促途径合成。Cooney等[43]首先发现:在光照条件下,类胡萝卜素可与NO2反应,生成NO。后来,Wang等[44]发现酸性条件下,通过抗坏血酸(ascorbic acid,ASA)以及其他还原剂的作用,质外体可以释放NO(表1)。酸性条件下,赤霉素(gibberellic acid,GA)和脱落酸(abscisic acid,ABA)处理的大麦普通糊粉层中,还原剂可以将NO-2还原为NO[45](表1)。在缺氧或低氧条件下,植物的线粒体消耗NADH,将亚硝酸盐还原为NO[46](表1)。此外,羟胺类(R-NHOH)也可被超氧化物或H2O2氧化,在烟草细胞悬浮液中释放出NO[47](表1),因此,非酶促途径NO的合成可能与氮氧化物与植物代谢产物之间的化学反应以及酸性条件下亚硝酸根(NO-2)的氧化还原反应有关[48]。此外,水杨酸和H2O2可诱导伴生细胞产生NO[49],但是该氧化反应效率较低且反应的生理条件和作用都尚不清楚。
2 NO对植物不定根发生的影响
植物的生长发育、代谢等生命活动都是通过复杂的机制来协调完成的。植物不定根的发生也受到很多因素影响,如:光照[50]、水分[51]、营养物质[52]、机械胁迫[53]等因素都会影响不定根发生。而NO作为一种简单的气体分子,在植物中的作用受到了广泛的关注,尤其是在植物不定根发生中扮演着至关重要的角色。
2.1 植物不定根发生过程中NO的产生
NO处理绿豆下胚轴后,NO清除剂2-4-羧基苯基-4,4,5,5-四甲基咪唑啉-1-氧-3-氧化物钾盐(2,4-carboxyphenyl-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide, cPTIO)和NOS-Like抑制剂 NG-硝基1-氨甲酯(NG-nitro-l-Arg-methyl ester, L-NAME)处理都抑制了绿豆不定根发生[54],且检测发现内源NO减少。因此,在不定根中NO的产生可能通过NOS-Like途径来完成[54],后来Xuan等[55]在黄瓜下胚轴不定根发生中,使用 L-NAME和钨酸盐(Na2WO4)(NR抑制剂)探究NO的来源。发现L-NAME处理后的黄瓜幼苗中NO内源含量减少,因此,在不定根发生过程中产生的NO可能是NOS-Like途径合成的。而Na2WO4处理后的黄瓜幼苗NO含量没有显著变化。所以黄瓜不定根中NO的产生并非NR途径产生。但是,在向日葵不定根发生的研究中,NO产生有NOS和NR两种途径[56]。
2.2 NO调控不定根发生的机理
2.2.1 木质素参与NO调控的不定根发生
NO在调控不定根的发生过程中,木质素也在其中发挥着作用。NO供体硝普钠(sodium nitroprusside,SNP)浓度较低时可诱导绿豆不定根发生,同时增加总木质素含量,改变参与木质素生物合成的过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)和苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)的活性[57]。在SNP浓度较高的情况下,不定根发生和木质化下降[58]。利用清除剂cPTIO清除内源NO后,下胚轴不定根发生和木质素合成酶活性显著下降。这说明NO对根系木质化的促进作用可能与NO自身有关[57]。不定根发生过程中,NO引起木质素生物合成酶活性的变化导致木质素水平的变化,进而影响不定根的发生[57]。100 μmol·L-1SNP处理后的紫锥菊外植体内酚类化合物、黄酮类化合物和咖啡酸衍生物等次生代谢物的积累增加[58],而且相同浓度的SNP还可以增加超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(ascorbic acid peroxidase,APX)活性,进而诱导抗氧化防御[58]。
2.2.2 抗氧化酶参与NO调控的不定根发生
目前已知NO能缓解植物干旱胁迫[59]、盐胁迫[60]等非生物胁迫,而在植物生长发育过程中,非生物胁迫会对不定根发生产生影响。在镉胁迫下,NO可以缓解镉对绿豆下胚轴不定根的抑制作用,同时提高了内源NO水平和谷胱甘肽(glutathione,GSH)、ASA、多酚和脯氨酸(proline,Pro)的水平,降低了丙二醛(malondialdehyde,MDA)的含量[61]。POD、过氧化氢酶(catalase,CAT)、SOD和吲哚乙酸氧化酶(indoleacetic acid oxidase,IAAO)等抗氧化酶活性的提高可以逆转镉胁迫,说明NO调节抗氧化系统防止膜脂过氧化在不定根发生中的应激反应,缓解镉胁迫对不定根的抑制作用,进而促进绿豆不定根的发生[61]。在干旱胁迫下,NO可促进万寿菊不定根的发生,而且存在明显的剂量依赖效应[16]。此外,NO还能减轻干旱胁迫对叶肉细胞超微结构的破坏,同时提高叶片叶绿素的含量和下胚轴可溶性碳水化合物和蛋白质的含量,降低淀粉含量[16]。因此,在植物缓解非生物胁迫过程中,NO影响抗氧化酶活性进而调控植物不定根的发生。
表1 植物体内NO的合成途径
Table 1 Synthetic pathway of NO in plants

合成途径Synthetic pathway底物Substrate酶/反应条件Enzyme/reaction conditions基因Gene合成部位Site of synthesis参考文献Reference酶促合成途径NO-2NRNIA1、NIA2细胞质Cytoplasm[24]、[27]Enzymatic synthesisL-ArgNOSAtNOS1(AtNOA1)线粒体Mitochondria[31]pathwayL-ArgNOS-like—叶绿体Chloroplast[32-34]NO-2XOR—叶绿体Chloroplast[37]NO-2Ni-NOR—根部线粒体Mitochondria of root[41]非酶促合成途径NO-2光照Illumination—叶绿体Chloroplast[43]Non-enzymaticASC 缺氧Anoxia、H+质外体Apoplast[44]synthesis pathwaysNO-2H+、GA、ABA—糊粉层Aleurone layer[45]NO-2、NADH缺氧或低氧Hypoxia—线粒体Mitochondria[46]R-NHOHH2O2—未知Unknown[47]SAH2O2—伴胞Companion cell[49]
NR,硝酸还原酶;L-Arg,L-精氨酸;XOR,黄嘌呤氧化还原酶;Ni-NOR,亚硝酸盐NO还原酶;R-NHOH,羟胺;NOS,NO合酶;SA,水杨酸。
NR, Nitrate reductase; L-Arg, L-arginine; XOR, Xanthine oxidoreductase; Ni-NOR, Nitrite:NO reductase; R-NHOH, Hydroxylamine; NOS, Nitric oxide synthase; SA, Salicylic acid.
2.2.3 细胞周期基因参与NO调控的不定根发生
在植物不定根发生过程中,Xuan等[62]发现CsDNAJ-1可能接受生长素信号或周围刺激调节细胞分裂和分化。SNP处理后,黄瓜幼苗中CsDNAJ-1的基因表达上调[63],而且与观察到不定根的数目和长度相匹配,进一步添加NO清除剂和抑制剂后,该基因的表达受到抑制。因此,Zhu等[63]推测CsDNAJ-1在不定根发生过程中的表达可能需要NO的参与。细胞分裂伴随细胞周期的变化,CycA和CycB编码两种类型的细胞周期蛋白参与调控细胞分裂过程[63]。在Zhu等[63]的研究中,NO和富氢水(hydrogen rich water,HRW)处理可以上调黄瓜幼苗中CycA和CycB的表达,促进细胞周期中G1期到S期的转化。CDKA和CDKB基因的表达在NO和HRW处理后也出现不同程度上调。NO在HRW诱导的不定根发生中,NO通过CycA、CycB、CDKA、CDKB等基因的调控,促进细胞分裂,进而促进不定根的形成[62]。
3 一氧化氮与植物激素互作对植物不定根发生的影响
植物激素是植物自身产生的一类有机物,参与了植物全部的生长发育过程。目前,不定根发生过程中,植物激素参与的研究主要有吲哚-3-乙酸(indolebutyric acid,IAA)、乙烯 、萘乙酸(naphthylacetic acid,NAA)等物质。
3.1 NO与生长素
生长素启动了细胞分裂和原基形成过程,诱导细胞去分化形成顶端分生组织,所以生长素在不定根发生中的作用尤为重要,而生长素在不定根发生过程中往往有NO的参与。前人发现,SNP促进IAA缺失外植体不定根的发生,而NO特异清除剂cPTIO能抑制SNP的作用[64]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)作为诱导黄瓜不定根路径中与细胞分裂相关的酶,参与了NO和IAA促进黄瓜不定根发生的过程,而NO在该过程中激活MAPK起关键的作用(图2),该过程通过影响MAPK的活性促进黄瓜不定根发生[65]。在万寿菊中,吲哚丁酸(1H-indole-3-butanoic acid,IBA)能引起外植体内源NO和H2O2增加;阻断内源生长素运输后,外源NO、H2O2,IBA仍对不定根的发生有促进作用。在IBA诱导万寿菊不定根发生中,H2O2可能在NO的下游促进不定根的发生[15](图2)。SNP处理绿豆下胚轴时呈现明显的浓度依赖效应,低浓度处理促进不定根数增加,而超过一定的浓度后,不定根的根数随着SNP浓度的增加而减少。而且增加NAA处理后,NAA可以促进NOS途径中NO的产生,因此,SNP与NAA共同处理的效果要比单独处理显著,但加入cPTIO会显著抑制不定根的发生[20]。
褪黑素通过NO调控与生长素相关基因促进不定根的发生[66]。PIN1负责调控生长素转运,在NO存在的条件下,褪黑素促使生长素从下胚轴维管束细胞横向运输到中柱鞘细胞中促进不定根发生[67]。PIN3决定生长素流出的方向,控制生长素的不对称积累和差异生长,PIN3将生长素重新分配到中柱鞘细胞,同时在中柱鞘细胞中检测到累积的NO[68],所以PIN3的表达可能受到NO的调控。此外,褪黑素提高了PIN7的转录产物,从而促进下胚轴的伸长[66]。
3.2 NO与乙烯
作为一种气体植物激素,乙烯在植物体不定根发生中发挥着一定的作用。外源乙烯可以提高植物体内NR和NOS的活性,从而使内源NO产生增多[17]。另外,乙烯可提高与NR和NOS相关基因的表达量,增加黄瓜外植体内源NO的含量,而且乙烯可上调DNAJ-like基因(CsDNAJ-1)和钙依赖蛋白激酶(calcium-dependent protein kinase,CDPK)基因(CsCDPK1和CsCDPK5)等与不定根发生相关基因的表达诱导黄瓜不定根的发生[17]。在万寿菊中可以得到相似的结论,施加外源乙烯提高了万寿菊NR和NOS活性,增加内源NO的积累[18]。此外,乙烯处理后IAAO、POD和PPO活性显著提高[18]。细胞周期激活后,细胞分裂开始进行,对不定根发生有很好的促进作用。Jin等[18]发现,NO参与乙烯诱导的细胞周期激活促进不定根的发生。目前,外源乙烯是影响内源NO的含量来诱导植物不定根产生,且可通过促进细胞周期诱导不定根产生。但是,植物体自身也会产生乙烯,外源乙烯的施加是否影响植物体内源乙烯的产生,目前没有相关研究说明。
3.3 NO与其他激素
除了生长素和乙烯外,褪黑素处理番茄幼苗下胚轴能促进其不定根发生,且存在明显的浓度依赖效应。褪黑素下调S-亚硝基谷胱甘肽还原酶(S-nitroso glutathione reductase,GSNOR)和上调NR促进内源NO积累[66](图2)。然而,在下胚轴中内源NO增加也会促进褪黑素积累[66]。因此,褪黑素和NO在番茄不定根的发生中协同发挥作用。在整个植物不定根发生过程中,褪黑素和NO在其中发挥着重要作用,但是目前的相关研究较少,无法确定褪黑素和NO在不定根中具体功能和作用。
4 NO与非激素信号分子互作对植物不定根发生的影响
4.1 NO与Ca2+
细胞内Ca2+浓度的变化是植物各种细胞过程中的转导信号[69-70]。近年来的研究发现,Ca2+在植物不定根发生中与NO之间有着某些联系。NO和生长素诱导黄瓜不定根发生过程中Ca2+作为第二信使参与激活CDPK活性[70](图2)。在干旱条件下,Ca2+参与NO调控SOD、CAT和APX等抗氧化酶活性,逆转干旱胁迫对黄瓜不定根的抑制作用(图2),促进不定根发生[70]。与此同时,在李春兰等[71]的研究中也得到了相同的结论:在NO诱导黄瓜下胚轴不定根发生中,CaCl2提高抗氧化酶活性缓解干旱胁迫对黄瓜不定根发生的影响。另外一篇报道也说明了Ca2+和钙调蛋白(calmodulin,CaM)在NO和H2O2诱导不定根的信号中发挥作用,而且进一步推测出了Ca2+和CaM都是NO和H2O2诱导的不定根过程中的下游信号分子[16]。而在渗透胁迫下,外源NO和Ca2+通过保护光合系统、刺激抗氧化系统促进黄瓜不定根发生;而且在渗透胁迫下,黄瓜不定根的细胞内Ca2+含量也随着NO的增加而增加,施加cPTIO、硝酸还原酶抑制剂Na2WO4和叠氮化钠(NaN3)后发现Ca2+的增加并没有受到抑制,说明了在渗透条件下,Ca2+可能是NO在不定根发生过程中的下游信号分子[71]。此外,有研究证明CsCDPK1和CsCDPK5编码的CDPK参与了CH4诱导NO积累促进不定根发生过程[72]。而且,在NO参与H2诱导黄瓜不定根发生过程中,H2和NO也可上调CsCDPK1和CsCDPK5基因表达[63],调控不定根发生。这些研究说明,Ca2+提高抗氧化酶活性缓解逆境对植物不定根发生的抑制作用,同时提高内源NO促进植物不定根发生。
4.2 NO与H2O2
H2O2作为一种活性氧,被认为是植物生理生化过程中的核心调控分子。在植物不定根的发生中也发挥着作用。Liao等[73]首次在万寿菊中研究发现,NO和H2O2在植物不定根的发生中有共同的正向调控作用。张美玲等[74]在万寿菊中发现了NO和H2O2共同协作对万寿菊不定根的促进作用比NO或者H2O2单独作用更加显著,证明了NO和H2O2对万寿菊不定根的发生具有协同作用。经过NO和H2O2处理后的万寿菊内源Ca2+的含量是增加的,而且,Ca2+处理提高了内源性NO和H2O2水平。Ca2+是通过提高内源NO和H2O2的水平来促进万寿菊不定根发生[16]。在IBA诱导的不定根发生中也发现有NO和H2O2的参与[75]。3-O-C10-HL(N-3-decyl-homoserine lactone,N-3-癸酰基-高丝氨酸内酯)是一种调节种群密度的细菌群体感应信号分子,在绿豆幼苗中通过H2O2和NO诱导环鸟苷单磷酸(cyclic guanosine monophosphate,cGMP)信号促进生长素诱导的不定根发生[76]。在一个涉及H2O2、NO、Ca2+、 cGMP和MAPK的信号网络中H2O2和NO均作为信号网络的重要组成部分来诱导不定根形成[77]。在生长素诱导不定根发生过程中,H2O2和NO参与两条平行的下游信号通路,H2O2也是不定根发生过程中NO信号的下游分子[77](图2)。
4.3 NO与其他分子
除了上述几种物质,近几年研究发现,CH4作为一种最简单的有机物,在黄瓜外植体中可提高NOS活性促进NO积累,从而诱导黄瓜不定根的发生(图2),而且,添加cPTIO可显著抑制黄瓜不定根的发生[73],以此证明在CH4诱导的黄瓜不定根发生中是NO发挥作用。此外,在植物体内生长素低于正常水平时,血红素也能促进黄瓜外植体不定根发生[55]。而在黄瓜不定根发生中血红素和NO在同一个信号途径,由血红素介导NO的产生是NOS-Like或者L-Arg途径来完成的[78]。因此,NO可能在血红素的下游促进不定根的形成。CsHO1是从黄瓜中分离出来的血红素加氧酶(heme oxygenase,HO-1)基因,生长素可以迅速诱导HO-1来影响不定根的发生,施加SNP后,NO导致CsHO1诱导的融合蛋白水平上调[77],进而促进黄瓜不定根的发生。
H2作为一种自然界最小的气体分子,它和NO协作促进黄瓜不定根的发生,Zhu等[62]研究发现,HRW对黄瓜不定根发生有促进作用,其中50% HRW对其促进效果最好,而内源NO的产生与HRW诱导的不定根发生密切相关,当内源NO产生被阻断时,HRW在不定根中的促进作用发生逆转,NO可能作用于H2诱导不定根信号通路的下游。而且H2和NO还上调与细胞周期相关蛋白如CycA(Cyclin type A,A型细胞周期蛋白)、CycB(Cyclin type B,B型细胞周期蛋白)、CDKA(Cyclin dependent kinase A,周期蛋白依赖性激酶A)和CDKB(Cyclin dependent kinase B,周期蛋白依赖性激酶B)的表达来激活细胞周期。后来进行深入研究发现,HRW处理黄瓜外植体中上调的基因与NR有关,使得NR活性升高,NO产生增加,从而促进黄瓜不定根的发生(图2)。与此同时,Zhu等[79]还发现,HRW能促进NO积累和提高NOS活性。在NOS和NR抑制剂存在的情况下,H2诱导的不定根发育发生逆转,说明在抑制剂存在的条件下NOS仍然可能产生NO促进H2诱导的不定根发生(图2)。
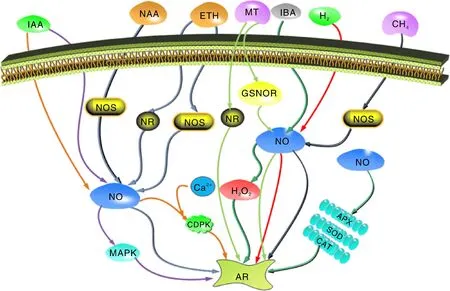
CDPK,钙依赖蛋白激酶;CAT,过氧化氢酶;SOD,超氧化物歧化酶;APX,抗坏血酸过氧化物酶;NR,硝酸还原酶;NOS,NO合酶;GSNOR,S-亚硝基谷胱甘肽还原酶。 CDPK, Calcium dependent protein kinase; CAT, Catalase; SOD, Superoxide dismutase; APX, Ascorbic acid peroxidase; NR, Nitrate reductase; NOS, Nitric oxide synthase; GSNOR, S-nitroso glutathione reductase.图2 NO与其他分子互作促进植物不定根的发生Fig.2 In teraction of NO with other molecules in promoting adventitious roots in plants
5 问题与展望
随着研究的深入,NO在植物体中的产生及其在植物生长发育以及在环境响应方面的功能研究取得了一定的进展。NO在植物不定根发生的信号网络中扮演着重要角色,这点是毋庸置疑的。而且NO和生长素、乙烯等激素以及其他信号分子物质如H2、H2O2、Ca2+等共同在植物不定根发生的信号网络中发挥作用也逐渐被人们证明。但是,是否有未知的物质亦参与到NO诱导植物不定根发生中的信号网络尚需进一步研究。此外,在实际生产中,NO是否可以应用于植物营养繁殖等生产实践需进一步探索。
尽管已经证实了NO在植物不定根中是一个关键的信号分子,但是,植物不定根的发生是一个复杂过程,受到营养状况、相关的应激反应、生物相互作用和遗传特性等多种内、外源性因素的影响。而且,有关NO参与植物不定根发生的研究大多集中在生理水平上,而在分子水平上的研究相对较少。目前已有很多研究结果表明,NO和内源物质共同协作调控植物不定根的发生。但是,NO与内源物质是如何相互协作促进不定根发生的;NO在诱导不定根发生前必须在植物体内感知、传递和表达,这一系列的信号转导过程是如何进行的。这些问题的研究对解析植物不定根发生机理有很大的帮助。
