灵芝孢子粉总三萜的提取优化及其体外生物活性
2020-04-28温慧萍雷伟敏柯乐芹陈雨薇肖建中
温慧萍,雷伟敏,柯乐芹,陈雨薇,侯 景,肖建中
(丽水学院 生态学院,浙江 丽水 323000)
灵芝孢子粉为灵芝在生长成熟期从灵芝菌盖中弹射出来的极其微小的卵形生殖细胞,有研究表明,其能治疗阿尔茨海默病[1],抗肝纤维化[2],且具有较好的抗肿瘤活性[3-7];因此,灵芝孢子粉逐渐发展成为重要的灵芝类保健食品。但是,此类商品品种繁多,质量参差不齐,价格差异较大,且并未有统一的有效成分含量标志,也缺少统一的国家质量标准。大多数文献资料认为,灵芝类产品的主要功效物质为多糖和三萜化合物[8-12]。目前,相关研究多集中在灵芝子实体三萜的提取方面[13-15],且均以齐墩果酸为对照品,而关于灵芝孢子粉三萜含量优化提取的研究较少[16-17]。此外,灵芝孢子粉总三萜的其他单体成分也还需进一步研究明确。由于提取过程溶剂与固体的比例、提取时间、溶剂组成和超声功率等因素都可能影响产品的提取效率和提取产量[18-19];因此,有必要对灵芝孢子粉的提取参数进行优化,以获得较高含量的三萜类化合物。本研究拟选取市场上常见的破壁灵芝孢子粉,对其主要功效成分灵芝孢子粉总三萜进行优化提取,并测定灵芝孢子粉总三萜的体外抗氧化活性,同时采用CCK-8法检测不同品牌灵芝孢子粉对人肝癌细胞HepG-2增殖的影响,为进一步开发灵芝孢子粉提供一定的理论依据。
1 材料与方法
1.1 试验材料
R210步琦旋转蒸发仪,瑞士步琦有限公司;UV2550紫外分光光度计,日本岛津公司;KQ-700VDV双频数控超声仪,昆山市超声仪器有限公司;DHG-9240A精宏电热鼓风干燥箱,上海精宏实验室设备有限公司;MIR-214 SANYO恒温培养箱,日本三洋公司;HERAcell 240i CO2恒温培养箱,美国Thermo公司。
灵芝酸A(LZS)标准品(批号18032603),成都普菲德生物技术有限公司;齐墩果酸标准品(批号C1723001),上海阿拉丁生化科技股份有限公司;高氯酸、冰醋酸均为分析纯,国药集团化学试剂有限公司;ABTS试剂,Sigma-Aldrich公司;DPPH(批号E1910039),上海阿拉丁生化科技股份有限公司;RPMI-1640培养基、DMEM培养基、青霉素、链霉素、胎牛血清,美国Life Technology公司;CCK-8试剂盒,同仁化学研究所;人肝癌HepG-2细胞系,本实验室常规培养、保存。
供试品包括:修正破壁灵芝孢子粉(XZ)、和成恒破壁灵芝孢子粉(HCH)、唐巢破壁灵芝孢子粉(TC)、万世堂破壁灵芝孢子粉(WST)、康益新破壁灵芝孢子粉(KYX)、北芝堂破壁灵芝孢子粉(BZT)、林岛灵芝孢子粉(LD)。以上产品通过实体药店,以及天猫、京东等网上购物平台购买,所有样品均为国食健字号产品。
1.2 试验设计
1.2.1 单因素试验
以WST为样本,以灵芝孢子粉总三萜得率为评价指标,分别进行乙醇体积分数、固液比(质量体积比)、提取时间、提取温度、超声功率的单因素试验。
(1)乙醇体积分数对得率的影响。精密称取6份样品(每份约1.0 g),分别加入30 mL体积分数为40%、50%、60%、70%、80%、90%的乙醇,提取30 min,在提取温度40 ℃、超声功率700 W的条件下进行灵芝孢子粉总三萜的提取。
(2)固液比对得率的影响。按照固液比1∶10、1∶20、1∶30、1∶40、1∶50的比例加入体积分数80%的乙醇,提取30 min,在提取温度40 ℃、超声功率700 W的条件下进行灵芝孢子粉总三萜的提取。
(3)提取时间对得率的影响。在固液比1∶20、提取温度40 ℃、超声功率700 W、乙醇体积分数80%的条件下,分别提取30、45、60、75、90 min。
(4)提取温度对得率的影响。在固液比1∶20、乙醇体积分数80%、提取时间60 min、超声功率700 W的条件下,分别在30、35、40、45、50 ℃提取灵芝孢子粉总三萜。
(5)超声功率对得率的影响。在固液比1∶20、乙醇体积分数80%、提取时间30 min、提取温度40 ℃的条件下,分别在350、420、490、560、630、700 W提取灵芝孢子粉总三萜。
1.2.2 Plackett-Burman(PB)试验
在单因素试验的基础上,以灵芝孢子粉总三萜得率为响应值,对提取温度、固液比、乙醇体积分数、超声功率和提取时间5个因素进行评价。采用Minitab17软件设计试验,并筛选出主效应因子,每个因素取最低(-1)和最高(+1)2个水平,共12组试验(表1)。
1.2.3 响应面设计
在PB试验的基础上,选取乙醇体积分数(A)、固液比(B)、超声功率(C)为自变量,以灵芝孢子粉总三萜得率(Y)为响应量,利用Design-Expert 8.0.6进行3因素3水平的试验设计(表2)。
1.3 试验方法
1.3.1 灵芝孢子粉总三萜的得率测定
灵芝孢子粉总三萜的得率测定采用香草醛-冰醋酸-高氯酸法[20]。配置0.35 mg·mL-1的齐墩果酸对照品,分别量取0、0.4、0.8、1.2、1.6、2.0 mL,水浴挥干,加入0.4 mL的5%(体积分数)香草醛-冰醋酸溶液和1 mL高氯酸,于60 ℃恒温水浴15 min,冰水冷却至室温,加入5 mL冰醋酸摇匀,在548 nm波长下测定吸光度,每个样本重复3次,绘制标准曲线。结果显示,所构建的标准曲线为y=1.719 8x-0.014 1,决定系数(R2)为0.998 9,线性关系良好。根据得到的灵芝孢子粉总三萜质量与原料质量,计算灵芝孢子粉总三萜的得率。
1.3.2 灵芝孢子粉总三萜对DPPH自由基的清除活性测定[21]
表1 PB试验设计因素和水平
Table 1 PB design factors and levels

因素Factor编码Code低水平Low level(-1) 高水平High level(+1)乙醇体积分数X17090Ethanol volume fraction/%固液比Solid to liquid ratioX21∶101∶30提取时间Extract time/minX34575提取温度Extract temperature/℃X43545超声功率Ultrasonic power/W X5420560
表2 响应面试验设计
Table 2 Response surface test design

因素Factor编码水平编号Code level of variable-11+1A. 乙醇体积分数708090Ethanol volume fraction/%B. 固液比Solid to liquid ratio1∶101∶201∶30C. 超声功率Ultrasonic power/W420490560
按优化流程提取各供试灵芝孢子粉的总三萜,用无水乙醇配置成质量浓度为0.5、1.0、1.5、2.0、2.5、3.0 mg·mL-1的溶液,取1 mL样品液加入1 mL 0.04 mmoL·L-1的DPPH甲醇溶液,混匀,室温避光反应30 min后,于517 nm处测定其吸光度。以抗坏血酸为阳性对照,按式(1)计算DPPH自由基清除率(R1):
R1=1-(A1-A2)/A0。
(1)
式(1)中:A1为1 mL样品提取液+1 mL DPPH溶液的吸光度,A2为1 mL无水乙醇+1 mL提取物溶液的吸光度,A0是1 mL无水乙醇+1 mL DPPH溶液的吸光度。
1.3.3 灵芝孢子粉总三萜对ABTS+自由基的清除活性测定
取100 μL质量浓度0.5、1.0、1.5、2.0、2.5、3.0 mg·mL-1的待测样品,加入300 μL ABTS+工作液(7.4 mmoL·L-1ABST+储备液与2.6 mmoL·L-1K2S2O8以1∶1的体积比混合,避光反应12 h后,用甲醇稀释至吸光度0.70±0.02,在室温下避光反应6 min[22],于734 nm处测定其吸光度,以抗坏血酸作为阳性对照。按式(2)计算ABTS+自由基清除率(R2):
R2=1-(A3-A4)/A5。
(2)
式(2)中:A3为100 μL样品提取液+300 μL ABTS+溶液的吸光度,A4为300 μL甲醇+100 μL提取物溶液的吸光度,A5是100 μL甲醇+300 μL ABTS+溶液的吸光度。
1.3.4 CCK-8法测定灵芝孢子粉总三萜对人肝癌细胞HepG-2的影响
采用CCK-8法[23],取对数生长期的HepG-2细胞,0.25%(质量分数)胰蛋白酶消化后计数。用RPMI1640细胞培养液将细胞浓度调整为1×105mL-1,取100 μL接种于96孔板,设置对照组、空白组和给药组,其中,给药组加入100 μL质量浓度为 0.02 mg·mL-1的灵芝孢子粉总三萜提取液,对照组不加药,空白组只加培养液,每组设置5个复孔。放入CO2培养箱内孵育24 h,弃上清,每孔加入100 μL 10%(质量分数)CCK-8溶液,孵育0.5 h后,于450 nm处测定其吸光度,重复3次。按式(3)计算细胞存活率(S):
S=(A6-A8)/(A7-A8)。
(3)
式(3)中:A6、A7、A8分别是给药组、对照组、空白组的吸光度。
1.4 数据处理
使用Minitab 17软件进行Plackett-Burman设计分析,利用Design Expert 8.0.5软件进行响应面设计和相关分析。用SPSS 19.0软件进行数据统计分析,用Origin 8.0软件做图。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对得率的影响
如图1-A所示,当乙醇体积分数低于70%时,灵芝孢子粉总三萜的得率随着乙醇体积分数的增加而较快增加;当乙醇体积分数增大到80%时,得率最大;随后,得率逐渐降低。因此,最适宜的乙醇体积分数在70%~90%。
2.1.2 固液比对得率的影响
如图1-B所示,灵芝孢子粉总三萜的得率在固液比为1∶20时最大。因此,固液比以1∶10~1∶30为宜。
2.1.3 提取时间对得率的影响
如图1-C所示,适当延长提取时间能够提高灵芝孢子粉总三萜的得率,当提取时间为60 min时,得率最大(5.82 mg·g-1),继续延长提取时间,得率趋于稳定。因此,提取时间应当在45~75 min。
2.1.4 提取温度对得率的影响
如图1-D所示,当提取温度为40 ℃时,灵芝孢子粉总三萜的得率达到峰值(5.98 mg·g-1),进一步升高提取温度,得率反而下降。因此,提取温度宜在35~45 ℃。
2.1.5 超声功率对得率的影响
如图1-E所示,当超声功率为350~490 W,灵芝孢子粉总三萜的得率随着功率的提升而迅速提高,在490 W时达到最大得率(4.90 mg·g-1),而在490~700 W,灵芝孢子粉总三萜的得率随着功率的提升略有下降。这可能是因为,适宜的超声功率有助于快速促进细胞内三萜化合物的渗出,但过高的超声功率可能会导致三萜化合物结构破坏;因此,超声功率宜选择在420~560 W。
2.2 PB试验结果
PB试验的结果如表3所示。采用Minitab 17软件对表1中的数据进行多元回归分析,得到以灵芝孢子粉总三萜得率为响应值的最优方程:Y=4.997 4+0.763 4X1+0.706 9X2-0.125 1X3+0.067 1X4+0.705 4X5。各因素的效应评价结果见表4。

图1 不同提取因素对灵芝孢子粉总三萜得率的影响Fig.1 Effects of extraction factors on total triterpenoid yield
表3 PB试验设计及结果
Table 3 PB experimental design and results

编号No.因素FactorX1X2X3X4X5得率Yield/(mg·g-1)11-1-1-115.2892-11-1-1-14.171311-1116.89341-11-1-13.6145-111-116.3026-1-1-1114.356711-11-16.8328111-117.0129-1-1-1-1-13.19410-1111-13.016111-111-14.92512-1-11114.365
由表4可知,乙醇体积分数、固液比、超声功率的效应达到显著性水平(P<0.05),可作为进一步优化的因素,而提取时间与提取温度的效应不显著。
2.3 响应面试验结果
根据PB试验结果,选取超声功率、固液比、乙醇体积分数进行3因素3水平的Box-Behnken试验设计,试验方案与结果见表5。对Box-Behnken试验设计的结果建立数学回归模型并进行方差分析(ANOVA),结果见表6。经过拟合得到的回归方程为Y=4.95+2.66A+1.22B+1.42C-0.38AB-0.64AC+0.27BC-0.082A2-2.04B2-0.89C2,R2=0.980 8,模型的P值<0.000 1,失拟项>0.05,表明模型可信,拟合结果真实可靠。方差分析结果显示,各单因素均达到显著水平(P<
表4 PB试验设计各因素的效应评价
Table 4 Effect evaluations of each factor under PB test design

因素Factors效应Effect系数Coefficient系数标准误Standard errorTP常量Cconstant—4.997 40.241 320.71<0.001乙醇体积分数Ethanol volume fraction1.526 80.763 40.241 33.160.019固液比Solid to liquid ratio1.413 80.706 90.241 32.930.026提取时间Extract time-0.250 2-0.125 10.241 3-0.520.623提取温度 Extract temperature0.134 20.067 10.241 30.290.790超声功率Ultrasonic power1.410 80.705 40.241 32.920.027
表5 Box-Behnken试验设计与结果
Table 5 Design and results of Box-Behnken tests

试验序号No.A/%BC/W得率Yield/(mg·g-1)1701∶304904.307 2801∶304203.425 3901∶205606.191 4701∶204202.694 5701∶104901.857 6801∶204906.926 7801∶305605.980 8801∶104202.285 9901∶104904.332 10901∶304905.254 11901∶204206.378 12701∶205605.081 13801∶204906.479 14801∶204907.067 15801∶204906.906 16801∶204906.556 17801∶105603.767
0.05),其影响力由大到小依次为乙醇体积分数>超声功率>固液比。
响应面法优化得到3因素的三维图(图2)。由图2可知,固液比与超声功率之间具有较强的影响,实际值较大的固液比和超声功率具有使灵芝孢子粉总三萜得率减小的倾向。这可能是由于超声功率大使得灵芝孢子粉中的其他杂质溶出。此外,乙醇体积分数和固液比的交互作用亦较强,较大的固液比与乙醇体积分数下,灵芝孢子粉总三萜得率反而减小。这可能是因为乙醇体积分数加大,导致其他非三萜类醇溶性物质溶出,从而影响了灵芝孢子粉总三萜的得率。灵芝孢子粉总三萜提取的理论最优条件是:乙醇体积分数、液料比(固液比的倒数)、超声功率分别为79.93%、22.48、523.64 W,理论得率为7.068 mg·g-1。结合实际,灵芝孢子粉总三萜的最优提取条件被确定为乙醇体积分数80%,固液比1∶23,超声功率540 W,40 ℃超声提取60 min。在最佳条件下进行3次重复试验,实际得率分别为6.970、7.025、7.167 mg·g-1,平均值为7.054 mg·g-1,验证结果与理论值接近,表明所得结果准确可靠。
表6 响应面方差分析结果
Table 6 ANOVA results of response surface
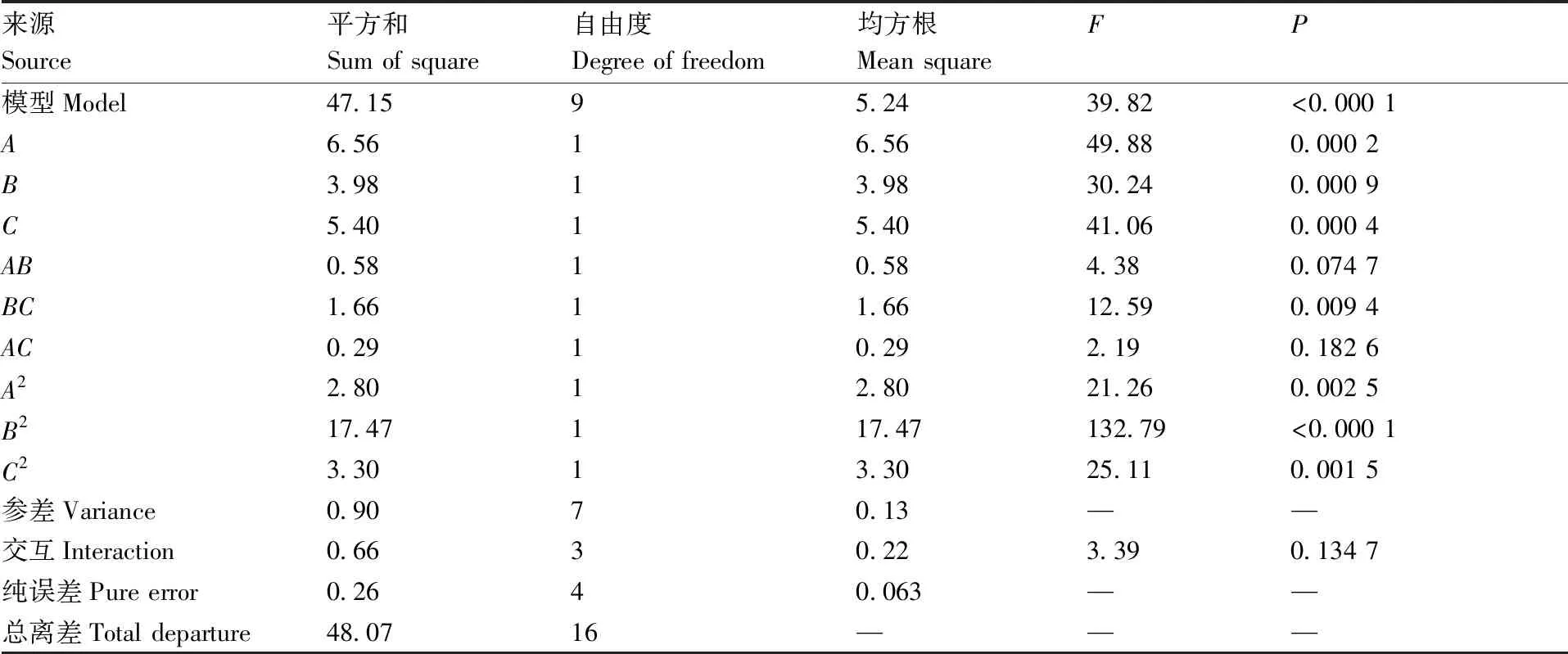
来源Source平方和Sum of square自由度Degree of freedom均方根Mean squareFP模型Model47.1595.2439.82<0.000 1A6.5616.5649.880.000 2B3.9813.9830.240.000 9C5.4015.4041.060.000 4AB0.5810.584.380.074 7BC1.6611.6612.590.009 4AC0.2910.292.190.182 6A22.8012.8021.260.002 5B217.47117.47132.79<0.000 1C23.3013.3025.110.001 5参差Variance 0.9070.13——交互Interaction0.6630.223.390.134 7纯误差Pure error0.2640.063——总离差Total departure48.0716———

图2 响应面三维图Fig.2 Three dimensional map of response surface
2.4 灵芝孢子粉总三萜的体外抗氧化活性
将从不同样品中提取的灵芝孢子粉总三萜配成不同质量浓度的溶液,分别测定其清除DPPH、ABTS+自由基的活性。如图3所示,灵芝孢子粉总三萜具有一定的抗氧化活性,其清除ABTS+的活性强于清除DPPH,且清除ABTS+的能力随着灵芝孢子粉总三萜质量浓度的增大而提高,最大清除率可达94.7%,但其清除DPPH的能力较弱,清除率小于50.0%,当质量浓度超过1.0 mg·mL-1后,其对DPPH的清除率增加趋于平缓。
如表7所示,灵芝孢子粉总三萜含量越高的样品,其清除自由基的活性越强:TC的灵芝孢子粉总三萜含量高达18.495 mg·g-1,对DPPH、ABTS+均表现出最强的清除能力,半抑制浓度(IC50)分别为2.495、0.452 mg·g-1。但并不是所有供试的灵芝孢子粉都呈现出良好的剂量-效应关系,其中,HCH清除DPPH的能力较弱,但其清除ABTS+自由基的活性较强,IC50达到了0.584 mg·g-1。
2.5 灵芝孢子粉总三萜对HepG-2肝癌细胞增殖的影响
由图4可知,与对照组(Con)相比,从不同品牌的供试样品中提取的灵芝孢子粉总三萜对HepG-2肝癌细胞均表现出较强的抑制作用。其中,TC的灵芝孢子粉总三萜含量最高,但其抑制HepG-2肝癌细胞的能力并不突出,细胞存活率高达67.5%;KYX、HCH对HepG-2肝癌细胞具有较好的抑制作用,2组细胞的存活率分别为44.7%、48.8%,均低于50.0%;LD对HepG-2肝癌细胞的抑制作用相对较弱,细胞存活率高达85.1%。

图3 灵芝孢子粉总三萜对抗DPPH(A)和ABTS+(B)的清除能力Fig.3 Antioxidant activities of different concentrations of total triterpenoid against DPPH (A) and ABTS+ (B)
表7 供试灵芝孢子粉总三萜的含量及其抗氧化活性(IC50)
Table 7 Contents of total triterpenoids extracted formGanodermalucidumspore powder and their antioxidant activities (IC50)

样品Sample总三萜含量Total triterpenoidscontent/(mg·g-1)IC50DPPHABTS+LD5.5393.6430.689HCH5.7594.1740.584XZ6.7292.8070.946WST6.9672.5552.002BZT4.9973.7281.053TC18.4952.4950.452KYX7.6372.5551.114

**表示与对照组相比差异极显著(P<0.01)。 ** indicated significant difference at P<0.01 as compared with the control group.图4 不同供试品牌样品的灵芝孢子粉总三萜对人肝癌细胞HepG-2存活率的影响Fig.4 Effect of total triterpenoids extracted from Ganoderma lucidum spore powder on survivability of HepG-2 cells
3 结论与讨论
Plackett-Burman设计可在减少试验次数的条件下快速找到显著因素;Box-Behnken试验设计能够进行相关数据的拟合,建立因素与响应值之间的模型并筛选出最佳工艺。综合采用上述设计方案,本试验充分考虑了各影响因素的交互作用,可提高试验结果的准确度和精确度。
本试验考查了灵芝孢子粉总三萜类化合物的体外抗氧化活性,及对HepG-2肝癌细胞增殖的影响,结果显示,其清除ABTS+自由基的活性较强,且对HepG-2肝癌细胞有一定的抑制作用,但灵芝孢子粉总三萜含量较高的样品虽具有更强的抗氧化能力,但并未表现出更突出的抑制HepG-2肝癌细胞增殖的效果。这可能是因为灵芝孢子粉总三萜中萜类物质的种类和含量存在较大差异,且并非所有三萜都具有抗肿瘤活性[24]。各品牌的灵芝孢子粉来源地不同,生长环境、采集季节亦有差异,均可导致其总三萜组成存在差异,故其抗氧化活性与抑制HepG-2肝癌细胞的能力并未表现出较明显的剂量效应相关性。
此外,本课题组利用高效液相色谱(HPLC)对经优化方法从不同供试样品中提取的灵芝孢子粉总三萜进行灵芝酸A含量测定,结果显示,灵芝孢子粉中灵芝酸A含量极低(数据未展示)。虽然所采用的色谱方法和样品处理方式与范蕾等[25]文献报告有差异,但色谱图高度一致。推测总三萜中灵芝酸A含量较少,且其并非灵芝孢子粉总三萜的主要组成成分,因此并不能确立其为质量参考标准物质。
灵芝中的三萜类化合物具有较好的治疗癌症、抗氧化、保护肝脏等药用潜力,但目前对灵芝孢子粉中三萜类化合物的研究较少,缺少成熟的分离提取和有效纯化单体的技术,且其药效作用基础物质不明确,因此有必要深入研究,明确相关的药效活性成分及其药理作用机制,并制定统一的标准来规范灵芝孢子粉的产品质量,从而为灵芝孢子粉的开发应用提供科学依据。
