高通量测序技术分析无特定病原体级实验小鼠肠道的菌群组成
2020-04-28韩立中
李 惠,冯 洁,韩立中
(1.上海交通大学医学院附属瑞金医院a.检验系,b.临床微生物科,上海 200025;2.上海实验动物研究中心 上海市实验动物质量监督检验站,上海 201203)
随着生命科学的快速发展,发达国家在生命科学研究、药品及生物试剂生产、食品检验和航天工业中使用的实验动物均已达到无特定病原体(specific pathogen free,SPF)级,我国也要求在2010 年普及使用SPF 级实验动物[1]。欧洲实验动物联合会(Federation of European Laboratory Animal Science Associations,FELASA)定期发布和更新详细全面的实验动物健康监控指南和人员培训计划,详细阐述了监测病原体的种类、采样要求和检测方法等[2]。我国最新发布的实验动物国家标准《实验动物微生物学等级及监测(GB 14922.2-2011)》中指出,SPF 级实验动物是指除清洁动物应排除的病原外,不携带主要潜在感染或条件致病菌和对科学实验干扰大的病原,简称SPF 级实验动物。针对无特定微生物,我国实验动物国家标准列举了8 个必须排除的菌属或菌种,分别为沙门菌属(Salmonella spp.)、支原体属(Mycoplasma spp.)、鼠棒状杆菌(Corynebacterium kutscheri)、泰泽病原体(Tyzzer′s Organism)、嗜肺巴斯德杆菌(Pasteurella pneumotropica)、肺炎克雷伯菌(Klebsiella peneumoniae)、金黄色葡萄球菌(Staphylococcus aureus)和铜绿假单胞菌(Pseudomonas aeruginosa)。即SPF 级实验动物不带有对人或动物本身致病的微生物,但非特定的微生物是允许存在的,且不能排除可经胎盘屏障垂直传播的微生物。然而在特定条件下,“非”病原体可以成为病原体,目前对于部分病原体尚缺乏有效的检查手段。最近有研究表明,动物肠道微生物其实对实验结果有较大影响,许多科研结果不能重复也归咎于肠道菌群的影响[3]。
实验动物是否达到了SPF 级别,其重要的评价手段就是微生物质量监测,必须建立一套完整且高通量的微生物检测体系,来确保大批量的实验动物不携带应排除的病原体。本研究在比较国内外实验动物细菌监测方案后,选取部分细菌指标作为调查项目,旨在建立一个将SPF 级实验小鼠肠道内容物病原菌的筛选与高通量测序技术相结合的技术平台,探讨其肠道菌群结构分析的方法,从微生物质量角度评估SPF 级实验小鼠质量,为提升实验动物的微生物检测水平提供技术支撑。
材料与方法
一、材料
选取14 个品系共65 只SPF 级健康成年小鼠(见表1),雌鼠33 只,雄鼠32 只,由上海实验动物研究中心提供,所有实验动物饲养于屏障环境,饲养环境及条件相同,均随机取自各饲养笼中。

表1 65 只SPF 级小鼠样本编号其品系分布
二、材料与方法
1.肠道内容物总DNA 抽提:无菌采集处死后SPF 级健康成年小鼠回盲部肠道内容物,称重3~5 g,立即置于无菌采样盒内,于-80 ℃下冷冻保存。取150 mg 冰冻样品,采用TIANGEN(天根)生化科技有限公司提供的粪便基因组DNA 抽提试剂盒抽提粪便DNA[尽量使DNA 浓度大于100 ng/μL,吸光度值(A)280/260介于1.8~2.0 之间,并确保DNA 无降解],在完成浓度测定及琼脂糖凝胶电泳评定后,保存于-20 ℃冰箱中。
2.16S rDNA 基因扩增、纯化及测序
(1)PCR 扩增:用338F(5′-ACTCCTACGGGA GGCAGCAG-3′)和806R(5′-GGACTACHVGGGTW TCTAAT-3′)引物对样本中细菌16S rRNA 基因的高可变V3~V4 区进行PCR 扩增。扩增程序为,95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共27 个循环;最后72 ℃延伸10 min(ABI GeneAmp®9700 型PCR 仪)。扩增体系为20 μL,包括5×FastPfu 缓冲液4 μL,2.5 mmol/L 的dNTPs 2 μL,0.8 μL 引物(5 μmol/L),FastPfu 聚合酶0.4 μL;10 ng DNA 模板。
(2)Illumina MiSeq 测序:使用2%琼脂糖凝胶回收PCR 产物,利用AxyPrep DNA 凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl 洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega,USA)进行定量检测。根据Illumina MiSeq 平台(Illumina,San Diego,USA)标准操作规程,将纯化后的扩增片段构建PE 文库。用Illumina 公司的MiSeq PE300 平台进行测序(上海美吉生物医药科技有限公司)。
3.数据处理:原始测序序列使用Trimmomatic软件进行质控,用FLASH 软件进行拼接。①设置50 bp 的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp 的序列;②barcode 需精确匹配,引物允许2 个碱基的错配,去除模糊碱基;③根据重叠碱基将两端序列进行拼接,重叠碱基需大于10 bp。去除无法拼接的序列[4]。使用的UPARSE 软件(版本7.1,网址http://drive5.com/uparse/),根据97%的相似度对序列进行运筹分类单位(operational taxonomic units,OTU)聚类;使用UCHIME 软件剔除嵌合体。利用核糖体数据库项目(ribosomal database project,RDP)分类(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva 数据库(SSU123),设置比对阈值为70%。Alpha 多样性是对单个样品中物种多样性进行分析[5],包括Chao1 值、Ace 值、Shannon 指数以及Simpson 指数等[6]。利用Mothur(版本1.30.1)软件计算样品的Alpha 多样性值。利用测得16S rDNA序列中已知的各种OTU 的相对比例,来计算抽取n 个(n 小于测得标签序列总数)标签序列时出现OTU 数量的期望值,然后根据一组n 值(一般为一组小于总序列数的等差数列)与其相对应的OTU 数量的期望值,采用软件R(版本3.2.2)绘制稀释曲线。
结 果
一、高通量序列分析和质量控制
65 只SPF 级健康成年小鼠的回盲部肠道内容物样本,经数据过滤和质控后得到144 318 条高质量序列用于后续分析,这些序列长度集中在421~460 bp 之间(见图1)。经开放读码框OUT 聚类,65 个样本高通量测序数据的片段可以聚类为972 个OUT。
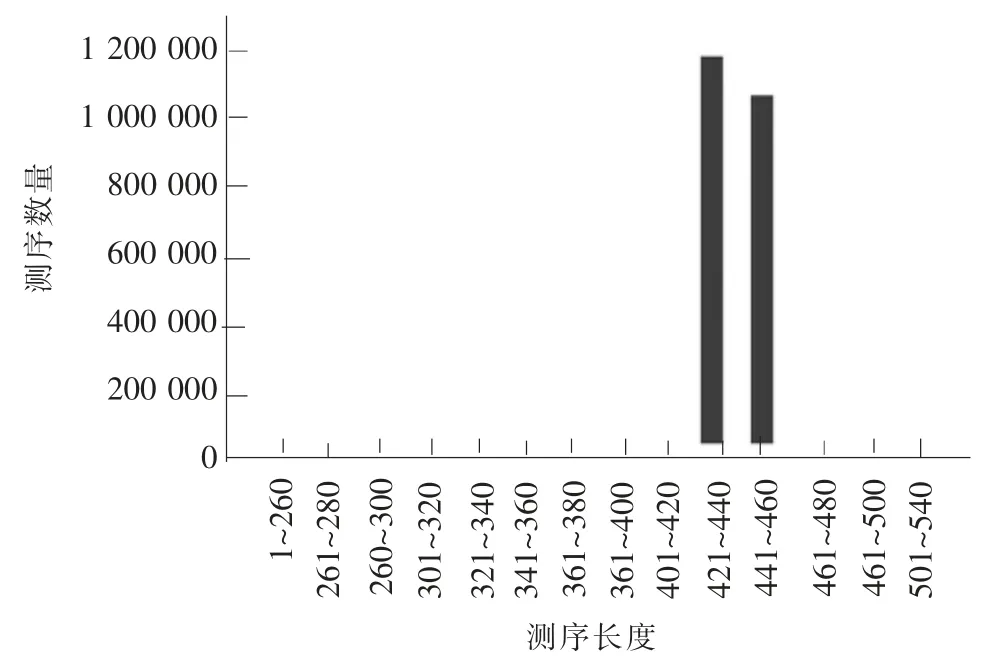
图1 样本高通量测序数据平均长度分布
二、Alpha 多样性分析结果
C57 品系小鼠(11 只)、BALB/c 品系小鼠(11 只)、ICR 品系小鼠(15 只)、C57BL/6 品系(11 只)Nu/Nu和db 品系(6 只)与其他品系小鼠(8 只)样品的Alpha 多样性分析结果见表2~7。本次实验Alpha多样性指数的结果显示,相同品系的小鼠样本间Alpha 多样性表现不均一,菌种数目亦不均匀,覆盖率显示本次测序结果能够代表样本中微生物的真实情况。
65 条样品稀释曲线如图2 所示,无限接近于样本中所包含OTUs 的最大值,但各样本物种丰度表现出明显差异。各曲线上升趋势已趋于平缓,接近平台期,说明其高通量测序深度能够满足本研究的分析要求。等级丰度曲线可用来解释多样性的2个方面,即物种丰度和物种均匀度(见图3)。本实验的65 份样本曲线走势显示在横轴上的范围和平滑程度均有较大差异,亦说明小鼠样本间表现出不同的丰度和均匀度。
三、肠道内容物菌群结构组成
1.在门水平上样品物种分布情况:基于OTU聚类对V3~V4 区序列在门水平上的样品数据统计,发现本实验所有样本的序列主要集中在以下8 个门,依次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、Saccharibacteria、软壁菌门(Tenericutes)和螺旋菌门(Spirochaetae),以厚壁菌门和拟杆菌门为主,除样本33~36 外,这二类基本占所有菌群门水平的60%以上。样本33~36 以变形菌门(Proteobacteria)为优势菌群;样本39、40、47 和52 则以厚壁菌门为优势菌群(见图4)。

表2 C57 品系小鼠(11 只)样品在在97%相似度水平下的Alpha 多样性
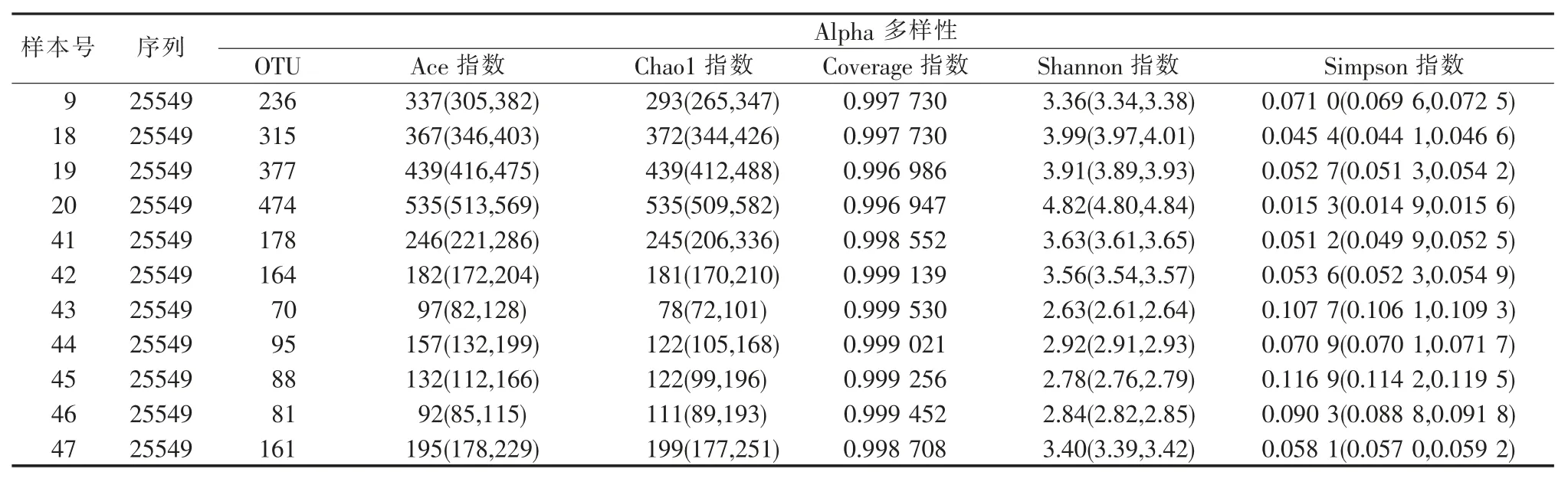
表3 BALB/c 品系小鼠(11 只)样品在在97%相似度水平下的Alpha 多样性
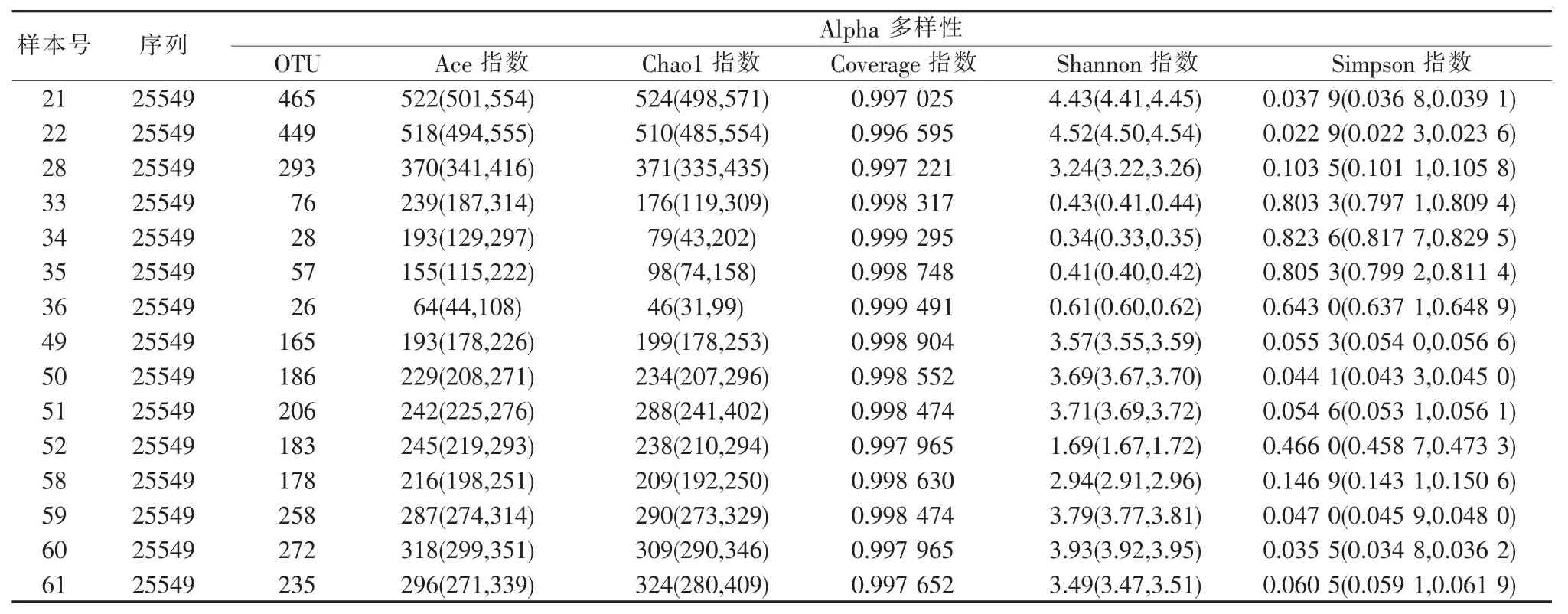
表4 ICR 品系(15 只)小鼠样品在在97%相似度水平下的Alpha 多样性

表5 C57BL/6 品系(11 只)小鼠样品在在97%相似度水平下的Alpha 多样性
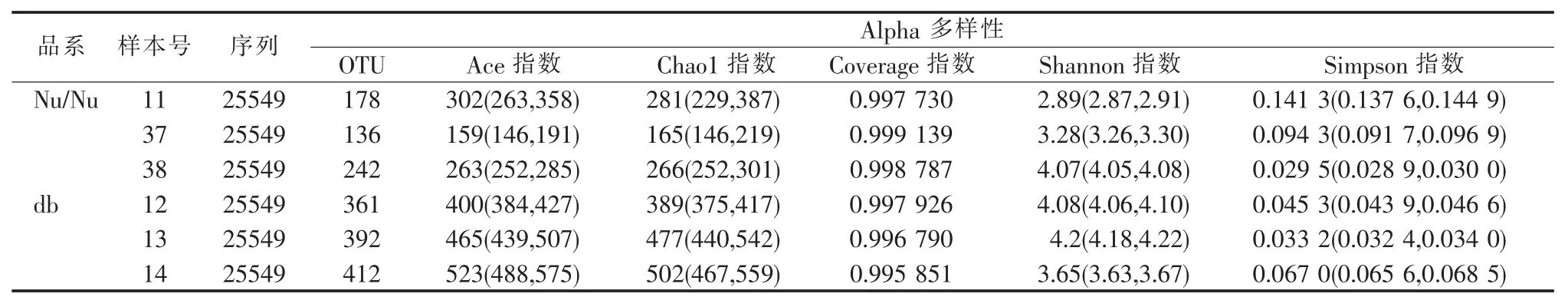
表6 Nu/Nu 和db 品系(6 只)小鼠样品在在97%相似度水平下的Alpha 多样性

表7 其他品系小鼠(8 只)样品在在97%相似度水平下的Alpha 丰富程度

图2 样品在遗传距离0.03 下的稀释曲线
2.在属水平上样本物种分布情况:本组各样本在属分类水平上菌群结构组成见图5。
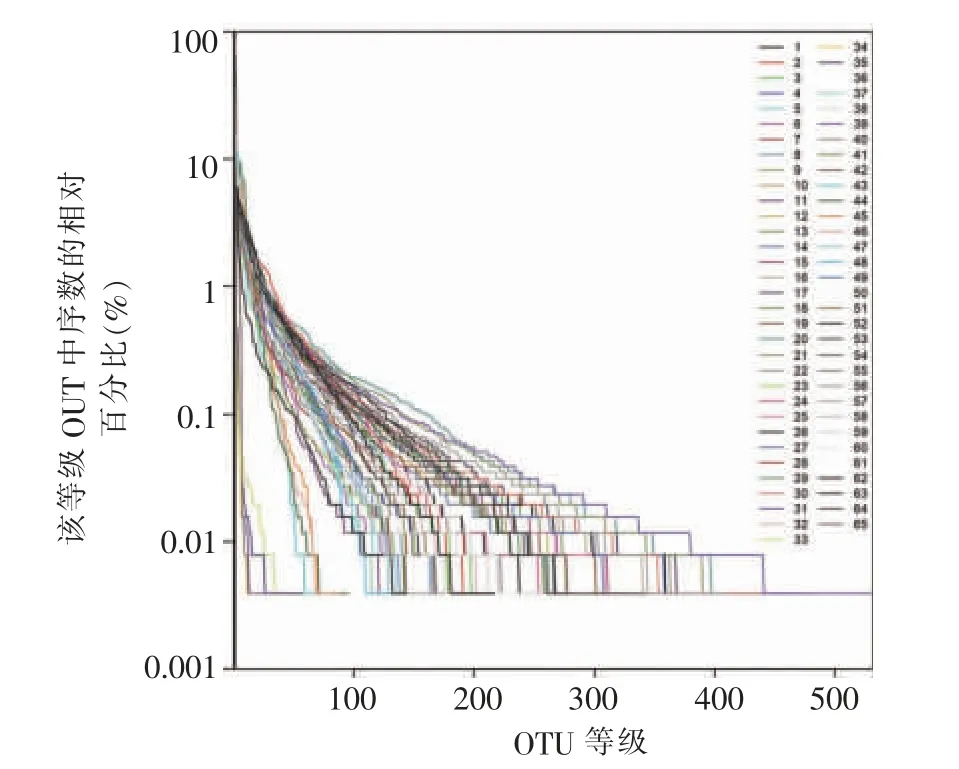
图3 等级丰度曲线
在ICR 品系小鼠中,样本33~36 表现为Enterobacteriaceae_unclassified 丰度较高,分别为89.1%、90.3%、89.2%和77.3%,显著高于其他小鼠的丰度。样本33~36 中类芽孢杆菌属(Paenibacillus sp.)丰度分别为9.6%、9.4%、9.6%和21.4%;样本39 和40 号来自品系C57BL/6,其类芽孢杆菌属丰度分别为20.8%和33.0%,以上6 个样本该菌属丰度显著高于其他小鼠。同样,在样本39 和40 中,狭义梭菌属(Clostridium_sensu_stricto_1)丰度分别为75.2%和61.0%,亦显著高于其他小鼠。针对本研究的目的菌属,样本39 和40 中葡萄球菌属(Staphylococcus)的丰度分别为2.3%和2.6%,葡萄球菌属还存在于其他部分样本中,其在各样本中的丰度见表8。

图4 样品在门分类水平上菌群结构组成
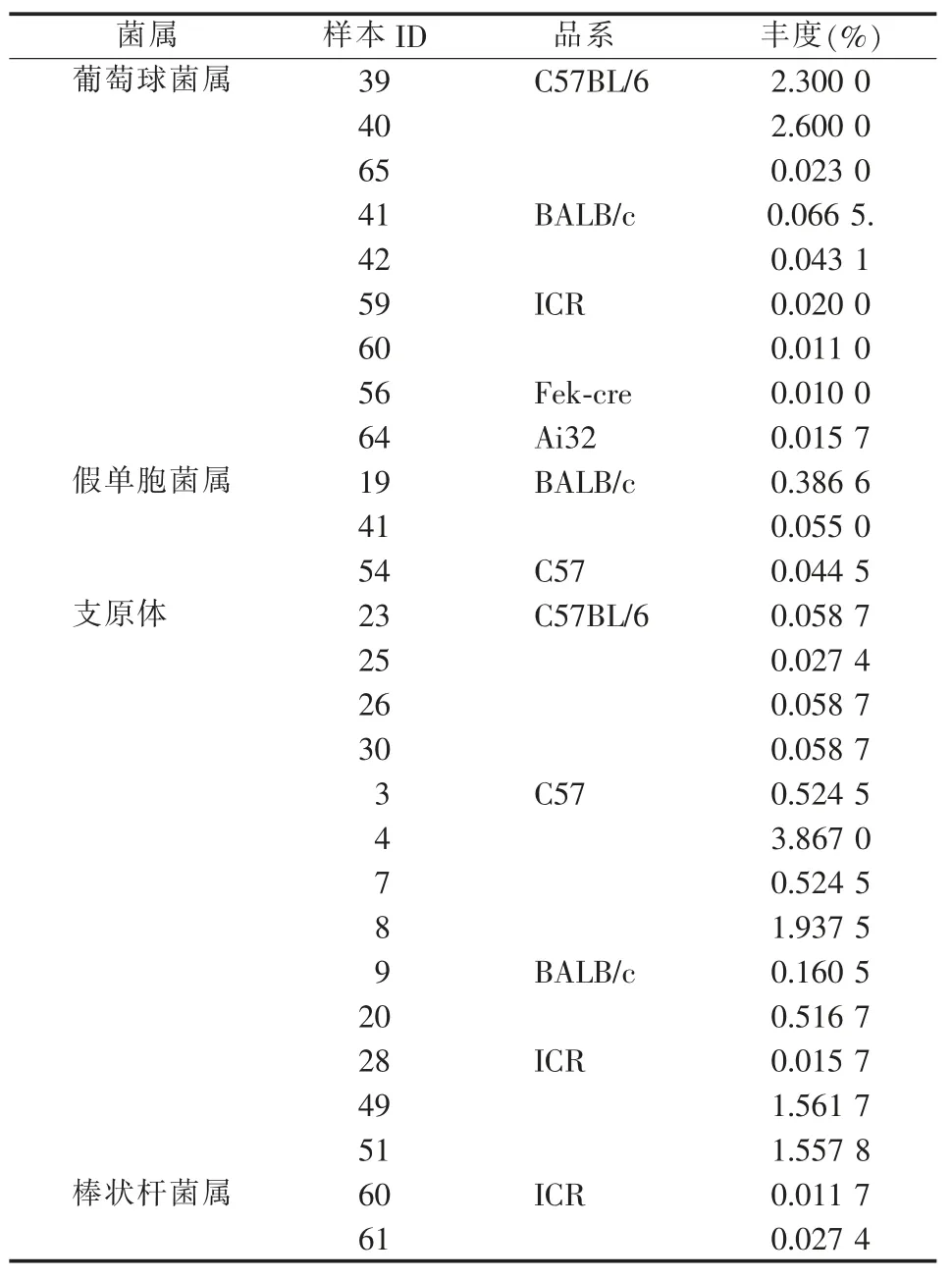
表8 目的菌属在各品系小鼠不同样本的丰度
本研究中其他目的菌属包括支原体、棒状杆菌属和假单胞菌属在各品系小鼠不同样本的丰度详见表8。
讨论
在机体肠道中,微生物在与宿主共同进化过程中形成了数量巨大、对宿主有益且必要的肠道正常菌群。这些微生物菌群在系统发生上显著不同,而其多样性是宿主选择性和菌群共进化、共同作用的结果,包括厌氧菌、兼性厌氧菌和需氧菌,其中97%以上为专性厌氧菌,且大多分布在结肠部位。在正常情况下,这些微生物菌群保持着动态的平衡和稳定。分子微生物生态学的方法已经揭示了未能培养的细菌群体的多样性[7],最近这些技术又被用来分析随着时间变化、肠道不同区域以及不同个体之间的微生物菌群结构差异[8-9]。高通量测序技术已被应用于多种生态系统的微生物多样性研究,如土壤[10-11]、海洋[12]、肠道[13-14]等,其使得人们对一个物种的转录组和基因组进行细致、全面的分析成为可能,故又被称为深度测序,是深入研究微生物菌群结构的新手段[15-16]。由于目的菌属在各样本中的丰度较低,本研究应用Megablast 的方法检测所有样本中属内OUT 数量(见表9)。

图5 样品在属分类水平上菌群结构组成

表9 Megablast 方法分析样本中检测到目的菌属的OUT 数量
目前,我国 《实验动物微生物学等级及监测(GB 14922.2-2011)》所推荐的小鼠细菌检测标准为常规分离培养结合生化鉴定法。传统的研究是通过培养结合生化鉴定的方法来分析其组成,肠道可培养的常见厌氧菌种属有拟杆菌、梭菌、双歧杆菌和乳杆菌;兼性厌氧菌有革兰阴性肠杆菌(如大肠埃希菌、沙门菌)和革兰阳性球菌(如肠球菌、葡萄球菌、链球菌)。然而,直接进行显微观察的结果发现,大多数肠道微生物形态与可培养微生物形态并不一致,其可能是肠道微生物离开了相应的生态位后死亡而引起。为了避免传统培养方法的局限,本研究引入了高通量测序技术,分析65 份SPF 级实验小鼠回盲部肠道内容物的细菌物种组成和丰度、Alpha 多样性和菌群结构,基本完成了在属水平上筛选特定的病原菌,包括葡萄球菌属、支原体属、棒状杆菌属及假单胞菌属。
本研究通过预实验和完整实验,完成了对各步骤反应条件的探索和优化,包括引物的特异性和扩增条件的选择以及高通量测序数据的处理,结果能够使研究人员在需用实验小鼠作为科研对象时,预先了解SPF 级实验小鼠肠道的菌群结构和组成,有助于实验结果的分析和重复,尤其是需要大批量的SPF 级实验小鼠时。本研究为有针对性地设计筛选实验动物肠道内容物特定病原体实验提供了一种新方法,并适合大样本量的筛查(本方法已申请专利,专利号201710924382.0)。在属水平上,本研究在所有样本中检测到了葡萄球菌属、假单胞菌属、支原体和棒状杆菌属,但丰度均相对较低。经高通量测序筛查后,在属水平上检测为阳性的样本,还需要进一步用PCR 检测来再次确定是否含有特定菌种。目的病原菌中涉及到的鼠棒状杆菌、牛棒状杆菌、金黄色葡萄球菌以及铜绿假单胞菌均需在种水平上确定其有或无。本研究还发现,ICR 品系小鼠中样本33~36 表现为以变形菌门(Proteobacteria)为优势菌群,与之相一致的是在属水平上Enterobacteriaceae_unclassified 丰度较高,而同样来源于ICR 品系的小鼠52 号样本,其肠道内容物则以厚壁菌门(Firmicutes)为优势菌群。以上5 个样本与本实验中其他ICR 品系小鼠相比较,OTU 聚类在门水平上的样本序列有明显差异。由此提示,即使饲养环境和条件相同,相同品系的SPF 级实验小鼠肠道菌群在物种组成、丰度及Alpha 多样性方面也会表现出显著差异。越来越多的研究已经关注实验动物肠道微生态环境对其所应用研究范围实验结果可重复性的影响。尽管实验动物的肠道菌群在饲养和管理过程中受诸多因素的影响,由于很难使其标准化,人们仍致力于研究各种方法使实验动物的肠道菌群在可控和可监测范围内[3]。对于SPF 级实验小鼠的微生物项目的监测,本研究建立的方法可以快速提供实验小鼠的肠道菌群组成、丰度、Alpha 多样性指数及种属筛查结果,提高实验动物用于进一步实验的准确率和可重复性,尤其适合较大样本微生物项目的筛选、监测。按照《实验动物微生物学等级及监测(GB 14922.2-2011)》的微生物检测项目的要求[17],本研究因初次尝试,存在诸多条件限制,只检测了上述国家标准中的部分项目,其余项目会在后续实验中展开。
总之,本研究首次使用高通量测序技术分析了SPF 级实验小鼠回盲部肠道内容物的菌群结构及组成,为提升实验动物微生物检测水平,进一步补充完善我国实验动物质量控制体系提供更精确的研究手段,并为生产高质量的SPF 级实验小鼠提供实验依据。
