单纯IgA肾病与IgA肾病合并糖尿病患者循环免疫复合物的功能差异性探索研究
2020-04-27翟亚玲龙晓青高静歌赵占正
翟亚玲 ,龙晓青 ,高静歌 ,卢 珊 ,赵占正 *
IgA肾病(IgA nephropathy,IgAN)是由国外学者BERGER等[1]首次提出,以免疫荧光下肾小球系膜区以免疫球蛋白A(IgA)沉积为主要特点的原发性肾小球疾病,也是目前世界范围内最常见的原发性肾小球疾病之一[2]。其起病隐匿,主要累及青壮年,也见于儿童和老年人。自IgAN发病20~30年,有30%~40%的患者进入肾脏病终末期,从而需要肾脏替代治疗(血液透析,腹膜透析,肾移植),给患者及其家庭带来沉重的负担,提示IgAN研究的重要性[3]。
IgAN的确诊依据肾组织活检,病理特征多样,如系膜细胞增生,系膜基质增加,间质纤维化以及肾小管萎缩[4],均被认为由肾小球系膜区的循环免疫复合物(CIC)沉积所引起,CIC的组成部分至今仍不十分清楚。据既往研究,IgAN机制研究的主流学说“四重打击学说”[5],认为含有IgA的CIC是导致肾脏损伤的关键步骤,此外,许多研究人员证明了可溶性CD89、纤维连接蛋白以及谷氨酰胺转氨酶可以与IgA结合形成大分子,并参与IgAN的发病[6-8],但CIC的具体成分复杂,仍未完全清楚。
近年来,糖尿病(DM)发病率逐年升高,成为困扰国民健康的重大难题。DM是肾病患者进入终末期最重要的因素[9]。根据既往研究结果,原发性IgAN在DM患者的非糖尿病肾脏病变中最为常见[10],然而,单纯IgAN患者与IgAN合并DM患者之间是否存在差异,目前尚少见报道。笔者近年研究发现,IgAN合并DM患者与单纯IgAN患者相比,具有不同的临床和病理特征以及预后[11]。基于此,本研究旨在探索IgAN合并DM患者与单纯IgAN患者之间CIC在系膜细胞中促进增殖和炎性因子分泌能力方面的差异,从而进一步揭示两者之间的关系。
1 对象与方法
1.1 研究对象 选取2017年2月—2018年2月在郑州大学第一附属医院就诊并行肾脏活检确诊的28例原发性IgAN患者。纳入标准:(1)经肾活检组织病理确诊为原发性IgAN;(2)肾穿刺活检时初始估算肾小球滤过率(eGFR)>15 ml·min-1·(1.73 m2)-1。排除标准:(1)IgAN合并糖尿病肾病;(2)其他非IgAN病变,如膜性肾病、狼疮性肾炎、膜增生性肾小球肾炎等;(3)继发性IgAN,继发于过敏性紫癜、系统性红斑狼疮、类风湿关节炎、强直性脊柱炎、慢性乙型病毒性肝炎等;(4)肾小球数<10个;(5)肾穿刺活检时初始eGFR ≤ 15 ml·min-1·(1.73 m2)-1。
另选取同期本院体检科体检健康者7例为正常组。纳入标准:(1)肝肾功能均无异常;(2)尿检无异常;(3)未见血糖及糖化血红蛋白异常;(4)年龄及性别与IgAN患者及IgAN合并DM患者匹配。本研究通过郑州大学第一附属医院医学科研伦理委员会批准,患者均为自愿参加并签署知情同意书。
1.2 研究方法
1.2.1 分组 根据2011年美国糖尿病协会关于2型糖尿病的诊断标准[12],将28例原发性IgAN患者分为单纯IgAN组(20例)和IgAN合并DM组(8例)。收集IgAN患者的临床资料和病理资料,包括合并高血压、24 h尿蛋白、血肌酐、尿素氮、白蛋白、尿酸、总胆固醇、三酰甘油、C3、C4。并记录牛津分类[13]、球性硬化比例、节段性硬化比例。
1.2.2 CIC提取及测定 收集各组受试者10 ml乙二胺四乙酸(EDTA)抗凝全血,4 ℃条件下以1 000 r/min离心15 min,离心半径7.5 cm,吸取血浆后分装,冻存于-80 ℃备用。采用PEG-6000[14]提取受试者CIC,方法如下:(1)将100 μl的7% PEG-6000溶液和50 μl的0.1 mol/L硼酸盐缓冲溶液加入到100 μl的等离子体中混匀;(2)将其置于4 ℃冰箱中保存24 h;(3)放入离心机中,以3 000 r/min离心30 min,离心半径7.5 cm,弃去上清液;(4)向沉淀中加入500 μl的3.5%PEG-6000溶液,充分混合溶液;(5)重复第三步;(6)将沉淀溶解于100 μl的0.01 mol/L磷酸盐缓冲液(PBS)中,使用BSA蛋白定量试剂盒(北京鼎国昌盛生物科技有限公司)测定CIC。
1.2.3 细胞培养及刺激实验 将人肾小球系膜细胞系(ScienCell,Carlsbad,CA,USA)培养于含10%胎牛血清(美国Gibco)、DMEM/F12(1∶1)培养基(美国Gibco)中,并在37 ℃、含5% CO2环境中生长。(1)铺板:将细胞种植于96孔板中培养24 h,细胞密度维持在2 000~5 000个/100 μl;(2)饥饿处理:采用含0.5%胎牛血清、DMEM/F12(1∶1)培养基饥饿处理18 h;(3)刺激:加入上述步骤提取的CIC,使刺激终浓度为 20 μg/ml,刺激 24 h。
1.2.4 肾小球系膜细胞增殖能力检测 使用CCK-8试剂盒(Med Chem Express,New Jersey,USA),按照说明书步骤检测CIC刺激后系膜细胞的增殖能力,通过酶标仪进行吸光度测量并记录OD值。
1.2.5 酶联免疫吸附试验(ELISA)法检测上清液白介素6(IL-6)、趋化因子配体1(CXCL-1)水平 收集各组细胞培养上清并离心,弃管底沉淀,分别按照商品化ELISA试剂盒(R&D,Minnesota,USA)的说明书步骤检测细胞培养上清液IL-6及CXCL-1水平。
1.3 统计学方法 采用SPSS 20.0软件进行统计学处理,符合正态分布计量资料以(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用q检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用非参数检验;计数资料的分析采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 28例IgAN患者中男14例,女14例;平均年龄(36.0±14.9)岁;15例(53.6%)合并高血压;24 h尿蛋白为1.91(1.05,5.15)g/d,血肌酐为82(66,122)μmol/L,尿素氮为 5.88(4.15,7.35)mmol/L,白蛋白为35.0(26.7,39.6)g/L,尿酸为(314±116)μmol/L,总胆固醇为5.07(4.38,6.25)mmol/L,三酰甘油为1.25(1.05,2.60)mmol/L,C3为 1.11(0.98,1.45)g/L,C4为0.28(0.42,0.72)g/L;牛津分类中,存在系膜细胞增生(M1)4例(14.3%),存在内皮细胞增生(E1)9例(32.1%),存在节段性硬化或粘连(S1)15例(53.6%),T0 16例(57.1%),T1 5例(17.9%),T2 7例(25.0%),C0 12例(42.9%),C1 10例(35.7%),C2 6例(21.4%);球性硬化比例为0.22(0.09,0.41),节段性硬化比例为0.05(0,0.11)。7例正常者,男4例,女3例;平均年龄(35.1±11.4)岁。
2.2 两组患者临床和病理特征比较 单纯IgAN组和IgAN合并DM组性别、年龄、高血压、24 h尿蛋白、血肌酐、尿素氮、白蛋白、尿酸、总胆固醇、牛津分类中M1、S1、T分类、C分类、球性硬化比例、节段性硬化比例比较,差异均无统计学意义(P>0.05);单纯IgAN组三酰甘油、C3、C4水平低于IgAN合并DM组,牛津分类中E1比例高于IgAN合并DM组,差异均有统计学意义(P<0.05,见表1)。
2.3 三组CIC刺激系膜细胞增殖水平比较 正常组OD值为(0.77±0.13),单纯IgAN组为(1.08±0.18),IgAN合并DM组为(0.85±0.14),三组OD值比较,差异有统计学意义(F=11.921,P<0.001);其中单纯IgAN组OD值均高于正常组和IgAN合并DM组,差异有统计学意义(P<0.05);IgAN合并DM组和正常组OD值比较,差异无统计学意义(P=0.250)。
2.4 三组肾小球系膜细胞分泌炎性因子能力比较三组IL-6、CXCL-1水平比较,差异均无统计学意义(P>0.05,见表 2)。
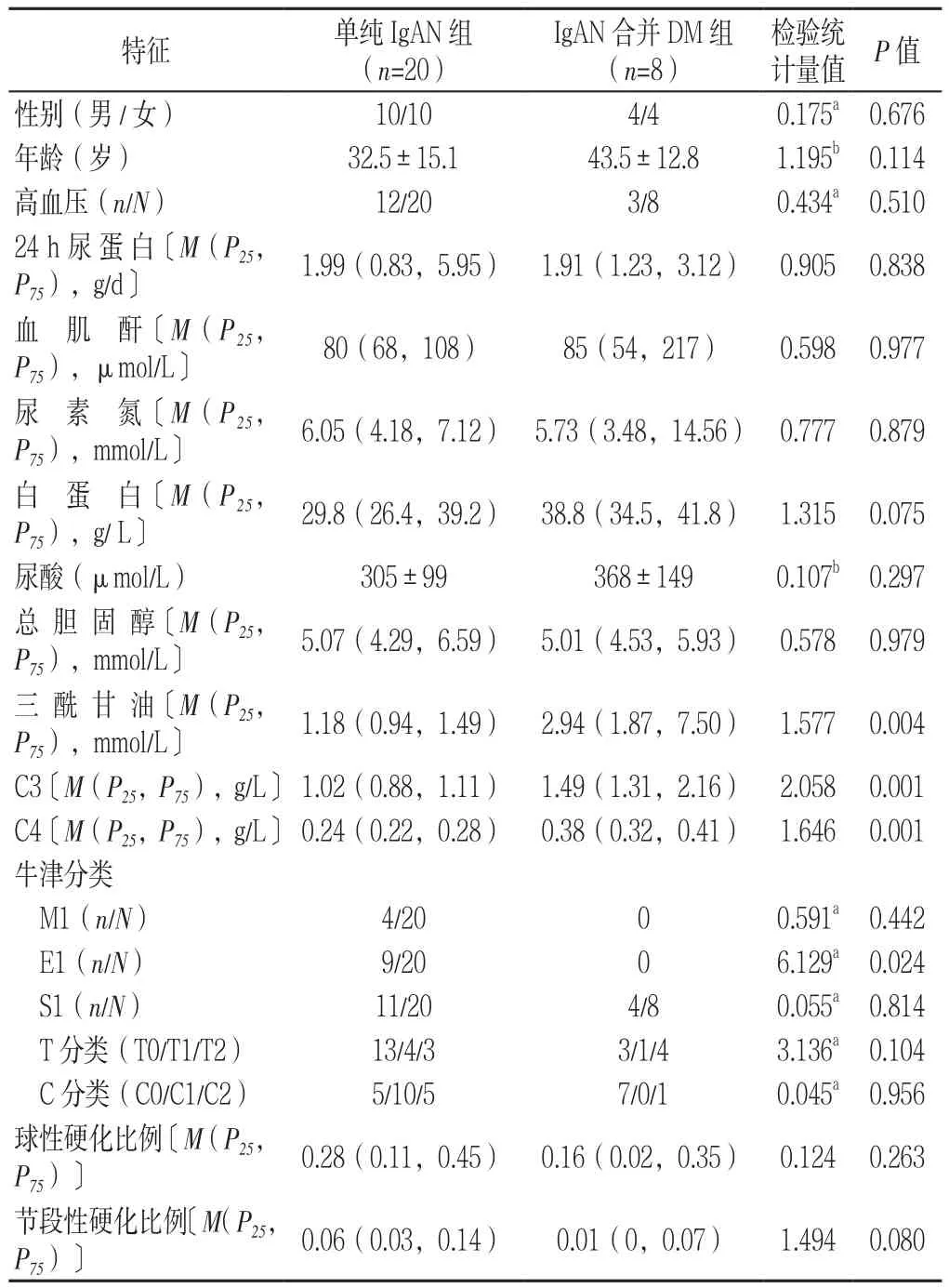
表1 单纯IgAN组和IgAN合并DM组临床和病理特征比较Table 1 Comparison of clinical and pathological characteristics between IgAN group and IgAN combined with diabetes group
表2 三组IL-6、CXCL-1水平比较(±s,ng/L)Table 2 Comparison of levels of IL-6 and CXCL-1 among three groups
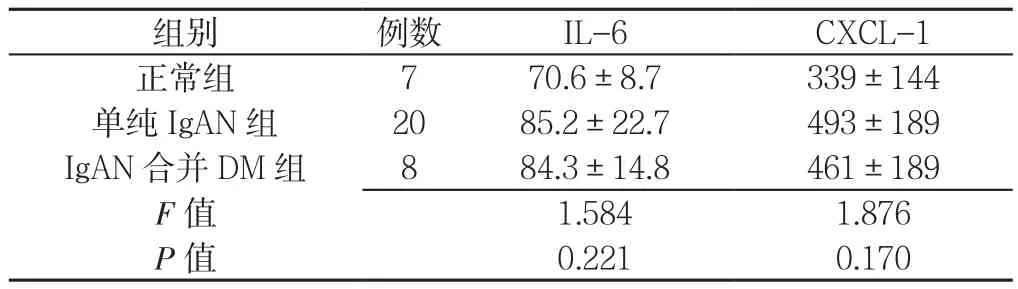
表2 三组IL-6、CXCL-1水平比较(±s,ng/L)Table 2 Comparison of levels of IL-6 and CXCL-1 among three groups
注:IL-6=白介素6,CXCL-1=趋化因子配体1
组别 例数 IL-6 CXCL-1正常组 7 70.6±8.7 339±144单纯IgAN组 20 85.2±22.7 493±189 IgAN合并DM组 8 84.3±14.8 461±189 F值 1.584 1.876 P值 0.221 0.170
3 讨论
目前,患有DM的IgAN患者并不罕见,然而,糖尿病肾病的发生和发展是一个缓慢的过程,通常需要5年或更长时间,因此患有DM的IgAN具有较长病程的疾病状态。与原发性IgAN相比,疾病表现和机制有何不同?这是本研究所致力于探讨的内容。
首先,本研究发现IgAN合并DM组患者血清三酰甘油、C3、C4水平较高,而E1所占比例较低,提示两组患者之间的差异除了临床表现,病理方面也存在少许不同,与笔者既往研究结果一致[11]。
IgAN的发病机制尚不完全清楚,但许多研究表明该疾病的起点是CIC沉积在系膜区域,促进系膜细胞增殖和炎性因子的释放[15-16]。糖尿病肾病患者在肾脏早期无明显的病理表现,但代表性的K-W结节甚至硬化小球将在后期出现。TUTTLE[17]和LIU等[18]相信糖尿病肾病是一种由代谢紊乱引起的炎性疾病。早期炎性因子和促炎因子的大量产生参与并促进糖尿病肾病的发生和进展,如IL-6、CXCL-1,引起单核细胞和巨噬细胞的浸润,最后进展为系膜细胞增殖,肾小球硬化,肾小管和间质纤维化等。基于以上理论,本研究比较了三组CIC对人肾小球系膜细胞的刺激作用。结果表明,来源于原发性IgAN的CIC刺激肾小球系膜细胞增殖能力更强,但原发性IgAN和IgAN合并DM患者在促进肾小球系膜细胞分泌炎性因子方面无差异。
既往研究多是关于患有糖尿病肾病的IgAN患者[19],并不是针对IgAN合并没有进展为糖尿病肾病的DM患者。考虑到原发性IgAN和DM患者的发病年龄不重叠,DM患者常有明显的代谢紊乱,IgAN合并DM患者与仅患IgAN的患者相比具有独特的表现:血清中较高的三酰甘油和C3、C4水平,以及较低的E1比例。本研究中,虽然相同水平的CIC刺激了肾小球系膜细胞,但提取CIC的成分比较粗糙,并不单一,不仅包括IgAN免疫复合物,还包括其他大分子物质;并且在不同的个体中,异常糖基化IgAN铰链区的糖基化位点和比例也不尽相同[20-21]。根据本研究的结果,提取自IgAN合并DM患者的CIC中可能存在一些其他的物质,进而导致两组IgAN免疫复合物总量不同,并最终可能导致对系膜细胞促增殖能力的差异。
本研究具有一定的局限性,提取CIC的方法简单粗糙,提取的CIC成分并不明确,需要在更大的队列中进行验证。总之,IgAN合并DM患者的CIC促进肾小球系膜细胞分泌炎性因子的能力与单纯IgAN相当,但促进肾小球系膜细胞增殖的能力相对较差,表明CIC的成分在两组中可能不同,进而导致临床病理表现不一样,值得进一步探索。
作者贡献:翟亚玲进行文章的构思与设计,研究的实施与可行性分析;龙晓青进行数据收集,实验及数据整理,统计学处理,结果的分析与解释;翟亚玲、龙晓青撰写论文;高静歌、卢珊进行论文的修订;龙晓青、卢珊负责文章的质量控制及审校;赵占正对文章整体负责,监督管理。
本文无利益冲突。
