全身麻醉下盲肠切除术后小鼠空间学习记忆能力下降的中枢炎症机制
2020-04-27杨潇潇靳溪源王清秀孙爱莲蔡红苗
杨潇潇, 靳溪源, 王清秀, 原 源, 姚 寒, 周 辰, 孙爱莲, 蔡红苗
(1. 同济大学附属东方医院麻醉科,上海 200120; 2. 苏州大学附属第二医院麻醉科,江苏 苏州 215004)
围手术期神经认知障碍(perioperative neuroco-gnitive disorders, PND)是指患者术前、术后的认知功能损害或改变,涵盖了以往临床所说的术后认知功能障碍[1]。PND是老年患者围术期常见并发症,有文献报道,60岁以上非心脏大手术出院患者中PND发生率高达41.1%,18~39岁患者中PND的发生率也有36.6%,而60岁以上患者在出院3个月后,患病率仍有12.7%[2]。目前,PND的发生机制中,中枢神经系统炎症反应学说得到了广泛的认可[3]。手术创伤引起固有免疫激活,发生神经炎症反应,致各功能脑区损伤,最终引发PND[4]。转化生长因子激酶1(TAK1)是丝裂原激活蛋白激酶激酶激酶(MAP3K)家族成员之一,它是经典炎症通路中的一个重要环节[5],活化的TAK1引起下游MAPKs家族(JNK、ERK和p38MAPK等)和NF-κB通路激活,最后引起大量炎症因子的释放[6]。中枢神经系统TAK1基因可作为一种中枢炎症发生的标志物,它的表达在中枢神经系统炎症反应中有着关键作用[7]。本研究通过在8~9月龄的C57BL/6小鼠上通过腹部手术构建空间记忆能力减退的小鼠模型,观察手术后脑区小胶质细胞变化与TAK1表达水平改变,探究在PND发生发展中空间记忆能力减退的中枢机制。
1 材料与方法
1.1 实验动物分组与处理
8~9月龄野生型C57BL/6J小鼠,随机分为手术组和对照组,行为学实验和免疫组织化学实验选择相同年龄段的小鼠进行比较。手术组小鼠在异氟醚吸入下行剖腹盲肠切除术,对照组不接受麻醉及手术处理。
1.2 PND模型
小动物麻醉机连接空气泵,异氟醚吸入浓度2.1%诱导5min后将小鼠取出,固定在操作台上,通过自制面罩维持麻醉,异氟醚浓度为1.5~2.0%。小鼠腹部剃毛备皮,聚维酮碘剂消毒。于小鼠腹部正中剑突下1cm左右处1~1.5cm行腹部正中纵形切口,逐层分离肌层到达腹膜,小心划开腹膜,镊子分离肠管并取出盲肠,在其距尾端0.8~1cm处用5-0丝线结扎盲肠,切除远端盲肠,用5mL生理盐水和棉签清除盲肠残端残渣并冲洗,确切止血和扎紧后回纳肠管。逐层缝合腹膜、肌层和皮肤。再次消毒切口区域后,皮下注射0.25%布比卡因(10mg/kg)。擦干小鼠,停止麻醉,待其苏醒后,放回干净的鼠笼。手术总时长20min左右。
1.3 行为学实验
水迷宫(morris water maze, MWM)是一种世界范围内被广泛认可的研究空间学习记忆的行为学实验方法,可以反映小鼠完成空间导航任务的能力。而此种能力与海马尤其是海马的CA1区功能密不可分[8]。因此可以利用水迷宫实验来反映手术创伤对实验动物空间能力的影响[9]。从处理后第2天起每天对小鼠进行4次训练,每次将小鼠面朝池壁放入水中,放入位置随机选取除平台所在象限及平台正对面的“0”点位置外,另外所标4个象限中的任意一个,每次训练换不同的点放入。记录动物找到水下平台的时间(s)。4次训练结束后将小鼠移出擦干。连续训练5d,每天4个放入点的先后顺序各不相同。第6天即术后第7天,将平台撤除,将小鼠从平台正对面的“0”点放入,开始60s的探查训练,见图1。记录小鼠在原平台区,目标象限(原平台所在象限)所花的时间和进入该象限的次数,以此作为空间记忆的检测指标。
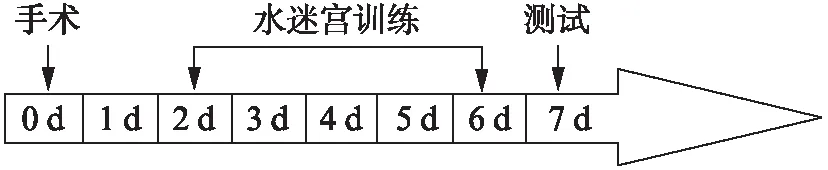
图1 水迷宫实验流程图Fig.1 Water maze experiment procedure
1.4 Western印迹法检测
将小鼠脱颈处死,依次取出海马,前额叶皮层、以及纹状体脑组织。加入相应体积裂解液(Pierce@RIPA Buffer, Thermo, #89901),充分匀浆。室温下倒置混匀3min,4℃离心(离心半径10cm,12000r/min,15min),取上清液,BCA蛋白分析试剂盒进行蛋白定量。使用10%Bis-Tris凝胶电泳,转膜,5%BSA蛋白封闭液室温封闭1h。一抗(GAPDH 1∶2000,TAK1 1∶500),4℃ 孵育过夜。孵育结束后用1×TBST缓冲液充分洗膜10min×3次。将辣根过氧化酶(HRP)偶联的IgG作为二抗加至膜上(稀释比例为1∶2000),室温孵育2h,充分洗膜,暗室曝光,显影,采集图像。Western印迹法蛋白量灰度值使用Image J软件进行分析。
1.5 免疫荧光染色
100mg/mL 10%水合氯醛腹腔注射麻醉小鼠后,经左心室灌注PBS冲净血液,使用4%PFA灌注固定。灌注结束后剥出鼠脑置于4%PFA中于4℃固定过夜。次日,30%蔗糖脱水,4℃冰箱放置24~48h。待鼠脑沉降后用OCT包埋成块,保存于-80℃,切片。将脑片在95℃水浴锅中用抗原修复液(枸橼酸缓冲液)修复5~6min,PBS充分漂洗,滴加BSA稀释的兔抗小鼠Iba1抗体(ionized calcium binding adapter molecule 1, Iba1 1∶1000),4℃ 孵育过夜。室温下孵育二抗生物素化马抗兔抗体IgG(1∶ 500)2~3h,PBS充分冲洗后,滴加cy3荧光标记的三抗,室温避光孵育1h。描片,75%甘油封片,荧光显微镜(尼康株式会社,日本Eclipse 80i)下观察、拍照。每只小鼠选取3张20×放大倍数的层面相同的脑片,对不同脑区中,小胶质细胞数量进行计数,并统计小胶质细胞胞体的大小,进行统计学分析,见图2。
1.6 统计学处理
2 结 果
2.1 全身麻醉下盲肠切除术后早期各脑区小胶质激活
分别统计术后3、7、15d时,观察以下区域20倍物镜下每视野中的小胶质细胞数量并与对照组进行比较。观察区域包括海马3个分区[海马CA1(cornu ammonis 1, CA1),海马CA2/3(cornu ammonis 2/3, CA2/3),海马齿状间(denote gyrus, DG)],纹状体(corpus stratun, CPu)和前额叶皮层(prefrontal cortex, PFC),见图2。统计结果如图3所示,术后3d 时,海马3个分区(CA1,CA2/3,DG)、纹状体(CPu)以及前额叶皮层(PFC)中,小胶质细胞数量均显著升高(PPFC=0.0182,PCA1=0.0273,PCA2/3=0.0101,PDG=0.0077,PCPu=0.0046,n=3),术后7d时,海马CA2/3,DG区、纹状体(CPu)以及前额叶皮层(PFC)中,小胶质细胞数量较术后3d时显著下降(PPFC=0.0192,PCA2/3=0.0321,PCPu=0.0187,PDG=0.0282,n=3),与对照组差异无统计学意义(PPFC=0.8487,PCA2/3=0.9564,PCPu=0.1223,PDG=0.2508,n=3)。术后15d,各脑区小胶质细胞数量均降至与对照组差异无统计学意义(PPFC=0.1502,PCA1=0.4409,PCA2/3=0.7843,PDG=0.8412,PCPu=0.9268,n=3)。
术后3d时前额叶皮层(PFC),海马CA2/3区和纹状体区域(CPu)小胶质细胞胞体显著增大(PPFC<0.0001,PCA2/3<0.0001。PCPu<0.0001,n=3),并在术后15d恢复至术前水平。海马CA1区小胶质细胞胞体大小较对照组未发生明显改变,而DG区小胶质细胞胞体在术后7d增大(PDG=0.0023),于术后15d恢复,见图4。
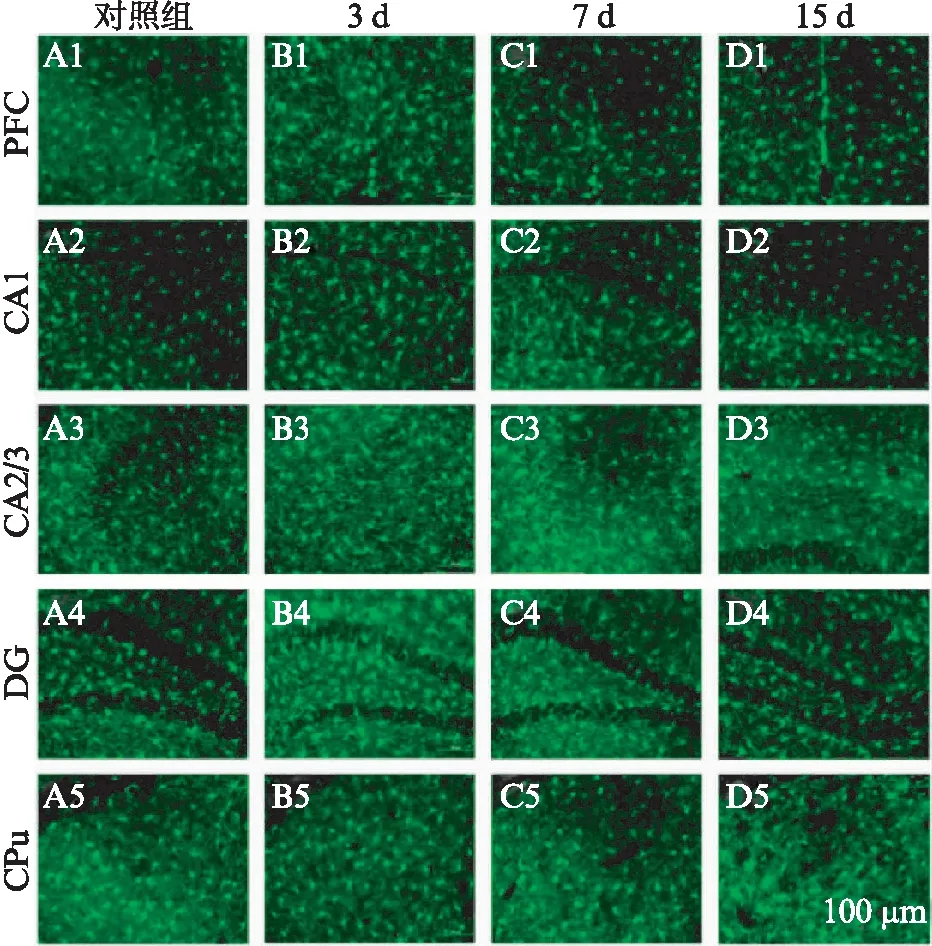
图2 各组小鼠不同脑区Iba1免疫荧光染色Fig.2 Immunocytochemical staining of Iba1+ cells in brain areasA1~A5: 对照组小鼠前额叶皮层(PFC),海马DG区,CA1区,CA2/3区,纹状体(CPu)Iba1免疫荧光染色;B1~B5: 术后3d小鼠PFC,海马DG区,CA1区,CA2/3区,CPu等区Iba1免疫荧光染色;C1~C5: 术后7d小鼠PFC,海马DG区,CA1区,CA2/3区,CPu等区Iba1免疫荧光染色;D1~D5: 术后15d小鼠PFC,海马DG区,CA1区,CA2/3区,CPu等区Iba1免疫荧光染色

图3 各组小鼠不同脑区小胶质细胞数量Fig.3 Count of microglia number in brain areas*P<0.05,**P<0.01,n=3
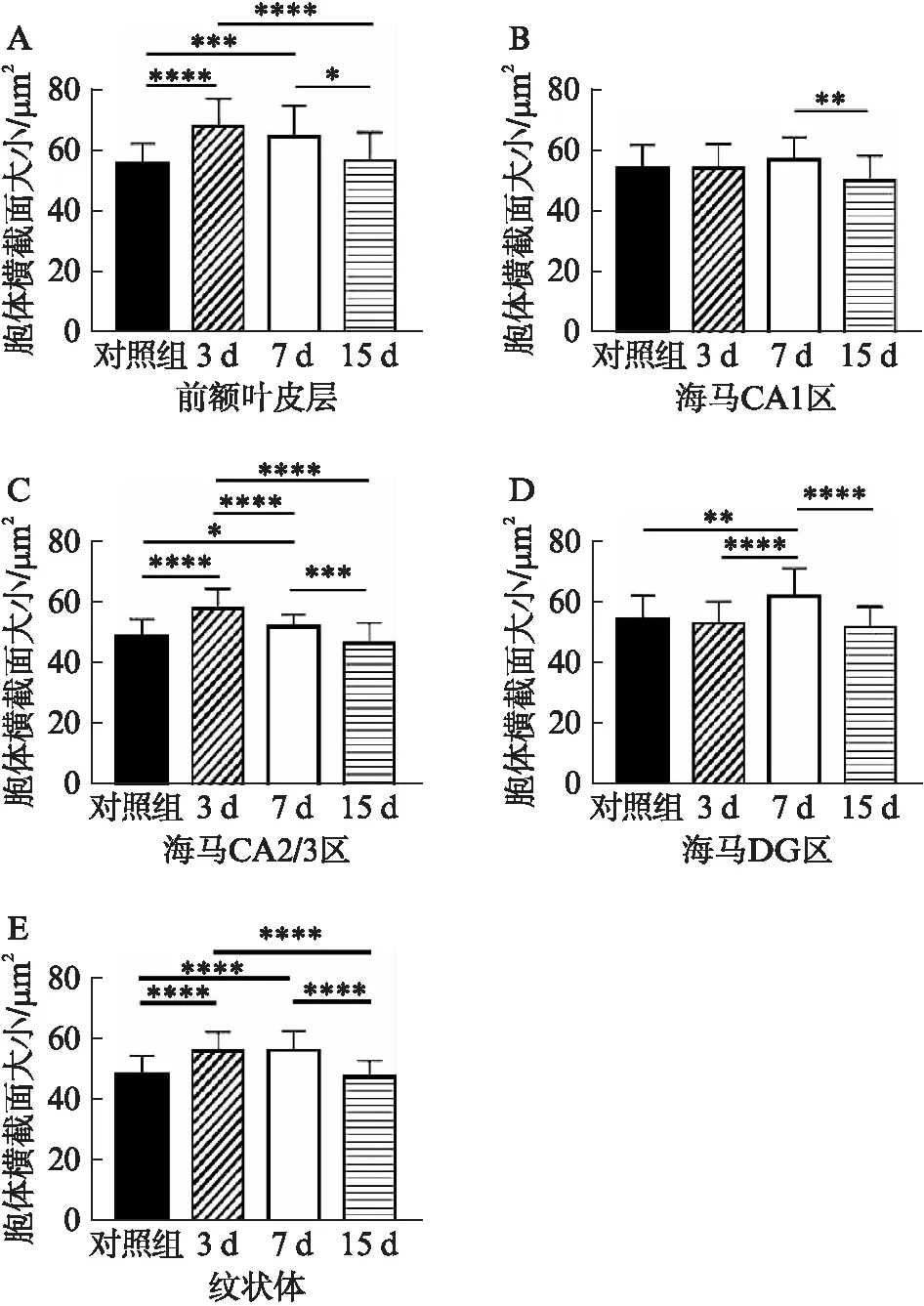
图4 各组小鼠不同脑区小胶质细胞胞体大小Fig.4 Detection of microglia body size in brain areas*P<0.05,**P<0.01,***P<0.001,****P<0.0001,n=3
2.2 全身麻醉下盲肠切除术后早期海马及前额叶皮层炎症相关蛋白TAK1表达上调
为检测吸入麻醉下盲肠切除术后TAK1蛋白表达,本研究采用8~9月龄小鼠,行腹部手术造模后,分别于术后3、7、15d将小鼠处死取材,分离海马组织和前额叶皮层组织进行Western印迹法检测。采用同月龄未经手术处理的C57BL/6J小鼠作为对照,每组6只。
盲肠切除术后3d,相较于对照组小鼠,手术组前额叶皮层(PFC)TAK1蛋白含量显著升高(PPFC=0.0025,n=6),在海马脑区(hippo campus, Hippo)呈现上升趋势,但差异无统计学意义(PHippo=0.173633186,n=6),术后7d时,海马和前额叶皮层TAK1蛋白的含量均较3d时显著下降(PHippo=0.0162,PPFC=0.0002,n=6),恢复至术前水平,与对照组差异无统计学意义(PHippo=0.4969,PPFC=0.3374,n=6),见图5。

图5 各组小鼠不同脑区TAK1蛋白含量Fig.5 Detection of the expression of TAK1 by Western blotting*P<0.05,**P<0.01,***P<0.001,n=6
2.3 手术对小鼠空间记忆的影响
为检测吸入麻醉下盲肠切除术后小鼠的空间学习记忆能力改变,本研究采用8~9月龄小鼠,行腹部手术造模作为手术组。采用同月龄未经手术处理的C57BL/6J小鼠作为对照,每组10只。
水迷宫的训练统一从术后的第2天开始,持续5d;术后第7天进行水迷宫的测试,结果提示,术后第2天即水迷宫训练的第1天(D1),手术组比对照组耗费了更多的时间找到平台: 对照组找到平台时间TC=(43.93±1.821) s,手术组找到平台时间 TS=(56.47±0.963) s,PC-S=0.0357,提示手术组小鼠术后出现空间记忆能力减退,见图6A。而在之后几天的训练中,这种差异逐渐缩小。测试阶段,手术和对照组小鼠在游泳的总距离、平均速度和穿越平台区域的次数差异均无统计学意义,具体数据如下: 总距离DC=(1156±106.5) cm,DS=(1223±51.54) cm,PC-S=0.5661,PC-M=0.2833,n=10;平均速度VC=(19.29±1.769) cm/s,VS=(20.39±0.855) cm/s,PC-S=0.5615,n=10;穿越平台区域的次FC=(2.375±0.461)次,FS=(2.875±0.549)次,PC-S=0.4967,n=10,见图6B、C、D,但对照组小鼠在原平台所在象限所滞留的时间明显比手术组长,提示手术组小鼠的空间记忆能力有一定受损:TC=(24.14±2.442) s,TS=(16.48±2.458) s,PC-S=0.0464,见图6E。
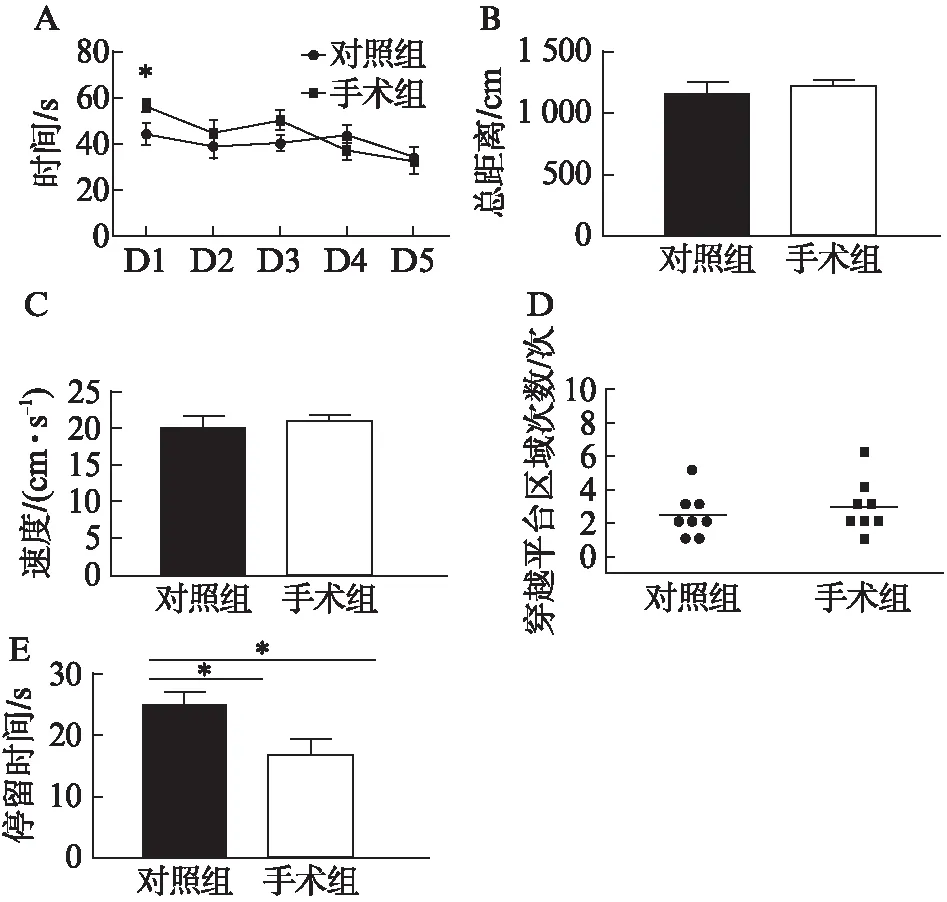
图6 不同处理组小鼠水迷宫测试结果Fig.6 Results of water maze experiment in different groupsA: 各组小鼠水迷宫训练阶段找到平台的潜伏期(横坐标为训练天数);*P<0.05,n=10
3 讨 论
PND主要表现为一系列精神和认知方面的损害和改变,包括记忆力、注意力、空间能力、社会融合能力及理解能力等多个方面[10]。该病常见于老年患者,年龄是PND的独立危险因素,PND的发生率随着年龄增大逐渐增高[11]。实验者也倾向选用月龄较大的小鼠或大鼠作为研究对象[12]。临床上,心脏手术、腹部大手术和骨科手术后PND发生率明显高于其他手术类型[13]。目前,中枢神经系统炎症反应是PND发生机制中一个较为主流的学说,小胶质细胞作为中枢神经系统的固有免疫细胞,是中枢炎症中的主要效应细胞[14]。TAK1是经典炎症通路中的一个重要环节,活化的TAK1引起下游MAPKs家族(JNK、ERK和p38MAPK等)和NF-κB通路激活,最后引起大量炎症因子的释放[15-16]。
本研究中采用水迷宫免疫组化、Western印迹法等手段对全身麻醉下盲肠切除术后小鼠行为学及记忆功能改变,中枢神经系统中炎症相关细胞、炎症相关基因表达进行探究,探寻PND发生发展过程中,引起空间学习记忆能力改变的中枢炎症机制。
在水迷宫实验中,手术组小鼠在旷场中运动的总距离和平均速度与对照组差异并无统计学意义,提示手术及术中麻醉吸入不会对小鼠的运动造成影响,排除了因手术造模导致运动能力出现差异的可能性。本实验中,在术后2d即进行水迷宫训练的第1天(D1),小鼠找到平台均比对照组需要耗费更多的时间。在术后7d天的测试中,2组小鼠穿越原平台位置的次数差异没有统计学意义,但统计发现,对照组小鼠在原平台所在象限停留时间明显比手术组延长。提示术后早期空间学习记忆能力下降。
免疫组化实验结果则表明,与空间学习记忆能力相关的前额叶皮层,海马和纹状体等脑区均有中枢炎症反应的发生,表现为术后3d时小胶质细胞数量升高伴胞体增大,呈现激活态。其中,海马区域的小胶质细胞多在术后7d恢复至术前水平,前额叶皮层和纹状体部位的小胶质细胞在术后15d恢复。提示术后早期学习记忆相关脑区中枢炎症的发生。同时,在盲肠切除术后3d时,海马和前额叶皮层中炎症相关蛋白TAK1表达均有明显升高,术后7d时均恢复至术前水平。
综上所述,异氟醚吸入下盲肠切除术后早期,可以观察到空间学习、记忆相关脑区中,中枢免疫炎症发生,表现为小胶质细胞的活化以及TAK1蛋白的表达上调。其中,海马的炎症改变尤为明显。这些脑区的炎症反应的发生,与其对应的空间能力上的改变一致,即水迷宫实验中手术组小鼠呈现出空间记忆能力下降与其脑区中炎症反应的发生具有同时性。研究结果提示腹部手术后早期,空间学习、记忆能力的损伤或与记忆相关脑区中枢炎症的发生相关。
