杨梅素体外抗 EV71 病毒作用的研究
2020-04-26李文淼
李文淼,张 洋,王 伟
(中国海洋大学医药学院,海洋药物教育部重点实验室,山东 青岛 266003)
肠道病毒71型(enterovirus 71,EV71)是含有约7.4 kb大小单股正链RNA的RNA病毒,属于小RNA病毒科(Picornaviridae)的肠道病毒属[1-2]。EV71是导致5岁以下儿童患手足口病的关键性病毒之一,可感染中枢神经系统,导致严重的危及生命的神经系统疾病,严重时可引起肌痉挛、肺水肿和心肺衰竭等并发症[3]。人类(尤其是儿童)在感染了EV71之后容易引起严重的并发症,发病速度快,死亡率高。据中国国家卫生和计划生育委员会的数据显示,2009~2017年,EV71在中国至少造成17 717 819人感染,3 509人死亡。但目前还没有特别有效的治疗EV71感染导致手足口病的药物。目前只有一种防治手足口病的疫苗正式上市,但是尚未发现有效的抗病毒药物面市。
杨梅素(myricetin)化学名称为3,5,7,3′,4′,5′-六羟基黄酮,又名杨梅树皮素、杨梅黄酮、杨梅酮,属于黄酮类化合物,存在于壳斗科、豆科、报春花科、葡萄科、菊科等植物中。据报道,杨梅素具有很多不同的生物活性,如抗氧化、抗菌、抗血栓、神经保护和抗炎作用[4]。杨梅素已被证明对多种病毒具有抑制活性,如抗小鼠白血病病毒和人类免疫缺陷病毒活性。杨梅素对HIV逆转录酶活性有明显抑制作用,且细胞毒性较低[5]。杨梅素和黄芩苷通过影响ATP酶活性,在体外能够有效地抑制了SARS冠状病毒解旋酶蛋白,提示杨梅素和黄芩苷可能是SARS冠状病毒的有效抑制剂[6]。由此可见,杨梅素具有开发成为新型抗病毒药物的潜力。
但是目前为止,鲜有关于杨梅素抗 EV71 病毒活性的研究报道。因此,本研究探讨了杨梅素是否具有抑制EV71病毒活性,并在此基础上初步探究了杨梅素的体外抗EV71作用机制。
1 材料与方法
1.1 材料
1.1.1药物 杨梅素(529-44-2)从陶素化工有限公司购买(中国上海)。盐酸胍从Sigma公司购买(中国上海)。
1.1.2细胞和病毒 非洲绿猴肾上皮 Vero 细胞在培养基(MEM)中培养,RD细胞在高糖培养基(DMEM)中培养,添加10%胎牛血清(ExCell Bio,中国),1%青霉素(100 kU·L-1),1%链霉素(100 mg·L-1),于37 ℃,5%CO2的细胞培养箱中培养。EV71病毒株BrCr-tr(GenBank号:AB204852.1)来源于中国科学院武汉病毒研究所。病毒在RD细胞中增殖,保存于-80 ℃冰箱,病毒滴度用空斑法和50%组织培养感染剂量法(TCID50)在Vero细胞中测定。
1.1.3试剂 碱性磷酸酶检测试剂盒(P0321)、4%多聚甲醛(P0099)、5%结晶紫染色液(C0121)、5×蛋白上样缓冲液(P0015L)、PMSF(ST505)、RIPA裂解液(P0013B)购从碧云天公司购买,胎牛血清(FSS500)从ExCell Bio公司购买,MEM(1994643)和DMEM 干粉(1931639)从 Gibco公司购买,0.25%胰酶-0.02%EDTA(C125C1)从新赛美生物科技有限公司购买,α-Tubulin(2125S)和β-Actin(3700S)从Cell Signalling Technology公司购买,VP1-EV71抗体(IT-016-007M1)从Inmune Technology Corp公司购买,RNA提取试剂盒(RN28)从Aidlab公司购买,一步法RT-PCR试剂盒(639504)从TaKaRa公司购买。
1.1.4仪器 Ⅱ级B2型生物安全柜(新加坡Esco公司);CO2培养箱(上海力康公司);酶标仪(苏州奥盛公司);蛋白电泳电转设备(美国Bio-Rad公司);倒置相差显微镜(日本 Olympus公司)。
1.2 方法
1.2.1杨梅素对细胞毒性的实验 取Vero细胞(1×108个·L-1)种在96孔板中,至其长满单层,维持液(基本培养基添加1%青霉素(100 kU·L-1),1%链霉素(100 mg·L-1)和0.2%胰酶),用维持液稀释杨梅素(终浓度为200 μmol·L-1、100 μmol·L-1、50 μmol·L-1、25 μmol·L-1、12.5 μmol·L-1),吸去原培养液,将各浓度杨梅素分别加入各孔,设有空白组。在5%CO2培养箱中培养48h,吸去维持液,用4%多聚甲醛固定15min,吸弃,再加入5%结晶紫染色液,37 ℃放置15 min,用自来水冲洗,晾干后用酶标仪测定A540nm值,细胞存活率=试验组A540nm/阴性对照组A540nm×100%。以细胞存活率为50%的药物浓度作为半数细胞毒性剂量(CC50)。
1.2.2CPE抑制实验检测杨梅素不同处理方式下对EV71的抑制作用 用“1.2.1”方法在96孔板中接种细胞并长满单层。分为A、B、C 3组,按照3种不同方式分别加入不同浓度的杨梅素(20 μmol·L-1、10 μmol·L-1、5 μmol·L-1、2.5 μmol·L-1)。I组(Pre+virus):预处理病毒。不同浓度的杨梅素与100TCID50的EV71病毒液在37 ℃培养箱中预先混合1h,随后加入96孔板中,于37 ℃作用1 h,吸弃,加入维持液;Ⅱ组(Adsorption):吸附时加药。药物与100TCID50EV71混合,随后加入96孔板,于37 ℃作用1h,吸弃,加入维持液;Ⅲ组(Post-adsorption) :吸附后加药。在96孔板中加入100TCID50EV71,于37 ℃作用1 h,吸弃,加入含有药物的维持液。每个浓度设有3个复孔,同时设有病毒对照组和空白组。按“1.2.1”方法检测。细胞存活率=(试验组A540nm- 病毒对照组A540nm)/(空白对照组A540nm-病毒对照组A540nm)×100%
1.2.3空斑实验检测杨梅素不同作用方式下对EV71的抑制作用 在12孔板中接种细胞并长满单层。按照“1.2.1”中方法的3种不同方式分别加入杨梅素(20 μmol·L-1);用不同浓度的杨梅素(20 μmol·L-1、10 μmol·L-1、5 μmol·L-1、2.5 μmol·L-1)37 ℃预处理病毒1 h,再于37 ℃作用1 h,吸弃,加入维持液。24 h后收取上清,同时设有阳性药对照、病毒对照组和空白组。
将收取的上清稀释10~106倍,于37 ℃吸附1 h,吸弃,每孔加入配制好的Overlay,待其凝固后,倒扣置于37 ℃培养箱中。待其出斑后,固定染色,用自来水冲洗,空斑计数。
1.2.4空斑减少实验评价杨梅素的直接杀病毒作用 在12孔板中接种细胞并长满单层,用不同浓度的杨梅素(50 μmol·L-1、 25 μmol·L-1、12.5 μmol·L-1)37 ℃预处理病毒1 h,于37 ℃作用1 h,吸弃,每孔加入2 mL配制好的Overlay,待其凝固后,倒扣置于37 ℃培养箱中。待其出斑后,固定染色,用自来水冲洗,空斑计数。
1.2.5Western blot 检测杨梅素对VP1蛋白的抑制作用 在12孔板中接种细胞并长满单层,按照“1.2.4”接种细胞方法的3种不同方式分别加入杨梅素(20 μmol·L-1);用不同浓度的杨梅素(50 μmol·L-1、 25 μmol·L-1、12.5 μmol·L-1)37 ℃预处理病毒1 h,于37 ℃作用1 h,吸弃,加入维持液,同时设有阳性药对照组、病毒对照组和空白组。4 h后吸弃,每孔加入50 μL细胞裂解液(800 μL RIPA裂解液、200 μL 5×蛋白上样缓冲液和10 μL PMSF),在冰上裂解15 min,转移至EP管中,100 ℃下煮15 min,放置于-20 ℃冰箱中备用。
提取的蛋白用BCA蛋白定量试剂盒进行定量,用于后续的SDS-PAGE电泳实验。电泳完之后利用半干转法转移到NC膜上,用 5%的BSA 4 ℃封闭过夜,然后将膜与 1 ∶1 000 稀释的VP1抗体封闭液,37 ℃孵育2 h。用 TBST 漂洗膜 3 次,每次 15 min。再将膜与含 1 ∶ 4 000 稀释的二抗( sc2357CM,Santa Cruz 公司) 封闭液一起37 ℃孵育2 h。TBST 漂洗膜3次,每次15 min。用碱性磷酸酶检测试剂盒显色,拍照后Image J软件处理图像。
1.2.6实时荧光RT-PCR检测杨梅素对VP1的mRNA表达的抑制作用 在6孔板中接种并长满单层,用不同浓度的杨梅素(50 μmol·L-1、 25 μmol·L-1、12.5 μmol·L-1、6.25 μmol·L-1)37 ℃预处理病毒1 h,于37 ℃作用1 h,吸弃,加入维持液,同时设有阳性对照组、病毒对照组和空白组。6 h后用RNA提取试剂盒提取总RNA,在Nanodrop上测定浓度及纯度。按照一步法RT-PCR试剂盒说明书,42 ℃ 5 min, 95 ℃ 10 s, 95 ℃ 5 s,60 ℃ 34 s,在7500 Fast Real-Time PCR System上测定循环数,并计算2-ΔΔct。所用的引物序列为:EV71-VP1(Forward: 5′-GGAGATAGGGTGGCAGATG-3′;Reverse: 5′-CCAATTTCAGCGGCTTGGAG-3′); β-actin(Forward: 5′-CTCCATCCTGGCCTCGCTGT-3′;Reverse: 5′-GCTGTCACCTTCACCGTTCC-3′)。
1.2.7统计学分析 数据分析及绘制统计图表均采用GraphPad Prism 6.0统计软件。数据用表示,各组数据先进行正态性和方差齐性检验,采用t检验比较两组之间的差异。
2 结果
2.1 杨梅素的细胞毒性实验由Fig 1可见,杨梅素在最低浓度(12.5 μmol·L-1)处理时,Vero和RD细胞的存活率接近100%;浓度提高时,对Vero细胞的毒性会比RD细胞大些;在测试高浓度(200 μmol·L-1)时,Vero细胞存活率仍有50%,RD细胞仍有65%左右。经计算,杨梅素对Vero细胞的半数毒性浓度CC50为198.5 μmol·L-1,对RD细胞的CC50为217.2 μmol·L-1。
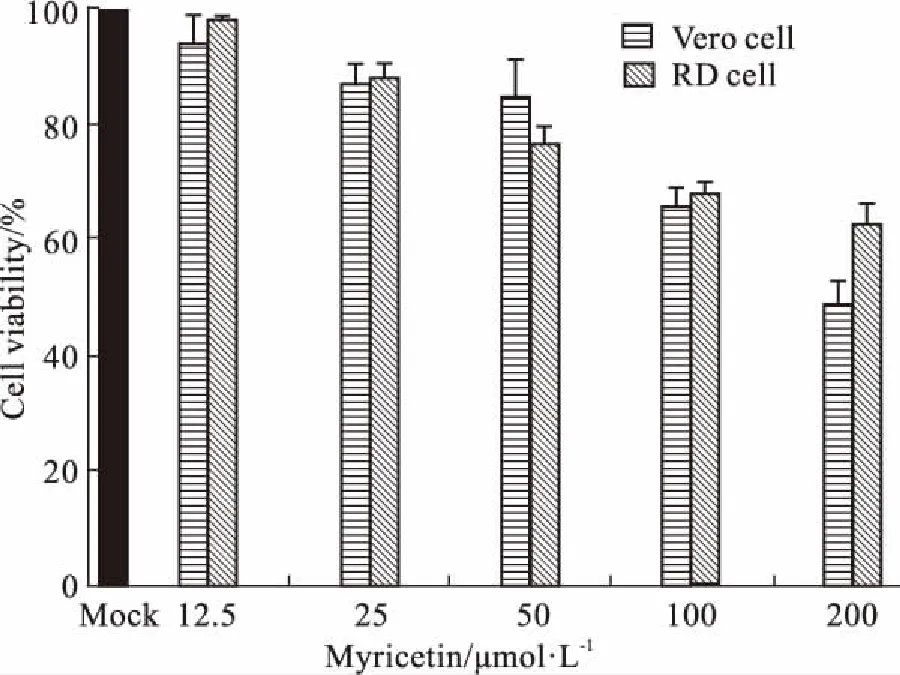
Fig 1 Determination of cytotoxicity of myricetin on
2.2 杨梅素对EV71的抑制实验首先,将不同浓度的杨梅素(2.5~20 μmol·L-1)按照3种不同作用方式与100 TCID50的EV71相互作用,24 h后用观察细胞病变程度,并利用结晶紫染色后测定A540nm值来计算细胞存活率。结果如Fig 2A所示,在Vero细胞中,预处理病毒(Pre+virus),吸附(Adsorption)和吸附后阶段 (Post-adsorption) 加入杨梅素都能够显著提高EV71感染细胞的存活率,其CPE抑制作用呈现明显的剂量依赖性。此外,在RD细胞内,预处理病毒和吸附阶段加入杨梅素也能够显著抑制 EV71 的感染,并具有浓度依赖性,吸附后作用效果略差一些(Fig 2B)。
其次,在EV71感染24 h后收集细胞上清液,利用空斑实验检测病毒滴度来进一步评价杨梅素对于病毒增殖的抑制作用(Fig 3)。Fig 3A的结果表明,与病毒组相比,预处理病毒组(20 μmol·L-1)、吸附时加药组(20 μmol·L-1)、吸附后加药组(20 μmol·L-1),分别将病毒滴度降低了2.56、2.08和0.9 个Log(PFU·mL-1)(P值分别为0.0154、0.0313、0.1633)。
最后,研究还发现杨梅素在20 μmol·L-1、10 μmol·L-1、5 μmol·L-1和2.5 μmol·L-1的浓度下分别将病毒滴度降低了2.78、1.92、1.18和0.11 个Log(PFU·mL-1),(P值分别0.0039、0.0436、0.0992、0.7965)(Fig 3B)。而盐酸胍(1 mmol·L-1)将病毒滴度降低了2.43个Log(PFU·mL-1)(P值为0.0146)。总之,以上结果说明杨梅素在5~20 μmol·L-1浓度下能够显著抑制 EV71 病毒增殖,且预处理病毒和吸附时加药的抑制作用更显著,说明杨梅素可能与病毒有直接相互作用。见Fig 2、Tab 1、Fig 3。
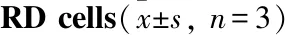
Tab 1 Inhibitory effects of myricetin on Vero and
2.3 空斑减少实验评价杨梅素的直接抗病毒作用上述研究结果表明杨梅素可能与病毒有直接作用,因此我们继续用空斑减少实验来评价杨梅素的直接抗病毒作用。首先将不同浓度的杨梅素按照预处理病毒的方式与100 TCID50的EV71在37 ℃作用1 h后,在Vero细胞吸附1 h后利用空斑试验直接检测。结果如Fig 4所示,杨梅素对EV71有直接的抑制作用,且呈剂量依赖性;在50 μmol·L-1的浓度下,几乎完全抑制病毒感染,在25 μmol·L-1的浓度下效果优于阳性对照盐酸胍(1 mmol·L-1)的作用。因此,杨梅素在高浓度下有直接灭活病毒的作用,再次表明杨梅素能够直接作用于EV71病毒颗粒。
2.4 杨梅素对EV71病毒蛋白表达的抑制作用我们又利用Western blot试验评价了杨梅素对于病毒衣壳蛋白VP1蛋白表达的影响。结果如Fig 5A/C所示,相比病毒对照组(EV71),杨梅素(20 μmol·L-1)预处理病毒和吸附时加药都能够显著降低VP1的蛋白表达水平,而吸附后加药也能够减少VP1的表达,只是较预处理病毒和吸附时加药组效果略差。其次,杨梅素在25 μmol·L-1和50 μmol·L-1浓度时能够显著抑制VP1蛋白的表达,但是12.5 μmol·L-1时抑制作用不明显(Fig 5B/D)。
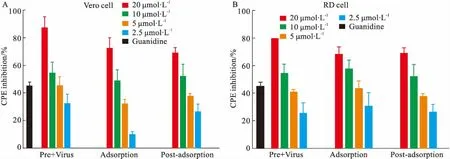
Fig 2 Inhibition of EV71 infection by myricetin in Vero and RD
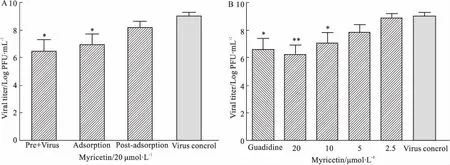
Fig 3 Inhibition of myricetin onviral titer in EV71 infected Vero *P<0.05,**P<0.01 vs virus control.
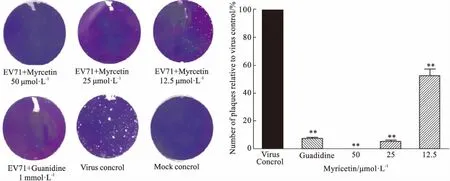
Fig 4 Evaluation of virucidal effect of myricetin by plaque reduction n=3)**P<0.01 vs virus control.
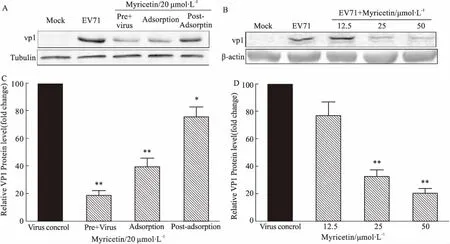
Fig 5 Influence of myricetin on protein expression of virus VP1 n=3)*P<0.05,**P<0.01 vs virus control.
2.5 杨梅素对EV71病毒RNA复制的影响此外,用不同浓度的杨梅素预处理100 TCID50的EV71,在EV71感染Vero细胞6 h后提取RNA,应用RT-PCR 的方法检测VP1蛋白的mRNA 的表达水平。结果如Fig 6所示,杨梅素在12.5~50 μmol·L-1的浓度范围内能够明显降低 EV71 诱导的VP1 的 mRNA 的表达,且呈剂量依赖性。说明杨梅素作用EV71之后明显抑制病毒吸附后的复制过程,这可能与其抑制病毒吸附和进入过程有关。
3 讨论
杨梅素属于黄酮类化合物,具有多种不同的生物活性,如抗氧化、抗菌、和抗炎作用。杨梅素已被证明具有抗病毒作用,如抗HIV-1和SARS冠状病毒活性。但目前为止,关于杨梅素抗 EV71活性的研究尚少。本研究利用Vero和RD细胞模型发现杨梅素能够抑制EV71病毒的体外增殖,并能够降低病毒VP1蛋白的mRNA和蛋白表达水平,提示其具有很好的抗EV71活性。
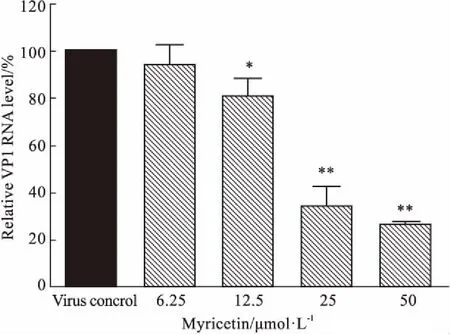
Fig 6 Influence of myricetin on mRNA expression of virus VP1 n=3)*P<0.05,**P<0.01 vs virus control
我们对杨梅素的体外抗EV71作用机制进行了初步探讨,发现预处理病毒和吸附时加药能够显著降低EV71的病毒滴度,减少病毒感染引起的细胞死亡,提示其可能作用于病毒本身。空斑减少实验进一步证明杨梅素能够直接作用于病毒颗粒从而抑制EV71的感染过程。CPE免疫印迹和RT-PCR实验表明吸附后加入杨梅素也能够抑制EV71感染和VP1蛋白的表达,因此杨梅素可能还能够抑制病毒进入或者后续的感染步骤。
综上所述,杨梅素具有很好的体外抗EV71感染作用,其作用机制主要与直接作用于病毒颗粒本身有关,但是具体的分子靶点有待于进一步研究。杨梅素的体内抗EV71作用将会在乳鼠模型上进行进一步验证。
本文研究首次揭示了杨梅素的抗EV71作用,并初步探究了杨梅素的抗EV71作用机制。相关研究表明杨梅素具有开发成潜在抗EV71病毒制剂的潜力,值得进一步深入研究。
