自噬相关蛋白在胃癌中表达的临床意义
2020-04-25王华,李娟
王 华,李 娟
(1.兰州市第二人民医院,兰州 甘肃 730000; 2.兰州市第一人民医院,兰州 甘肃 730000)
根据世界卫生组织 (WHO,world health organization) 的调查,胃癌目前是全球每年肿瘤相关死亡的第4大原因,在2018年,全球有约1 033 701新发病例,其中死亡约782 685例[1]。根治性手术仍然是目前唯一可能治愈的治疗方式,然而胃癌根治术后5年生存率为20%~30%[2],这主要与胃癌发病隐匿,在形态学上很难区分高级别上皮内瘤变与早期胃癌有关,使得早期诊断存在困难[3]。自噬是一种与凋亡相似的生物现象,是存在于真核细胞中的一种进化保守的分解代谢过程,在调节细胞的生存和凋亡,维持细胞内环境稳态等方面起着重要作用[4-5]。越来越多的研究表明,自噬在肿瘤的演进过程中扮演着重要的角色[6-7],自噬发生过程中会出现多种相关分子的变化,识别这些自噬因子将有利于检测自噬的发生。研究采用免疫组化法检测胃癌细胞中雷帕霉素靶蛋白(mTOR)、Beclin1(the beclin1 gene)、丝氨酸-苏氨酸激酶(ULK)、p62蛋白的表达,并探究其表达与胃癌的相关性,同时引入自噬抑制剂雷帕霉素及氯喹,进一步研究自噬在胃癌发生及发展过程中的具体作用。
1 材料与方法
1.1 材料来源
研究收集2019年4月—2019年11月兰州市第二人民医院胃癌组织标本200例,并配对癌旁组织、正常胃组织各200例。所有患者均行胃癌根治术,术前均未接受任何放疗、化疗或其他治疗,所有病例均经病理组织学检查证实。所有研究对象均签署知情同意书,并经过兰州市第二人民医院伦理委员会审核同意。
1.2 免疫组织化学实验方法
实验标本经中性的福尔马林固定,进行常规石蜡包埋,每份标本以4 μm厚度连续切片5份,1份为HE染色以核实诊断,另外4份分别做mTOR、Beclin1、ULK、p62蛋白的免疫组织化学染色,全部病理标本均经病理检查确诊,染色MaxVision 2/HPR试剂盒按说明书进行,用正置荧光显微镜进行观察。结果的判定在双盲下进行,mTOR、Beclin1、ULK、p62表达以细胞质或细胞核出现明显的棕黄色为阳性细胞。
1.3 蛋白免疫印迹实验方法
收集新鲜组织,用PBS洗涤1遍,加RIPA裂解液(RIPA∶PMSF=100∶1),混匀,充分震碎离心后,按照BCA法测定蛋白浓度。经SDS-PAGE分离蛋白,用TBST洗涤3次,每次10 min。将蛋白转印至PVDF膜上,然后取出PVDF膜,放入TBST溶解的5%脱脂奶粉中室温2 h进行封闭。封闭后的膜用TBST洗涤1次,共计10 min,接着4 ℃孵育TBST稀释的抗体mTOR、Beclin1、ULK、p62和内参β-ACTIN过夜,回收一抗,用TBST洗膜3次,每次10 min,孵育二抗(1∶5 000),摇床上常温孵育2 h。使用ECL超敏发光液进行曝光检测,最后采用ImageJ软件对条带进行灰度分析,计算出目的条带与内参条带的灰度值比。
1.4 MTT、Transwell实验
以胃癌细胞株为研究模型,采用自噬抑制剂雷帕霉素和氯喹处理细胞后使用MTT实验检测胃癌细胞的活力,使用Transwell实验检测胃癌细胞的侵袭迁移能力。
1.5 统计学处理方法
应用SPSS16.0软件进行统计学分析,组间比较采用χ2检验然后进行t检验分析。统计mTOR、Beclin1、ULK、p62的表达与胃癌患者的诊断、发生发展、临床病理特征以及预后之间的关系;使用Kaplan-Meier法计算生存率,分析mTOR、Beclin1、ULK、p62的表达与胃癌患者生存率的关系。P<0.05为差异有统计学意义。
2 结果
2.1 各组免疫组化结果及细胞个数
研究采用不同浓度自噬抑制剂雷帕霉素处理细胞后,免疫组化结果如图1所示。0 nmol/L组细胞个数为400个,0.1 nmol/L组细胞个数为318个,1 nmol/L组细胞个数为253个,10 nmol/L组细胞个数为194个,100 nmol/L组细胞个数为126个,如图2所示。

图1 采用不同浓度自噬抑制剂雷帕霉素处理细胞后各组免疫组化结果Fig.1 Results of each group by means of immunohistochemistry after processing cells with different concentrations of autophagy inhibitor rapamycin
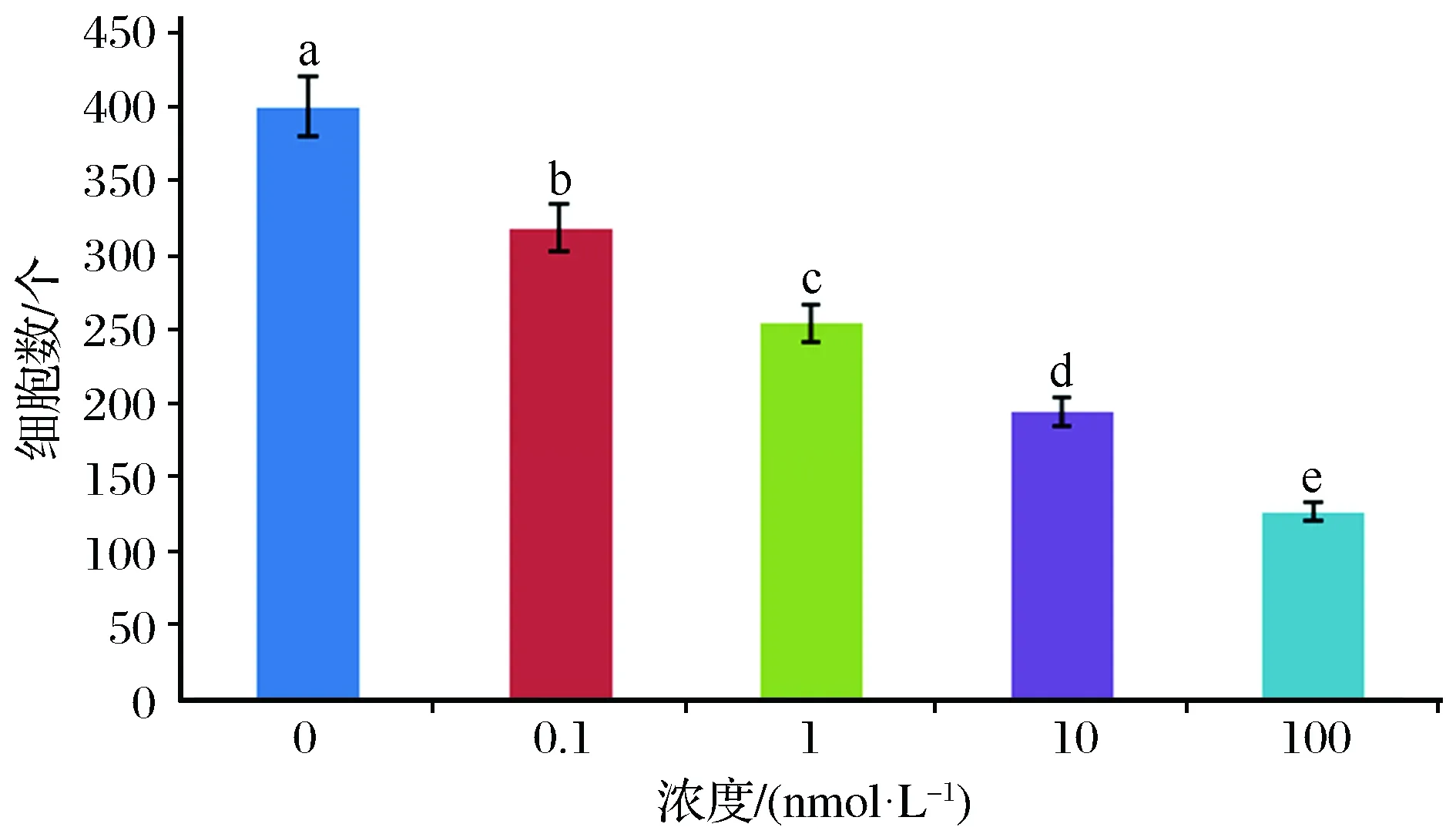
图2 采用不同浓度自噬抑制剂雷帕霉素处理细胞后各组细胞个数Fig.2 Number of cells in each group after processing cells with different concentrations of autophagy inhibitor rapamycin
实验采用不同浓度自噬抑制剂氯喹处理细胞后,免疫组化结果如图3所示。0 μmol/L组细胞个数为369个,5 μmol/L组细胞个数为282个,10 μmol/L组细胞个数为214个,15 μmol/L组细胞个数为103个,20 μmol/L组细胞个数为65个,如图4所示。
2.2 正常、癌旁、肿瘤细胞中各蛋白表达量
胃癌细胞组与癌旁细胞组相比,mTOR蛋白表达率显著降低(p<0.05),Beclin1、ULK、p62各蛋白表达率显著升高(p<0.05),如表1和图5所示。
2.3 胃癌细胞增值抑制率的变化
采用不同浓度自噬抑制剂雷帕霉素处理细胞后,0 nmol/L组、0.1 nmol/L组、1 nmol/L组、10 nmol/L组、100 nmol/L组之间细胞增值抑制率差异有统计学显著性(n=6,F=136.864,P<0.05),如图6所示。

图3 采用不同浓度自噬抑制剂氯喹处理细胞后各组免疫组化结果Fig.3 Results of each group by means of immunohistochemistry after processing cellswith different concentrations of autophagy inhibitor chloroquine
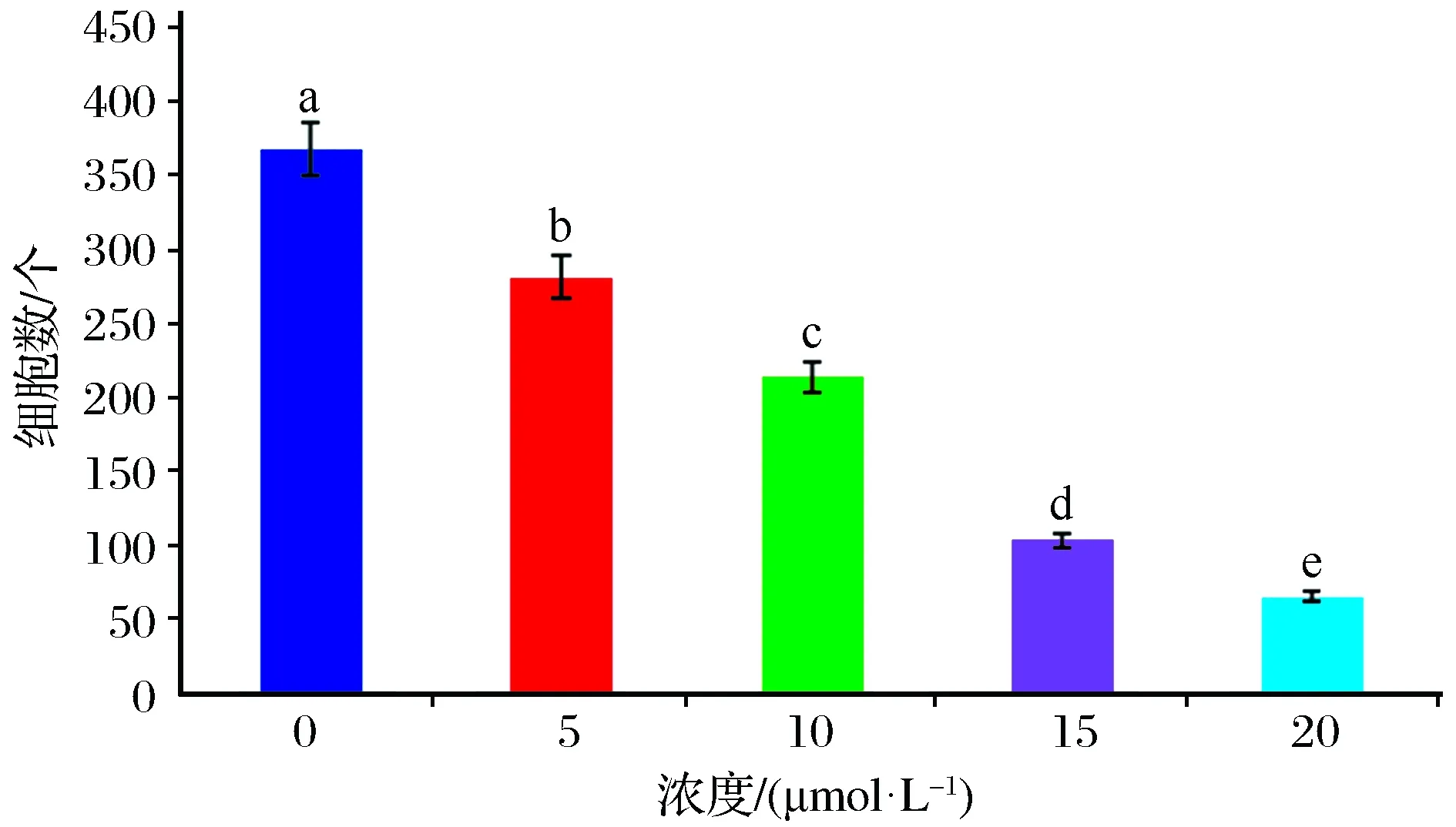
图4 采用不同浓度自噬抑制剂氯喹处理细胞后各组细胞个数Fig.4 Number of cells in each group after processing cells withdifferent concentrations of autophagy inhibitor chloroquine
采用不同浓度自噬抑制剂氯喹处理细胞后,0 μmol/L组、5 μmol/L组、10 μmol/L组、15 μmol/L组、20 μmol/L组之间细胞增值抑制率差异有统计学显著性(n=6,F=1 086.891,P<0.05),如图7所示。
3 讨论
研究结果显示,与癌旁组织及正常组织相比,在胃癌组织中mTOR表达明显降低,ULK、Beclin1、p62的表达显著增高。自噬抑制剂雷帕霉素及氯喹能够显著抑制胃癌细胞的增殖,其作用随着药物浓度的增加而增加。
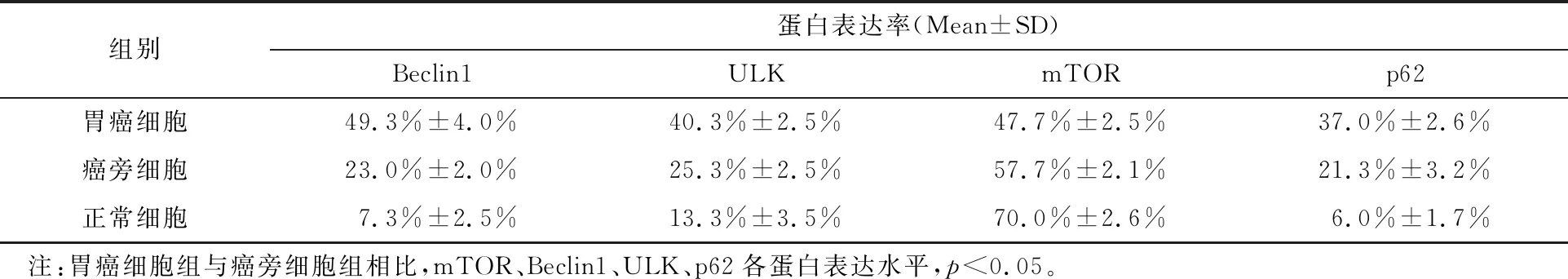
表1 正常细胞组织、癌旁细胞组织和肿瘤细胞组织中mTOR、Beclin1、ULK、p62各蛋白表达率
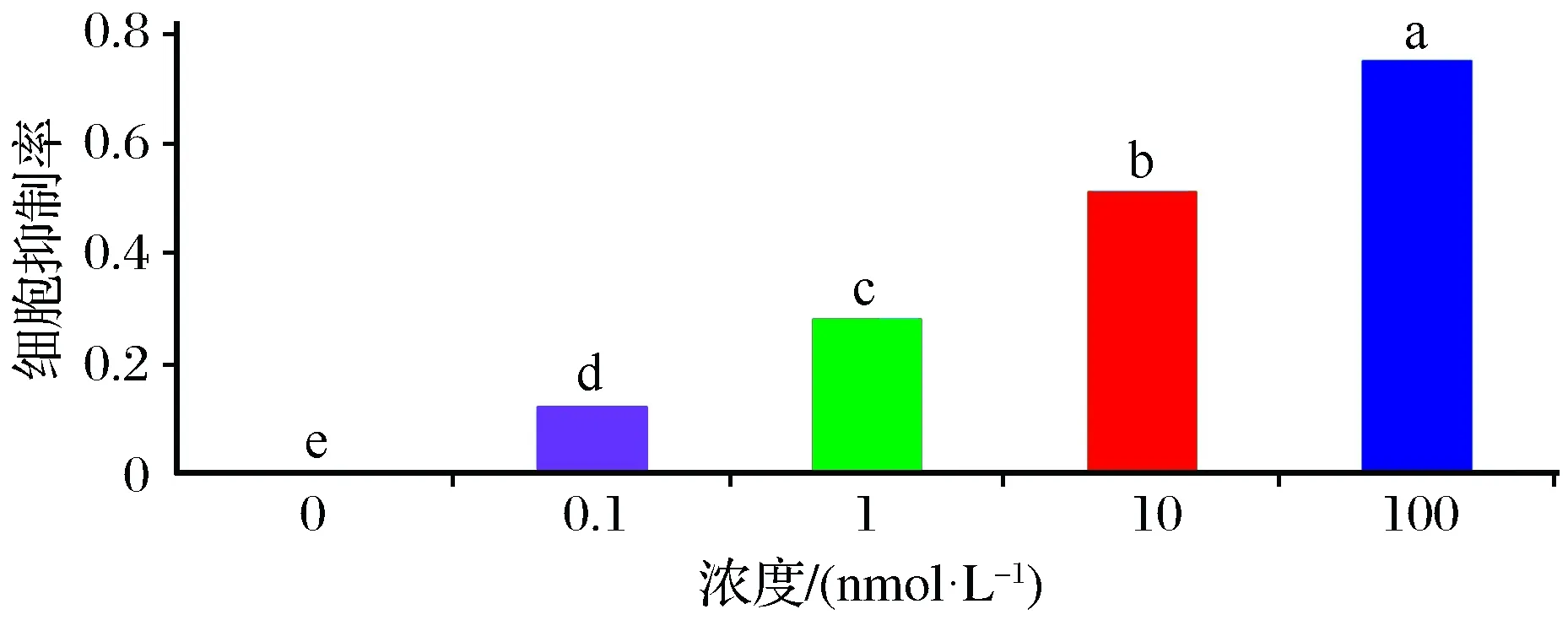
图6 采用不同浓度自噬抑制剂雷帕霉素处理细胞48 h后,各组细胞增值抑制率变化Fig.6 Changes in cell proliferation inhibition rate of cells in each group after processing with different concentrations of autophagy inhibitor rapamycin after 48 hours
自噬相关基因(ATG,autophagy-related genes)是一类进化保守的基因家族,参与自噬调控。Beclin1为ATG6的同系物,被认为是一种是潜在的抑癌基因[8],主要分布在细胞浆内,通过与PI3K 第Ⅲ类激酶 (也称为 Vps34)结合形成Ⅲ型磷脂酰肌醇-3磷酸激(PI3K)复合体参与自噬的起始过程并促进自噬体的形成,是自噬第一阶段不可或缺的基因[9]。Beclin1 可激活自噬过程,是维持细胞自噬活性的关键,而其表达缺失可显著增加肺癌等恶性肿瘤的发生率,多项研究表明,胃癌组织中Beclin1表达显著升高,提示胃癌组织中自噬体活性增高,细胞自噬水平上调。这与研究中胃癌细胞的Beclin1高表达,细胞自噬水平上调有利于胃癌进展的结果一致。相似的研究显示,Beclin1在胃癌组织中的表达水平高于非肿瘤胃黏膜组织,表达水平与肿瘤分级有关,并认为Beclin1是胃癌患者的独立预后因素[10]。
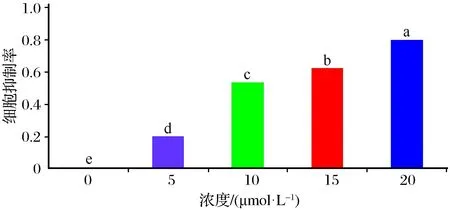
图7 采用不同浓度自噬抑制剂氯喹处理细胞24 h后各组细胞增值抑制率变化Fig.7 Changes in cell proliferation inhibition rate of cells in each group after processing with different concentrations of autophagy inhibitor chloroquine after 24 hours
ULK属于ATG1的同系物,是一种多分子复合物的组成部分,可促进磷酸化并诱导自噬,其与mTOR相互作用从而调节自噬体的形成及其与溶酶体的延伸、融合等过程。细胞自噬过程的激活和抑制受多种细胞信号通路的调控,其中 PI3K/AKT/mTOR 信号通路已被证实是调控自噬的主要信号通路,该通路中的mTOR是调控自噬的重要分子。mTOR 的激活可以抑制 ULK和自噬的相互作用,抑制mTOR 的活性即可诱导自噬的发生。Zhao等[11]认为在上皮内瘤变阶段,mTOR被激活,细胞开始处于活跃增殖状态。伴随肿瘤进展,为适应肿瘤细胞快速生长和代谢需求,mTOR 水平逐渐降低,肿瘤细胞自噬活性增强,以维持肿瘤细胞内环境稳态。这与我们研究中胃癌细胞的mTOR低表达,ULK高表达及激活自噬有利于胃癌进展的结果一致。
p62是选择性自噬的底物,是一种泛素结合蛋白,有研究表明,p62表达上调和(或)低效降解与肿瘤的发生发展有关[12]。自噬缺陷会引起p62 持续表达,其高表达可以改变核因子KB(NF-KB)的调控和基因表达,从而表现出促癌作用[10]。结合研究结果,胃癌组织中检测到p62表达水平升高,而在癌旁及正常胃组织中的表达均较弱。p62可能通过提高上调细胞自噬水平,帮助肿瘤细胞在恶劣条件下存活并增殖,进而促进胃癌的病情进展。
雷帕霉素及氯喹均为自噬特异性抑制剂,雷帕霉素属于大环内酯类化合物,是 mTOR信号通路抑制剂,氯喹具有弱化溶酶体内酸性环境,稳定溶酶体膜的功能。实验通过观察在一定时间内不同浓度的雷帕霉素及氯喹分别作用于胃癌细胞后癌细胞抑制率的改变,发现其均可显著抑制胃癌细胞的生长,且具有明显的浓度依赖性。这与文献[13]中的研究结果相似,文献[13]中通过流式细胞术研究发现,雷帕霉素可将胃癌细胞周期阻滞在G0/G1期,并且使S期细胞比例降低,从而抑制肿瘤细胞的增殖。文献[14]中的研究提示氯喹抑制自噬活性后,可能通过激活p53蛋白以及灭活Bcl-2蛋白来诱导胃癌细胞启动程序性的死亡,引起 Caspase蛋白依赖的细胞凋亡,从而抑制肿瘤细胞的增殖。因此,结合我们的研究结果,认为细胞自噬可促进胃癌的发生,主要原因可能在于:在胃癌的发展过程中,癌细胞通过增强自噬活性,清除细胞中被损伤的蛋白和细胞器,为其提供满足自身生长及增殖所需的能量,维持存活及增殖。
综上所述,自噬相关蛋白mTOR、Beclin1、ULK、p62均参与了胃癌的发生,mTOR低表达及ULK、Beclin1、p62高表达可能与促进胃癌发生有密切关系,并提示自噬活性的增强可能促进了胃癌的发生及发展。
