肺金生方抗非小细胞肺癌EGFR-TKIs 耐药性的分子机制研究
2020-04-24高文仓
姚 成 高文仓
原发性肺癌(以下简称肺癌)是我国最常见的恶性肿瘤之一。根据国家癌症中心2018 年发布的数据显示,2014 年我国肺癌发病率约78.1 万,在男性恶性肿瘤居第1 位,女性恶性肿瘤第2 位[1]。而非小细胞肺癌(NSCLC)约占所有肺癌的85%[2]。人表皮生长因子受体(epidermal growth factor receptor,EGFR)为肺癌最常见的致病突变。靶向EGFR 的酪氨酸激酶抑制剂(TKIs)是目前临床治疗EGFR 致病突变NSCLC 患者的一线药物,在改善晚期NSCLC 患者总生存期和无进展生存期方面有突出作用[3]。然而EGFR-TKIs 同样存在耐药现象,临床上EGFR 基因突变的晚期NSCLC 在EGFR-TKIs 一线治疗约10个月后,通常会因获得性耐药而出现疾病进展[4]。在获得性耐药机制中,EGFR T790M 突变和酪氨酸蛋白激酶Met(c-MET)基因扩增占主要地位。Wang 等[5]研究发现,EGFR-TKIs 获得性耐药约20%是由c-MET 基因扩增及下游蛋白激酶B(AKT)和细胞外调节蛋白激酶(ERK1/2)激活引起的。因此,c-MET 是继EGFR、ALK 之后NSCLC 的又一分子治疗靶点。中医药是我国肿瘤治疗的重要手段之一。临床研究显示,中药配合EGFR-TKIs 治疗肺癌,能一定程度延长患者疾病无进展生存期[6-7]。肺金生方《金匮要略》以泽漆汤为基础,方中多种中药成分均有抗肿瘤作用[8-10]。本研究探讨肺金生方抗非小细胞肺癌EGFRTKIs 耐药性作用及分子机制。
1 实验材料
1.1 动物 BALB/c 裸鼠(SPF 级),雄性,6 周龄,20~25g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007—0005。本实验研究经浙江中医药大学附属第二医院动物实验伦理审核通过(批准编号:SYXK(浙)2018-0012)。
1.2 细胞株 人非小细胞肺癌HCC827 细胞株购自上海生命科学院细胞库(目录号SCSP-538)。
1.3 药物 肺金生方由泽漆、石见穿各30g,前胡10g,人参、桂枝、黄芩、半夏各9g,红豆杉8g,蜂房15g,生姜5g 组成,由浙江中医药大学附属第二医院中药房配置。加水浸泡30min 后,按汤剂常规方法煎熬,过滤并浓缩成含生药0.536g/mL 的药液,冷却后4℃保存。按照“人和动物之间按体表面积折算的等效剂量比值表”计算出裸鼠等效剂量,设置药物浓度为53.6g/kg。吉非替尼(商品名:易瑞沙,规格:0.25g,批号 701144)阿斯利康公司生产,加入0.9%注射用水,配置成1mg/mL 的吉非替尼混悬液。
1.4 试剂 RPMI-1640 培养基(批号12 633012)、0.25%胰酶(批号25 300054)、胎牛血清(批号10099),购自GIBCO 公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒(批号 556420),购自美国BD 公司;p-EGFR 单抗(批号ab40815),EGFR 单抗(批号ab40815),p-c-MET 单抗(批号ab5662),c-MET 单抗(批号ab 252205)抗体,购自美国abcam 公司;p-AKT 单抗(批号4060S),AKT 单抗(批号4685S),p-ERK 单抗(批号4370S),ERK 单抗(批号4695S)抗体,CST 公司;GAPDH 抗体,购自华安生物技术有限公司。
1.5 仪器 生物安全柜,-80℃超低温冰箱,细胞培养箱,液氮罐,Thermo fisher;SynergyMx M5 全波段多功能酶标仪,Molecular Devices;金属浴,杭州奥仟科技有限公司;低温超速离心机,Eppendorf;细胞计数仪Countstar,上海睿钰生物科技有限公司;ACEA NovoCyteTM 系列流式细胞仪,ACEA Biosciences;CFX-Touch 96 荧光定量PCR 仪,美国伯乐公司;Odyssey 红外激光双色图像分析系统。
2 实验方法
2.1 中药复方制备 将肺金生方药液在50℃煎煮2~5h,使1g 溶液含有5g 生药,冷冻干燥成粉。用0.9%生理盐水溶解,使用前离心5000 r/min,10min,0.22μm 微孔滤膜过滤,调节PH 值,制成体外细胞培养用的中药原液,保存在-20℃备用。
2.2 构建非小细胞肺癌吉非替尼耐药细胞株 人NSCLC 细胞株HCC827 接种于6 孔板中,在培养基中按0、0.001、0.01、0.1、1.0、10 和100μM 浓度梯度加入吉非替尼,以诱导筛选吉非替尼耐药细胞株。后续使用浓度为1.00μM 的吉非替尼维持细胞耐药性。CCK8 法检测正常HCC827 细胞株和耐药HCC827 GR 细胞株的IC50,应用荧光定量PCR 法检测c-MET 扩增效率。
2.3 构建皮下移植瘤模型 消化构建成功的吉非替尼耐药细胞株接种皮下移植瘤,以每只4×107/200μL注射后肢皮下。采用随机数字表法将20 只BALB/c裸鼠随机分成四组:空白对照组、吉非替尼组、肺金生方组和肺金生方+吉非替尼组,每组5 只。空白对照组给予生理盐水125μL 腹腔注射;吉非替尼组给予吉非替尼50mg/kg 灌胃及生理盐水125μL 腹腔注射;肺金生方组给予肺金生方剂量53.6g/kg 灌胃及生理盐水125μL 腹腔注射;肺金生方+吉非替尼组给予吉非替尼50mg/kg+肺金生方剂量53.6g/kg 联合灌胃给药,并生理盐水125μL 腹腔注射。给药频次设置为每2 天1 次,连续给药4 周。4 周后取出皮下移植瘤进行称重拍照。
2.4 CCK8 检测肺金生方和吉非替尼对耐药HCC827 GR 细胞增殖的作用 设置四组:空白对照组以完全培养液(RPMI-1640 培养液+10%胎牛血清)正常培养;吉非替尼组用完全培养液+终浓度为1μM 的吉非替尼;肺金生方组用完全培养基+肺金生方1mg/mL;肺金生方+吉非替尼组用完全培养基+吉非替尼1μM+肺金生方1mg/mL。培养48h 后,加入10μL CCK8 孵育2h 后,检测450nm 波长处吸光度值。
2.5 流式细胞仪检测肺金生方和吉非替尼对HCC827 GR 耐药细胞的作用 将HCC827 GR 细胞铺板于6 孔板中,设置四组:空白对照组用正常培养;吉非替尼组用终浓度为1μM 的吉非替尼;肺金生方组用肺金生方1mg/mL;肺金生方+吉非替尼组用吉非替尼1μM+肺金生方1mg/mL。培养24h 后,消化贴壁的细胞。调整细胞浓度为1×106,应用Annexin V-FITC(30μg/mL)/PI 染色后迅速上机检测。
2.6 Western Blot 检测吉非替尼和肺金生方对耐药HCC827 GR 细胞p-EGFR/p-MET/p-AKT/p-ERK 的作用 设置四组:空白对照组正常培养;吉非替尼组用终浓度为1μM 的吉非替尼;肺金生方组用肺金生方1mg/mL;肺金生方+吉非替尼组用吉非替尼1μM+肺金生方1mg/mL。用含0.1% FBS 的1640 饥饿培养基和对应的药物饥饿过夜,次日同时加入EGF(10ng/mL)和HGF(10ng/mL)刺激10min,检测EGFR、磷酸化EGFR(p-EGFR)、MET、磷酸化MET(p-MET)、AKT、磷酸化AKT(p-AKT)、ERK1/2、磷酸化ERK(p-ERK1/2)蛋白水平,GAPDH 作为内参。
2.7 统计学方法 应用GraphPad Prism 6 软件进行统计分析,计量资料均采用均数±标准差采用方差分析和t 检验,P<0.05 表示差异均有统计学意义。
3 结果
3.1 构建非小细胞肺癌吉非替尼耐药细胞株 CCK8检测结果显示,与对照组比较,吉非替尼诱导的耐药细胞株HCC827 GR 的细胞活力在吉非替尼浓度达到0.10、1.0μM 时明显高于正常HCC827 细胞,差异有统计学意义(P 均<0.01),同时吉非替尼在1.0μM时对正常HCC827 细胞具有明显的杀伤作用,但是对耐药细胞株HCC827 GR 的抑制作用明显降低,后续将使用浓度为1.0μM 的吉非替尼维持细胞耐药性。同时对正常和耐药HCC827 细胞株c-MET 表达水平进行mRNA 水平的鉴定,结果显示,耐药细胞株HCC827 GR 的c-MET 转录水平明显高于对照组,差异有统计学意义(P<0.01)。提示HCC827 吉非替尼耐药细胞株构建成功,同时该细胞株具有明显的c-MET 扩增。见表1-2。
表1 各组吉非替尼处理后细胞活力比较(%,±s)
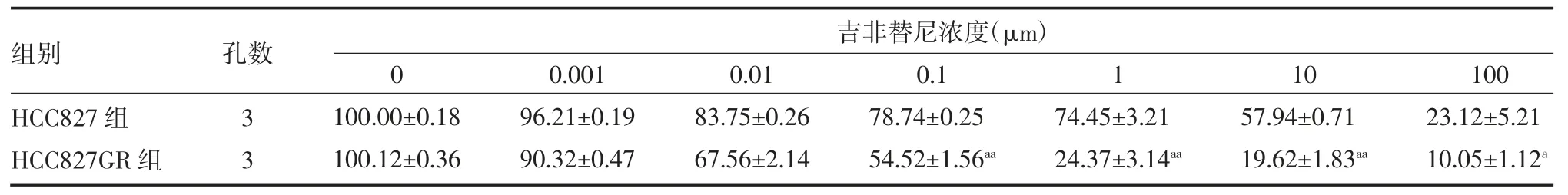
表1 各组吉非替尼处理后细胞活力比较(%,±s)
注:HCC827 组为人非小细胞肺癌对照组;HCC827GR 组为人非小细胞肺癌耐药组;与HCC827 组比较,aP<0.05,aaP<0.01
表2 各组吉非替尼处理后c-MET mRNA 相对表达水平比较(±s)
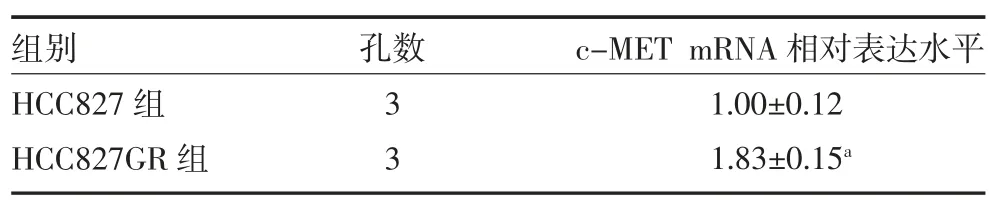
表2 各组吉非替尼处理后c-MET mRNA 相对表达水平比较(±s)
注:HCC827 组为人非小细胞肺癌对照组;HCC827GR 组为人非小细胞肺癌耐药组;与HCC827 组比较,aP<0.01
3.2 吉非替尼联用肺金生方对耐药HCC827 GR 细胞皮下移植瘤的作用 与空白对照组比较,吉非替尼组小鼠皮下移植瘤瘤重无差异(P>0.05),肺金生方处理组小鼠皮下移植瘤瘤重减轻,吉非替尼+肺金生方组小鼠皮下移植瘤重明显小于吉非替尼组及肺金生方组,差异有统计学意义(P<0.01)。见表3、图1。
表3 各组小鼠皮下移植瘤瘤重比较(g,±s)

表3 各组小鼠皮下移植瘤瘤重比较(g,±s)
注:空白对照组给予0.9%生理盐水腹腔注射;吉非替尼组给予吉非替尼50mg/kg 灌胃及生理盐水腹腔注射;肺金生方组给予肺金生方剂量53.6g/kg 灌胃及生理盐水腹腔注射;吉非替尼+肺金生方组给予吉非替尼50mg/kg+肺金生方剂量53.6g/kg 联合灌胃,并生理盐水腹腔注射;与空白对照组比较,aP<0.01;与吉非替尼组比较,bP<0.05,bbP<0.01;与肺金生方组比较,cP<0.01
3.3 吉非替尼联用肺金生方对耐药HCC827 GR 细胞增殖的影响 与空白对照组比较,肺金生方组和吉非替尼+肺金生方组明显降低耐药HCC827 GR 细胞的增殖能力,差异有统计学意义(P 均<0.01)。增殖能力:吉非替尼+肺金生方组<肺金生方组<吉非替尼组<对照组。见表4。
3.4 吉非替尼联用肺金生方对耐药HCC827 GR 细胞早期凋亡的影响 与空白对照组比较,吉非替尼组、肺金生方组以及吉非替尼+肺金生方组细胞的凋亡明显增加。凋亡率:空白对照组(3.05±0.54)%<吉非替尼组(7.38±0.45)%<肺金生方组(7.40±0.56)%<吉非替尼+肺金生方组(12.80±0.72)%。见图2。
表4 各组细胞增殖率比较(%,±s)

表4 各组细胞增殖率比较(%,±s)
注:空白对照组给予腹腔注射0.9%生理盐水;吉非替尼组给予吉非替尼50mg/kg 灌胃及0.9%生理盐水腹腔注射;肺金生方组给予肺金生方剂量53.6g/kg 灌胃及0.9%生理盐水腹腔注射;吉非替尼+肺金生方组给予吉非替尼50mg/kg+肺金生方剂量53.6g/kg 联合灌胃,并生理盐水腹腔注射;与空白对照组比较,aP<0.01;与吉非替尼组比较,bP<0.01
3.5 吉非替尼联用肺金生方对耐药HCC827 GR 细胞p-EGFR/p-MET/p-AKT/p-ERK 的作用 与空白对照组比较,吉非替尼组略微降低EGFR 磷酸化信号,但是并不能明显影响p-c-MET 以及下游信号p-AKT/p-ERK1/2 信号。肺金生方组和吉非替尼+肺金生方组c-MET 和p-c-MET 的水平明显降低,同时下游p-AKT/p-ERK1/2 水平也明显降低。GAPDH 作为内参。见图3。
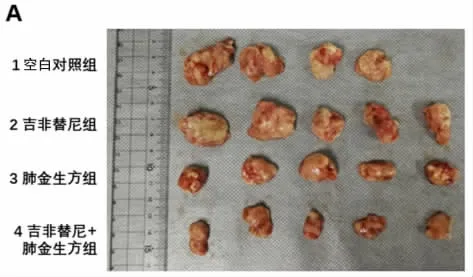
图1 肺金生方联用吉非替尼对吉非替尼耐药皮下移植瘤的作用
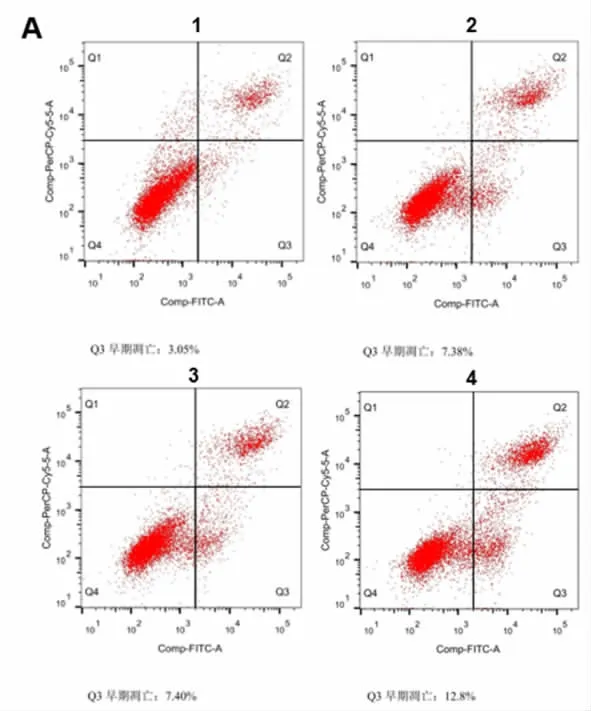
图2 肺金生方联用吉非替尼对耐药细胞早期凋亡的影响
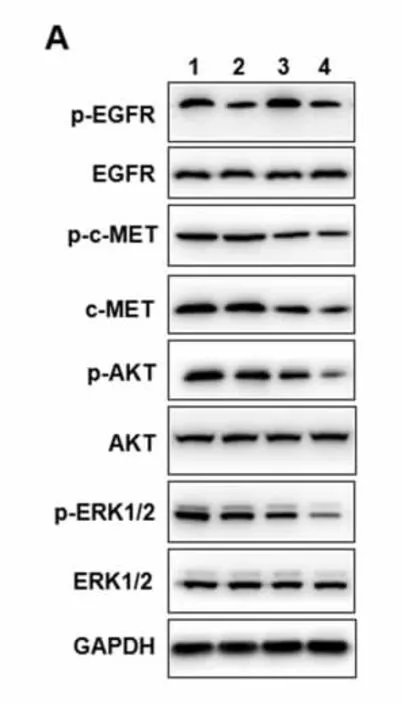
图3 药物联用对耐药细胞株p-EGFR/p-MET/p-AKT/p-ERK1/2 的作用
4 讨论
尽管通过引入EGFR-TKIs 治疗晚期NSCLC EGFR 基因突变患者的临床结果有所改善,但是由于内在或获得性耐药的发生,预后仍然较差。研究发现,HGF/c-MET 信号通路的异常激活是EGFR-TKIs产生耐药的一个重要原因,约占NSCLC 患者中EGFR-TKIs 获得性耐药的20%[11-13]。肺金生方的多种主要组分在抗肿瘤中发挥着重要的作用[14-17]。而目前关于肺金生方方剂抗EGFR-TKIs 耐药的研究尚未见报道。本研究结果显示,诱导耐药株存在明显的c-MET 扩增。本研究结果还显示吉非替尼组皮下移植瘤和空白对照组比较无明显减轻,说明该移植瘤确实产生了吉非替尼耐药。肺金生方组移植瘤瘤重明显较空白对照组减轻,证明肺金生方能够抑制吉非替尼耐药的皮下移植瘤的生长。吉非替尼+肺金生方组皮下移植瘤瘤重明显较空白对照组和吉非替尼组减轻,再次说明肺金生方能逆转吉非替尼耐药的表型。体外实验结果显示,肺金生方和吉非替尼联用明显抑制吉非替尼耐药诱导的细胞增殖,并诱导细胞凋亡。HGF/c-MET 诱导EGFR-TKIs 获得性耐药的分子机制为c-MET 扩增与异常活化,以及下游AKT和ERK1/2 磷酸化。本研究结果显示,肺金生方能明显抑制吉非替尼耐药导致的c-MET 扩增以及下游AKT 和ERK1/2 的磷酸化,两药联用后效果更明显。肺金生方可能通过抑制HGF 受体c-MET 蛋白表达及活化,从而抑制HGF/c-MET 信号通路的异常激活诱导的吉非替尼耐药。
