三阴性乳腺癌患者RGS20 mRNA表达水平及与临床预后的关系分析
2020-04-24吕以东李莹张彦武牛耀东严文君王璐冯爱强
吕以东 ,李莹 ,张彦武 ,牛耀东 ,严文君 ,王璐 ,冯爱强
(1.郑州大学第三附属医院乳腺科,河南 郑州450052;2.郑州大学第三附属医院检验科分子遗传实验室,河南 郑州 450052)
乳腺癌是女性中最为常见的恶性肿瘤,有极高的发病率,且其病死率仅次于肺癌[1]。三阴性乳腺癌是一种特殊亚型的乳腺癌,其癌组织免疫组化检测雌激素受体、孕激素受体和原癌基因Her-2均为阴性,是一种侵袭性恶性肿瘤,转移几率较其他类型乳腺癌高[2]。现代流行病学显示三阴性乳腺癌预后较差,死亡风险很高,因此探索有效的分子靶基因对三阴性乳腺癌早期诊断和治疗有十分重大的意义[3]。G蛋白信号转导调控因子20(RGS20)是GTP酶激活因子,参与G蛋白偶联受体蛋白信号转导途径,调节细胞功能活动,但RGS20对三阴性乳腺癌预后的研究较少,本研究旨在通过分析RGS 20表达与三阴性乳腺癌临床病理特征和生存情况的关系,拟寻求三阴性乳腺癌潜在的分子靶点。
1 资料与方法
1.1 一般资料 收集2013年6月-2015年6月入院治疗三阴性乳腺癌的患者82例临床资料,年龄33~67 岁,平均(52.67±9.21)岁,均为女性,肿瘤>5cm 13例,≤5cm 69例,浸润性导管癌37例、浸润性小叶癌6例、其他浸润性39例,淋巴结转移33例、无转移49例,临床分期Ⅰ-Ⅱ期58例、Ⅲ-Ⅳ期24例。采集患者乳腺癌组织和相应癌旁组织(癌距<3cm),所有患者乳腺癌组织病理检测确诊为三阴性乳腺癌(ER阴性,PR阴性,HER-2阴性)[4],排除其他恶性肿瘤,首次就诊,术前均为接受其他放化疗,无重要器官疾病,患者签署知情同意书,本研究已通过医院伦理委员会批准。
1.2 qRT-PCR检测患者乳腺癌组织和癌旁正常组织中RGS20 mRNA的表达 取适量组织样品于1mL Trizol裂解液中匀浆,充分裂解15min,于-80℃保存备用。采用氯仿-异丙醇体系提取总RNA,参照逆转率试剂盒说明书将RNA逆转录为cDNA。按照SYBR PremixEX Taq试剂盒说明书进行qRT-PCR扩增,检测样品组织中GADPH、RGS20 mRNA的表达,程序设置参数为:95℃ 5min,94℃10s,65℃ 50s,70℃ 2min,38 个循环。 以 GADPH mRNA的表达量为内参,计算RGS20 mRNA的相对表达量,独立重复3次以上,引物序列[5]见表1。
1.3 免疫组化检测三阴性乳腺癌患者乳腺癌组织中RGS20的表达 取出组织标本烤蜡处理1h,二甲苯溶液脱蜡后酒精梯度水化,滴加3%过氧化氢溶液灭活,25℃孵育15min,置于枸橼酸缓冲液中进行抗原修复,加热状态孵育10min,滴加RGS20一抗,4℃孵育过夜,滴加二抗,37℃孵育 30min,滴加DAB工作液避光孵育4min,苏木素复染10s,酒精梯度脱水后滴加二甲苯至透明,封片;于显微镜下随机选取5个视野观察。
RGS20阳性染色定位于胞浆,着色程度评分规则:棕褐色计3分,棕黄色计2分,浅黄色计1分,未着色计0分;着色细胞比例评分规则:大于75%计 4分,51%~74%计3分,26%~50%计2分,6%~25%计1分,小于5%计0分,最终得分为着色程度评分与着色细胞比例评分乘积,0~12分,其中0~4分评定为阴性表达,5~12分为阳性表达。以上评分过程由3位病理科高级医师独立进行,最终以均值作为结果。
1.4 病例随访 随访截止至2018年6月30日,确保每位患者随访时间达到36个月,随访形式为:复诊、上门、电话等。术后1年内,1次/月;术后第2年,1次/季;术后第3年,1次/半年。随访内容为:了解患者无疾病生存期 (Disease Free Survival,DFS)、总生存期(Overall Survival,OS)和死亡原因。 DFS指患者首次治疗到有疾病复发或疾病致死的时间间隔,OS指患者首次治疗到任何原因致死的时间间隔,随访截止日期仍存活的患者以截止时间生存情况为准。
1.5 统计学方法 本研究数据采用SPSS 20.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,组间采用t检验;计数资料以率(%)表示,组间采用卡方(χ2)检验;等级资料行秩和检验;采用Kaplan-Meier法分析生存率,生存期限比较采用Lo g-rank χ2法检验,以P<0.05表示差异具有统计学意义。

表1 基因GADPH和RGS20的引物序列
2 结果
2.1 患者组织中RGS20mRNA的表达 如图1所示,三阴性乳腺癌患者癌组织中RGS20mRNA的表达 显著高于癌旁组织(P<0.05)。
2.2 患者组织中RGS20的表达 RGS20在三阴性乳腺癌细胞中定位于胞浆,显微镜下表现为胞浆呈黄棕色或黄褐色,如图2。三阴性乳腺癌患者癌旁组织中RGS20的阳性表达率为15.85%(13/81);而乳腺癌组织中为68.29%(56/81),显著高于癌旁组织(P<0.05),见表 2。

图1 患者组织中RGS20mRNA的表达

图2 RGS20在三阴性乳腺癌细胞中阳性染色定位(免疫组化×400)

表2 患者组织中RGS20的表达
2.3 患者癌组织中RGS20表达与临床特征的关系三阴性乳腺癌患者不同淋巴结的转移情况、临床分期及Ki67百分比等临床病理特征中RGS20的表达表现出显著性差异(P<0.05),而不同年龄、肿瘤大小以及病理分类患者中RGS20的表达无明显差异(P>0.05),见表 3。
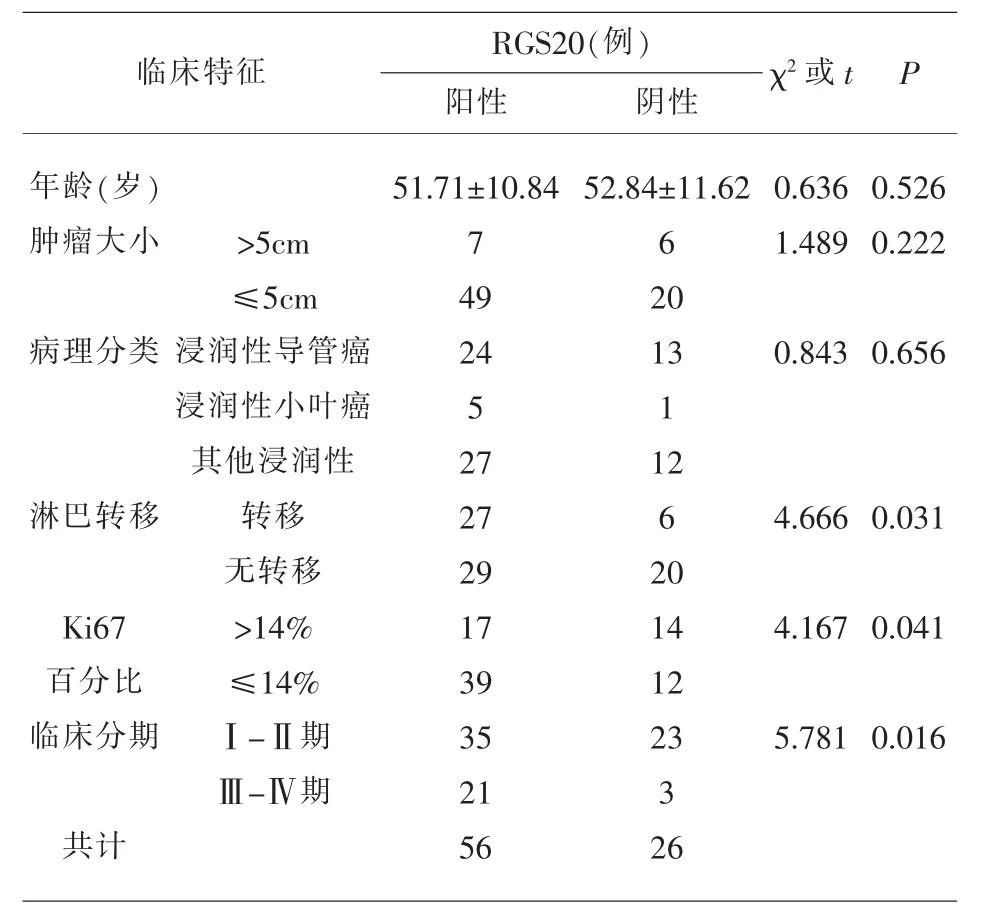
表3 患者癌组织中RGS20表达与临床特征的关系
2.4 患者癌组织中RGS20表达与生存情况的关系如图3,Kaplan-Meier曲线显示阳性表达RGS20的三阴性乳腺癌患者3年DFS为42.86%,3年OS为55.36%;阴性表达RGS20患者3年DFS为65.39%,3年OS为80.77%。阳性表达pS6K1患者3年DFS和OS均显著低于阴性表达患者 (Logrank χ2=3.904、4.957,P=0.048、0.026)。

图3 患者癌组织中RGS20表达与生存情况的关系
3 讨论
三阴性乳腺癌病情发展较快,肿瘤负荷大且复发早转移高,严重威胁到女性生命健康[6]。其发病机制尚不明确,研究表明三阴性乳腺癌多发于绝经前年轻女性,目前并没有针对三阴性乳腺癌的治疗指南,主要以化疗为主,化疗治疗三阴性乳腺癌有效率很高,但是化疗药物选择性差,容易产生不良反应,且预后差[7]。随着对癌症的深入研究,新型辅助化疗药物紫杉类、铂类等对三阴性乳腺癌有一定的疗效,但只有部分患者较敏感,能够起到疗效且有良好的预后[8,9],故寻求出三阴性乳腺癌的肿瘤标记物对于三阴性乳腺癌的诊断和治疗有着极其重要的意义。G蛋白偶联受体家族是一种细胞表面受体,参与细胞增殖、存活、运动等过程,并与肿瘤的生长、血管的生存和转移有关[10]。G蛋白信号调节蛋白是Gα亚基GTP酶活性增敏剂,可以放大GTP酶活性,是G蛋白偶联受体蛋白信号转导途径中重要因子[11]。G蛋白偶联受体蛋白信号转导途径主要有:⑴受体-G蛋白-Ac途径,参与细胞分泌,肌细胞收缩,细胞通透性调节及胞内各种酶促反应;⑵受体-G蛋白-PLC途径,参与调节细胞一系列生物效应[12,13]。G蛋白信号调节蛋白在多种癌细胞中有不同程度的表达,与肿瘤的发生发展密切相关,据报道RGS20基因低表达的Luminal型乳腺癌患者预后较好[14],但RGS20的表达与三阴性乳腺癌临床病理特征及生存时间的研究较少。
本研究通过qRT-PCR法和免疫组化法检测到三阴性乳腺癌患者乳腺癌组织中RGS20的表达显著高于癌旁正常组织,表明RGS20的表达能反映出肿瘤的进展,可为肿瘤的早期治疗提供指导。Ki67是一种增殖细胞相关的核抗原,参与细胞有丝分裂过程,研究显示浸润型乳腺癌中Ki67与癌细胞增殖和侵袭转移密切相关,常作为肿瘤细胞增殖标记物[15,16]。通过分析三阴性乳腺癌患者临床病理特征与RGS20表达的关系,发现有淋巴转移、Ki67百分比>14%及临床分期为Ⅲ-Ⅳ期的患者RGS20阳性表达分别显著高于无淋巴转移、Ki67百分比≤14%及临床分期为Ⅰ-Ⅱ期的患者,揭示RGS 20高表达可能会提高癌细胞增殖能力和运动能力;而不同年龄、肿瘤大小和病理类型患者中RGS20阳性表达无显著差异,揭示RGS20可能是一种新型的肿瘤靶点。随访36个月发现,阳性表达RGS20的三阴性乳腺癌患者3年DFS为42.86%,3年OS为55.36%;而阴性表达RGS20患者3年DFS为65.39%,3年OS为80.77%,表明RGS20阳性表达的三阴性乳腺癌患者生存时间更短,预后较差。
综上所述,RGS20与三阴性乳腺癌的发生发展密切相关,揭示RGS20可作为三阴性乳腺癌的潜在肿瘤标记物,有助于三阴性乳腺癌的早期诊断和预后评估,为进一步研究三阴性乳腺癌发病机制提供新的研究方向。后续还可继续探讨RGS20在其他类型乳腺癌中的表达情况及与临床预后的关系。
